Trvalý karben - Persistent carbene

A perzistentní karben (také známý jako stabilní karben) je typ karben prokazující zvláštní stabilitu. Nejznámějšími příklady a zdaleka největší podskupinou jsou N-heterocyklické karbeny (NHC)[1] (někdy nazývané Arduengo karbeny), například diaminokarbeny obecného vzorce (R2N)2C:, kde 'R jsou typicky alkylové a arylové skupiny. Skupiny lze spojit a dát heterocyklický karbeny, jako jsou ty odvozené od imidazol, imidazolin, thiazol nebo triazol.
Karbeny jsou tradičně považovány za tak reaktivní, že byly studovány pouze nepřímo, např. zachycením reakcí. Tato situace se dramaticky změnila se vznikem perzistentních karbenů. I když jsou to docela reaktivní látky, tj. Podstupující dimerizace, mnohé lze izolovat jako čisté látky.
Trvalé karbeny mohou existovat v tílko nebo stavy tripletů přičemž karbeny singletového stavu jsou stabilnější. Relativní stabilita těchto sloučenin je způsobena pouze částečně sterická překážka objemnými skupinami. Některé singletové karbeny jsou termodynamicky stabilní při nedostatku vlhkosti a (ve většině případů) kyslík a lze je izolovat a neomezeně dlouho ukládat. Ostatní se během dnů pomalu dimerizují. Karbeny ve stavu tripletů mají poločasy měřeno v sekundách, a proto je lze pozorovat, ale ne uložit.
Dějiny
Včasné důkazy
V roce 1957 Ronald Breslow navrhl, že relativně stabilní nukleofilní carbene, a thiazol-2-yliden derivát, byl zapojen do katalytický cyklus z vitamin B1 (thiamin), který se získá furoin z furfural.[2][3] V tomto cyklu jsou vitamíny thiazolium kruh zaměňuje atom vodíku (navázaný na uhlík 2 kruhu) za furfuralový zbytek. v deuterovaná voda, C2-proton bylo zjištěno, že rychle vyměnit za deuteron ve statistice rovnováha.[4]
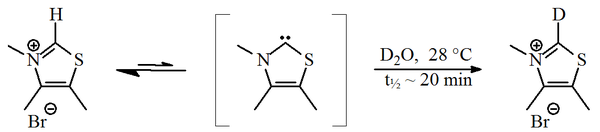
Tato výměna byla navržena tak, aby probíhala prostřednictvím prostředku thiazol-2-yliden. V roce 2012 došlo k izolaci tzv Breslow meziprodukt bylo nahlášeno.[5][6]
V roce 1960 Hans-Werner Wanzlick a spolupracovníci se domnívali, že z nich pochází karbeny dihydroimidazol-2-yliden byly vyrobeny vakuová pyrolýza odpovídajícího 2-trichlormethylu dihydroimidazol sloučeniny se ztrátou chloroform.[7][8][9] Domnívali se, že karben existuje v rovnováze s jeho dimer, a tetraaminoethylen derivát, tzv Wanzlickova rovnováha. Tuto domněnku zpochybnil Lemal a spolupracovníci v roce 1964, kteří předložili důkazy, že dimer nedisocioval;[10] a Winberg v roce 1965.[11] Následné experimenty Denka, Herrmanna a dalších však tuto rovnováhu potvrdily, i když za konkrétních okolností.[12][13]
Izolace perzistentních karbenů
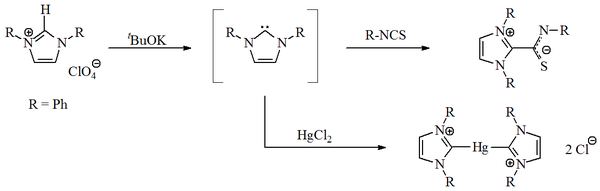
V roce 1970 Wanzlickova skupina vytvořila imidazol-2-ylidenkarbeny deprotonací imidazolium sůl.[14] Wanzlick i [Roald Hoffmann],[9][15] navrhuje, aby tyto karbeny na bázi imidazolu byly stabilnější než jejich 4,5-dihydro analogy, kvůli Hückelovu typu aromatičnost. Wanzlick však neizoloval imidazol-2-ylidenes, ale místo toho jejich koordinační sloučeniny s rtuť a isothiokyanát:
V roce 1988 Guy Bertrand a další izolovali a fosfinokarbenu. Tyto druhy mohou být reprezentovány buď jako λ3-fosfinokarbon nebo λ5-fosfacetylen:[16][17]

Tyto sloučeniny byly nazývány „push-pull karbeny“ ve srovnání s kontrastními elektronovými afinitami atomů fosforu a křemíku. Vykazují jak karbenické, tak alkynic reaktivita. Rentgenová struktura této molekuly nebyla získána a v době publikace zůstaly určité pochybnosti o jejich přesné karbenické povaze.
V roce 1991 získal Arduengo a spolupracovníci stabilní, izolovaný a krystalický diaminokarben, který lze představit jako karben nebo yl-dusík-uhlík.[18] podle deprotonace imidazoliumchloridu se silnou bází:

Bylo zjištěno, že tento karben, předchůdce velké rodiny karbenů s jádrem imidazol-2-yliden, je při pokojové teplotě (za nepřítomnosti kyslíku a vlhkosti) neomezeně stabilní a taje při 240–241 ° C bez rozkladu. Další zajímavou chemickou vlastností této ylidové sloučeniny byla charakteristická rezonance v 13C NMR spektrum při 211 ppm pro karbenový atom.[19] The rentgen struktura[20] odhalilo delší N – C délky vazby v kruhu karbenu než v původní sloučenině imidazolia, což naznačuje, že jich bylo velmi málo dvojná vazba charakter těchto vazeb.
První na vzduchu stabilní ylidový karben, chlorovaný člen rodiny imidazol-2-yliden, byl získán v roce 1997.[21]
V roce 2000 získal Bertrand další karbeny fosfanylového typu, včetně (fosfanyl) (trifluormethyl) karbenu, stabilního v roztoku při -30 ° C[22] a středně stabilní (amino) (aryl) karben s pouze jedním heteroatomem sousedícím s karbenickým atomem.[23][24]
Faktory ovlivňující stabilitu heteroatomem stabilizovaných karbenů

(externí prohlížeč )
Stabilita karbenu Arduengo byla původně přičítána objemnému N-adamantyl substituenty, které zabraňují dimerizaci karbenu v důsledku sterická překážka. Nahrazení N-adamantylových skupin methyl Skupiny také poskytují stabilní NHC.[25] Imidazol-2-ylidenes tedy jsou termodynamicky stabilní.
Rovněž se předpokládalo, že dvojná vazba mezi uhlíky 4 a 5 základního řetězce imidazolového kruhu, která tomuto systému dala aromatický charakter, byla důležitá pro stabilitu karbenu. Tato domněnka byla vyvrácena v roce 1995 skupinou Arduenga, která získala derivát dihydroimidazol-2-yliden, chybí dvojná vazba.[26] Termodynamická stabilita v této sloučenině a role sterické ochrany v prevenci dimerizace byla předmětem některých sporů.[27][28]

První acyklický perzistentní karben byl hlášen v roce 1996,[29] což ukazuje, že cyklická páteř není pro jejich stabilitu nutná. Na rozdíl od cyklických derivátů jsou acyklické karbeny flexibilní, pokud jde o rotaci vazeb na karbenový atom. Měřením překážka rotace těchto dluhopisů, rozsah jejich dvojná vazba znak lze měřit a ylidová lze určit povahu tohoto karbenu. Stejně jako cyklické diaminokarbeny mají nerušené varianty tendenci dimerizovat.[28][30][31]
Většina perzistentních karbenů je stabilizována dvěma sousedícími centry dusíku. Aminothiokarbeny a aminooxykarbeny jsou odlehlé hodnoty.[32] a [33]. V těchto stabilních sloučeninách leží karbenový atom mezi atomem dusíku a buď a síra nebo atom kyslíku:
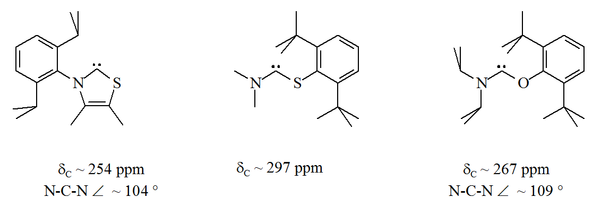
Na rozdíl od NHC nejsou tyto karbeny termodynamicky stabilní, ale mají sklon k dimerizaci.
v bis (diisopropylamino) cyklopropenyliden, který je stabilní při pokojové teplotě, je atom karbenu připojen ke dvěma atomům uhlíku, ve tříčlenném kruhu, který si zachovává aromatičnost a geometrii cyklopropenyliden prsten. Tento příklad prokázal, že ani přítomnost heteroatomů vedle karbenu není pro stabilitu nutná.[34]
Třídy stabilních karbenů
Následují příklady dosud stabilních tříd stabilních karbenů:
Imidazol-2-yliden
První stabilní karbeny, které se izolovaly, byly založeny na imidazol kruh, s odstraněným vodíkem na uhlíku 2 kruhu (mezi dvěma atomy dusíku), a další vodíky nahrazeny různými skupinami. Tyto imidazol-2-ylidenes jsou stále nejstabilnější a nejlépe studovanou a chápanou rodinou perzistentních karbenů.
Bylo syntetizováno značné množství imidazol-2-ylidenů, včetně těch, ve kterých byly 1,3-polohy funkcionalizovány alkyl, aryl,[25] alkyloxy, alkylamino, alkylfosfino[35] a dokonce chirální substituenty:[35]
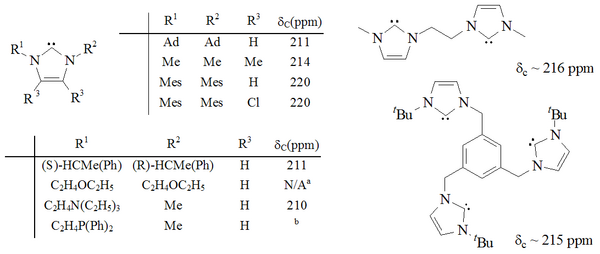

(externí prohlížeč )
Zejména střídání dvou chlór atomy pro dva vodíky v polohách kruhů 4 a 5 poskytly první na vzduchu stabilní karben.[21] Jeho další stabilita pravděpodobně vyplývá z výběr elektronů účinek chlór substituenty, které snižují elektronová hustota na atomu uhlíku nesoucím osamělý pár, přes indukce přes páteř sigma.
Byly také syntetizovány molekuly obsahující dvě a dokonce tři imidazol-2-ylidenové skupiny.[36][37]
Karbeny na bázi imidazolu jsou termodynamicky stabilní a obecně mají diagnostické vlastnosti 13Hodnoty chemického posunu C NMR pro karbenický uhlík mezi 210–230 ppm. Rentgenové struktury těchto molekul obvykle vykazují vazebné úhly N-C-N 101–102 °.
Triazol-5-ylidenes
Další rodina perzistentních karbenů je založena na 1,2,4-triazol prsten s nevyplněnými orbitaly na uhlíku 5 tohoto prstence. The triazol-5-ylidenes níže zobrazené obrázky byly nejprve připraveny Endersem a spolupracovníky[38] podle vakuová pyrolýza ztrátou methanolu z 2-methoxytriazolů. Bylo popsáno pouze omezené rozmezí těchto molekul, přičemž trifenylem substituovaná molekula je komerčně dostupná.
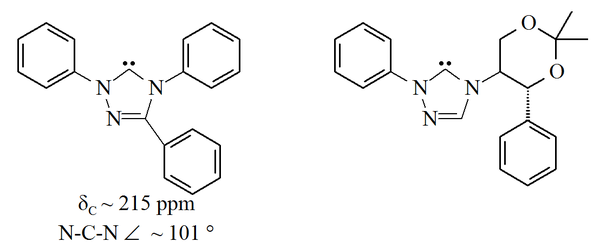
Triazol karbeny založené na bázi jsou termodynamicky stabilní a mají diagnostiku 13Hodnoty chemického posunu C NMR pro karbenický uhlík mezi 210–220 ppm. Rentgenová struktura výše uvedeného trifenylem substituovaného karbenu vykazuje úhel vazby N-C-N asi. 101 °. Prekurzor 5-methoxytriazolu tohoto karbenu byl vyroben zpracováním triazoliové soli s methoxidem sodným, který útočí jako nukleofil.[38] To může naznačovat, že tyto karbeny jsou méně aromatické než imidazol-2-yliden, protože prekurzory imidazolia nereagují s nukleofily kvůli výsledné ztrátě aromatičnosti.
Ostatní diaminokarbeny
Dvě výše uvedené rodiny lze považovat za zvláštní případy širší třídy sloučenin, které mají karbenový atom překlenující dva atomy dusíku. Řadu takových diaminokarbenů připravila v zásadě Roger Olše výzkumná skupina. V některých z těchto sloučenin je jednotka N-C-N členem 5 nebo 6 členného nearomatického kruhu,[26][27][39] včetně bicyklického příkladu. V dalších příkladech jsou sousední dusíky připojeny pouze prostřednictvím karbenového atomu a mohou nebo nemusí být součástí samostatných kruhů.[29][30][31]

Na rozdíl od aromatických imidazol-2-ylidenů nebo triazol-5-ylidenů se tyto karbeny nezdají být termodynamicky stabilní, jak ukazuje dimerizace některých neomezených cyklických a acyklických příkladů.[27][30] Studie[28] naznačují, že tyto karbeny dimerizují prostřednictvím dimerizace katalyzované kyselinou (jako v Wanzlickova rovnováha ).
Diaminokarbeny mají diagnostiku 13Hodnoty chemického posunu C NMR pro karbenový atom mezi 230–270 ppm. Rentgenová struktura dihydroimidazol-2-yliden vykazuje úhel vazby N-C-N asi. 106 °, zatímco úhel acyklického karbenu je 121 °, oba jsou větší než úhly pozorované u imidazol-2-ylidenů.
Heteroamino karbeny
Nahoře existuje několik variant stabilních karbenů, kde jeden z atomů dusíku sousedí s centrem karbenu (dále α nitrogeny) byl nahrazen alternativním heteroatomem, jako je kyslík, síra nebo fosfor.[16][17][32][33]
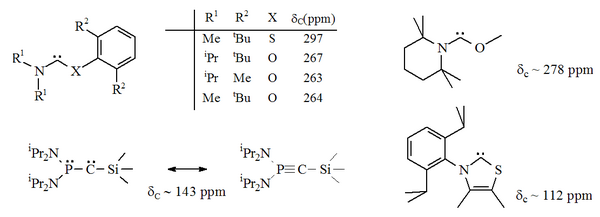
Zejména formální substituce síry za jeden z atomů dusíku v imidazolu by poskytla aromatickou heterocyklickou sloučeninu thiazol. Karben na bázi thiazolu (analogický s karbenem předpokládaným Breslowem)[40] byl připraven a charakterizován rentgenovou krystalografií.[32] Byly připraveny další nearomatické aminokarbeny s atomy O, S a P sousedícími (tj. Alfa) se středem karbenu, např. thio- a oxyiminium karbeny na bázi byly charakterizovány rentgenovou krystalografií.[33]
Od té doby kyslík a síra jsou dvojmocný, sterický ochrana karbenového centra je omezena, zejména když je jednotka N-C-X součástí kruhu. Tyto acyklické karbeny mají diagnostiku 13Hodnoty chemického posunu C NMR pro karbenový uhlík mezi 250–300 ppm, dále směrem dolů než u jiných typů stabilního karbenu. Rentgenové struktury ukázaly vazebné úhly N-C-X ca. 104 °, respektive 109 °.
Karbeny, které formálně pocházejí z imidazol-2-ylidenů substitucí síry, kyslíku nebo jiných látek chalkogeny pro oba α-nitrogeny se očekávají nestabilní, protože mají potenciál disociovat na alkyn (R.1C≡CR2) a uhlík dichalkogenid (X1= C = X2).[Citace je zapotřebí ]
Neaminokarbeny
Reakce sirouhlík (CS2) s nedostatkem elektronů acetylén deriváty se navrhuje poskytnout přechodné 1,3-dithiolium karbeny (tj. kde X1 = X2 = S), které pak dimerizují za vzniku derivátů tetrathiafulvene. Je tedy možné, že u podobných karbenů může dojít k obrácení tohoto procesu.[41][42]
Bertrandovy karbeny
V Bertrandových perzistentních karbenech je nenasycený uhlík vázán na a fosfor a a křemík.[43] Zdá se však, že tyto sloučeniny vykazují určité alkynické vlastnosti, a když byly zveřejněny, byla diskutována přesná karbenická povaha těchto červených olejů.[17]
Jiné nukleofilní karbeny
Jeden stabilní N-heterocyklický karben[44] má strukturu analogickou k borazin s jedním bór atom nahrazen a methylenová skupina. To má za následek planární 6-elektronovou sloučeninu.
Cyklopropenylidenes
Další rodina karbenů je založena na a cyklopropenyliden jádro, kruh se třemi uhlíky s dvojnou vazbou mezi dvěma atomy sousedícími s karbenickým. Příkladem této rodiny je bis (diisopropylamino) cyklopropenyliden.[34]
Karbeny ve stavu tripletů
V roce 2001 Hideo Tomioka a jeho spolupracovníci byli schopni produkovat poměrně stabilní triplet karben (bis (9-anthryl) karben, s poločasem 19 minut), využitím elektronová delokalizace.[45][46]

V roce 2006 byla trojicí karbenu hlášena stejnou skupinou s a poločas rozpadu 40 minut.[47] Tento karben je připraven a fotochemické rozklad a diazomethan předchůdce o 300 nanometr světlo v benzenu s vyloučením dusík plyn.
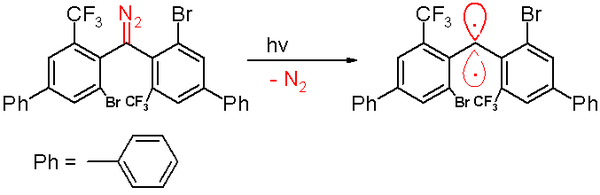
Expozice kyslíku (triplet diradical) převádí tento karben na odpovídající benzofenon. Difenylmethanová sloučenina vzniká, když je zachycena cyklohexa-l, 4-dien. Stejně jako u ostatních karbenů obsahuje tento druh velké objemné substituenty, a to bróm a trifluormethylové skupiny na fenylových kruzích, které chrání karben a zabraňují nebo zpomalují proces dimerizace na 1,1,2,2-tetra (fenyl) alken. Na základě počítačové simulace, vzdálenost atomu dvojmocného uhlíku jeho sousedům se tvrdí, že je 138 pikometry s úhel vazby 158,8 °. Roviny fenylových skupin jsou navzájem téměř v pravém úhlu ( vzepětí úhel 85,7 °).
Mesoionické karbeny
Mesoionické karbeny (MIC) jsou podobné N-heterocyklickým karbenům (NHC), kromě toho, že kanonické rezonanční struktury se zobrazeným karbenem nelze nakreslit bez přidání dalších poplatků. Mezoionické karbeny se také označují jako abnormální N-heterocyklické karbeny (aNHC) nebo vzdálené N-heterocyklické karbeny (rNHC). Lze izolovat různé volné karbeny, které jsou stabilní při teplotě místnosti. Jiné volné karbeny nejsou stabilní a jsou citlivé na dráhy mezimolekulárního rozkladu.
Chemické vlastnosti
Bazicita a nukleofilita
Imidazol-2-ylidenes jsou silné báze, které mají a pKa ca. 24 pro konjugovanou kyselinu v dimethylsulfoxid (DMSO):[48]

Další práce však ukázaly, že diaminokarbeny deprotonují rozpouštědlo DMSO, přičemž výsledný anion reaguje s výslednou amidiniovou solí.
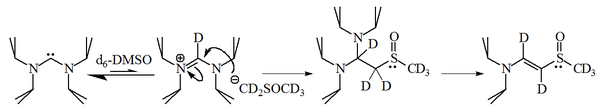
Reakce imidazol-2-ylidenů s 1-bromhexan dalo 90% 2-substituovaného aduktu, pouze 10% odpovídajícího alken, což naznačuje, že tyto molekuly jsou také rozumně nukleofilní.
Hodnoty pKa pro konjugované kyseliny několika rodin NHC byly zkoumány ve vodném roztoku. Hodnoty pKa triazoliových iontů se pohybují v rozmezí 16,5 - 17,8,[49] asi o 3 pKa jednotky kyselější než příbuzné imidazoliové ionty.[50]
Dimerizace
Najednou se předpokládalo, že stabilní karbeny jsou reverzibilní dimerizovat prostřednictvím tzv Wanzlickova rovnováha. Imidazol-2-ylidenes a triazol-5-ylidenes jsou však termodynamicky stabilní a nemerizují a byly skladovány v řešení při nedostatku vody a vzduchu po celá léta. To je pravděpodobně způsobeno aromatický povaha těchto karbenů, která se při dimerizaci ztrácí. Ve skutečnosti jsou imidazol-2-ylideny tak termodynamicky stabilní, že pouze ve velmi omezených podmínkách jsou tyto karbeny nuceny dimerizovat.
Chen a Taton[51] vyrobil dvakrát vázaný diimidazol-2-yliden podle deprotonovat příslušná diimidazolová sůl. Pouze deprotonace dvojitě vázané diimidazoliové soli s kratší methylenový můstek (-CH2-) vedlo k dimeru dikarbenu:

Pokud tento dimer existoval jako dikarbon, elektron osamělé páry na karbenickém uhlíku by byl přinucen do těsné blízkosti. Pravděpodobně výsledný odpudivý elektrostatický interakce by měly významný destabilizační účinek. Aby se zabránilo této elektronické interakci, karben jednotky dimerizují.
Na druhé straně, heteroaminokarbeny (např. R2N-C: -OR nebo R2N-C: -SR) a nearomatické karbeny, jako jsou diaminokarbeny (např. R2N-C: -NR2) bylo prokázáno, že dimerizují,[52] i když docela pomalu. Předpokládá se, že to bylo způsobeno vysokou bariérou pro stav singletu dimerizace:
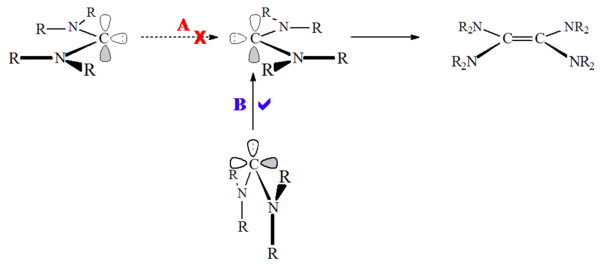
Diaminokarbeny nejsou skutečně dimerizovány, ale spíše tvoří dimer reakcí prostřednictvím formamidinium soli, protonovaný prekurzor.[28] V souladu s tím může být tato reakce katalyzována kyselinou. K této reakci dochází, protože na rozdíl od karbenů na bázi imidazolia nedochází při protonaci karbenu ke ztrátě aromatičnosti.
Na rozdíl od dimerizace stav tripletů karbeny, tyhle stav singletu karbeny se nepřibližují k hlavě („nejmenší pohyb“), ale spíše ke karbenu osamělý pár útočí na prázdný uhlík p-orbitální („neméně důležitý pohyb“). Dimerizace karbenu může být katalyzována kyselinami i kovy.
Reaktivita
Chemie stabilních karbenů nebyla dosud plně prozkoumána. Nicméně, Enders et al.[38][53][54] provedli řadu organických reakcí zahrnujících triazol-5-yliden. Tyto reakce jsou uvedeny níže a lze je považovat za model pro jiné karbeny.

| A | 3,6-difenyl-l, 2,4,5-tetrazin, toluen | 92% | E | 2 ekv., PhNCO, toluen, reflux | 92% | |
|---|---|---|---|---|---|---|
| b | RXH, RT | 95–97% | F | CS2, toluen nebo PhNCS, THF, RT | 71–90% | |
| C | Ó2, S.8nebo Se, toluen, reflux | 54–68% | G | Maleimid, THF, RT | 47–84% | |
| d | R1CH = CHR2, THF, RT | 25–68% | h | Dimethylacetyléndikarboxylát, THF, reflux | 21% |
Tyto karbeny mají tendenci se chovat v a nukleofilní móda (E a F), předvádění inzerční reakce (b), adiční reakce (C), [2+1] cykloadice (d, G a h), [4 + 1] cykloadice (A) a také jednoduché deprotonace. Inzerční reakce (b) pravděpodobně probíhá deprotonací, což vede ke generování nukleofilu (−XR), které mohou zaútočit na generovanou sůl a vytvořit dojem vložení H-X.
Údajně stabilní isothiazol karben (2) odvozený od chloristanu isothiazolia (1)[55] byl vyslýchán,[56] kteří byli schopni pouze izolovat 2-imino-2H-thiete (4). Meziprodukt 3 bylo navrženo prostřednictvím přesmyková reakce. Tento karben již není považován za stabilní.[57]

Karbenová komplexace
Ukázalo se, že imidazol-2-ylidenes, triazol-5-ylidenes (a v menší míře diaminokarbeny) koordinují celou řadu prvků, od alkalické kovy, prvky hlavní skupiny, přechodné kovy a dokonce lanthanoidy a aktinidy. A periodická tabulka prvků poskytuje určitou představu o komplexech, které byly připraveny, a v mnoha případech byly identifikovány monokrystalem Rentgenová krystalografie.[39][58][59] Předpokládá se, že stabilní karbeny se chovají podobně organofosfiny ve svých koordinačních vlastnostech vůči kovům. Tyto ligandy se říká, že jsou dobrými dárci σ prostřednictvím karbeniku osamělý pár, ale špatné π-akceptory kvůli vnitřnímu ligand zpětný dar z dusík atomy sousedící s centrem karbenu, a tak jsou schopné koordinovat i relativně elektronově nedostatečné kovy. Enders [60] a Hermann[61][62] prokázali, že tyto karbeny jsou vhodnou náhradou za fosfin ligandy v několika katalytické cykly. I když zjistili, že tyto ligandy neaktivují kovový katalyzátor stejně jako fosfinové ligandy, často vedou k robustnějším katalyzátorům. Hermann a Enders zkoumali několik katalytických systémů s použitím katalyzátorů obsahujících ligandy imidazolu a triazolkarbenu, se středním úspěchem.[58][60][61][62] Grubbs [63] uvádí náhradu fosfinového ligandu (PCy3) s imidazol-2-ylidenem v metateze olefinů katalyzátor RuCl2(PCy3)2CHPh a zaznamenal zvýšenou metatezu uzavírání prstenců a také vykazoval „pozoruhodnou stabilitu vzduchu a vody“. Molekuly obsahující dva a tři karbenové zbytky byly připraveny jako potenciální bidentate a trojzubec karbenové ligandy.[36][37]
Periodická tabulka (perzistentní karben) | ||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| Skupina → | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 | 11 | 12 | 13 | 14 | 15 | 16 | 17 | 18 | ||
| ↓ Doba | ||||||||||||||||||||
| 1 | 1 H | 2 On | ||||||||||||||||||
| 2 | 3 Li | 4 Být | 5 B | 6 C | 7 N | 8 Ó | 9 F | 10 Ne | ||||||||||||
| 3 | 11 Na | 12 Mg | 13 Al | 14 Si | 15 P | 16 S | 17 Cl | 18 Ar | ||||||||||||
| 4 | 19 K. | 20 Ca. | 21 Sc | 22 Ti | 23 PROTI | 24 Cr | 25 Mn | 26 Fe | 27 Spol | 28 Ni | 29 Cu | 30 Zn | 31 Ga | 32 Ge | 33 Tak jako | 34 Se | 35 Br | 36 Kr | ||
| 5 | 37 Rb | 38 Sr | 39 Y | 40 Zr | 41 Pozn | 42 Mo | 43 Tc | 44 Ru | 45 Rh | 46 Pd | 47 Ag | 48 CD | 49 v | 50 Sn | 51 Sb | 52 Te | 53 Já | 54 Xe | ||
| 6 | 55 Čs | 56 Ba | 72 Hf | 73 Ta | 74 Ž | 75 Re | 76 Os | 77 Ir | 78 Pt | 79 Au | 80 Hg | 81 Tl | 82 Pb | 83 Bi | 84 Po | 85 Na | 86 Rn | |||
| 7 | 87 Fr. | 88 Ra | 104 Rf | 105 Db | 106 Sg | 107 Bh | 108 Hs | 109 Mt. | 110 Ds | 111 Rg | 112 Cn | 113 Nh | 114 Fl | 115 Mc | 116 Lv | 117 Ts | 118 Og | |||
| 57 Los Angeles | 58 Ce | 59 Pr | 60 Nd | 61 Odpoledne | 62 Sm | 63 Eu | 64 Gd | 65 Tb | 66 Dy | 67 Ho | 68 Er | 69 Tm | 70 Yb | 71 Lu | ||||||
| 89 Ac | 90 Čt | 91 Pa | 92 U | 93 Np | 94 Pu | 95 Dopoledne | 96 Cm | 97 Bk | 98 Srov | 99 Es | 100 Fm | 101 Md | 102 Ne | 103 Lr | ||||||
- Legenda
- Karbenový komplex se známým prvkem
- Není znám žádný komplex karbenu s prvkem
Karbeny v organokovové chemii a katalýze
Karbeny lze stabilizovat jako organokovový druh. Tyto komplexy karbenu přechodného kovu spadají do dvou kategorií:
- Fischer karbeny, ve kterých jsou karbeny vázány na kov a an skupina pro výběr elektronů (obvykle karbonyl),
- Schrock karbeny; ve kterém jsou karbeny vázány na kov a an skupina poskytující elektrony. Reakce, kterých se takové karbeny účastní, se velmi liší od reakcí, kterých se účastní organické karbeny.
Chemie karbenu ve stavu tripletů
Persistentní karbeny ve stavu tripletů pravděpodobně budou mít velmi podobnou reaktivitu jako jiné neperzistentní stavy ve stavu tripletů karbeny.
Fyzikální vlastnosti

Karbeny, které byly dosud izolovány, bývají bezbarvé pevné látky s nízkou teplotou tání. Tyto karbeny mají tendenci sublimovat při nízkých teplotách za vysokého vakua.
Jednou z užitečnějších fyzikálních vlastností je diagnostický chemický posun karbenického atomu uhlíku v 13C-NMR spektrum. Typicky je tento pík v rozmezí mezi 200 a 300 ppm, kde se v 13C-NMR spektrum. Vlevo je uveden příklad cyklického diaminokarbenu, který má karbenový pík při 238 ppm.
Po koordinaci s kovovými centry 13C karbenová rezonance obvykle posune vysoké pole v závislosti na Lewisově kyselosti komplexního fragmentu. Na základě tohoto pozorování Huynh et al. vyvinuli novou metodiku pro stanovení silných donorů ligandů pomocí 13C NMR analýza transkomplexy -palladium (II) -karbenu. Použití a 13C-značený N-heterocyklický karbenový ligand také umožňuje studium smíšených komplexů karben-fosfin, které podléhají trans-cis-izomerizace v důsledku trans efekt.[64]
Aplikace
NHC jsou široce používány jako pomocný ligand v organokovový chemie. Jednou z praktických aplikací je ruthenium -na základě Grubbsův katalyzátor a Komplexy NHC-palladium pro křížové vazebné reakce.[65][66][67] Komplexy NHC-kov, konkrétně komplexy Ag (I) -NHC, byly široce testovány na své biologické aplikace.[68]
Metody přípravy
NHC jsou často silné základní (dále jen pKa hodnota konjugovaná kyselina imidazol-2-yliden bylo měřeno při ca. 24)[48] a reagovat s kyslík. Je zřejmé, že tyto reakce se provádějí pomocí bezvzduchové techniky, vyhýbat se sloučeninám i umírněného kyselost. I když jsou imidazoliové soli stabilní vůči nukleofilní navíc, jiné nearomatické soli nejsou (tj. formamidinium soli).[69]
V těchto případech je zabráněno silným nerušeným nukleofilům, ať už jsou generovány v situ nebo jsou přítomny jako nečistota v jiných činidlech (např. LiOH v BuLi).
Pro přípravu stabilních karbenů bylo vyvinuto několik přístupů, které jsou uvedeny níže.
Deprotonace
Deprotonace karbenových prekurzorových solí se silnými bázemi se ukázala jako spolehlivá cesta k téměř všem stabilním karbenům:
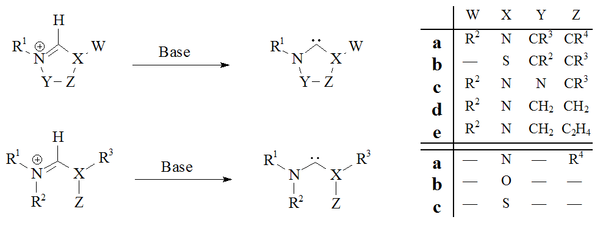
Imidazol-2-ylidenes a dihydroimidazol-2-ylidenes, např. IMes, byly připraveny deprotonací příslušných imidazolium a dihydroimidazolium soli. Acyklické karbeny[29][30] a tetrahydropyrimidinyl[39] karbeny na bázi byly připraveny deprotonací za použití silných homogenních bází.
Bylo použito několik bází a reakčních podmínek s různým úspěchem. Míra úspěchu byla v zásadě závislá na povaze EU předchůdce deprotonován. Hlavní nevýhodou tohoto způsobu přípravy je problém izolace volného karbenu z iontů kovů použitých při jejich přípravě.
Kovové hydridové báze
Dalo by se věřit, že sodík nebo hydrid draselný[26][32] by byla ideální bází pro deprotonaci těchto prekurzorových solí. Hydrid by měl nevratně reagovat se ztrátou vodík dát požadovaný karben, s anorganické vedlejší produkty a přebytek hydridu se odstraní filtrací. V praxi je tato reakce často příliš pomalá a vyžaduje přidání DMSO nebo t-BuOH.[18][25] Tato činidla generují rozpustné látky katalyzátory, které zvyšují rychlost reakce tohoto heterogenního systému generováním terc-butoxidu nebo dimsylový anion. Tyto katalyzátory se však ukázaly jako neúčinné pro přípravu neimidazolových aduktů, protože mají tendenci působit jako nukleofily vůči prekurzorovým solím a jsou přitom zničeny. Přítomnost někoho hydroxid ionty jako nečistota v hydridu kovu by také mohly zničit nearomatické soli.
Deprotonace s sodík nebo draslík hydrid ve směsi kapaliny amoniak / THF při –40 ° C[35] pro karbeny na bázi imidazolu. Arduengo a spolupracovníci[32] podařilo připravit dihydroimidazol-2-yliden za použití NaH. Tato metoda však nebyla použita pro přípravu diaminokarbenů. V některých případech, terc-butoxid draselný mohou být použity bez přidání hydridu kovu.[25]
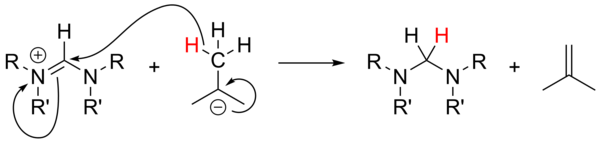
Alkyllithia
Použití alkyllithia jako silné základy[18] nebyl rozsáhle studován a byl nespolehlivý pro deprotonaci prekurzorových solí. S nearomatickými solemi mohou n-BuLi a PhLi působit jako nukleofily, zatímco t-BuLi může příležitostně působit jako zdroj hydridu, čímž se sůl snižuje tvorbou isobuten:
Amidové báze
Amidy lithia jako diisopropylamid (LDA) a (tetramethylpiperidid (LiTMP) )[29][30] obecně fungují dobře pro deprotonaci všech typů solí, pokud to není příliš mnoho LiOH je přítomen v n-butyllithium se používá k výrobě amidu lithného. Ke stanovení množství hydroxidu v roztoku lze použít titraci amidu lithného. Deprotonace prekurzorových solí s kovem hexamethyldisilazidy[39] funguje velmi čistě pro deprotonaci všech typů solí, s výjimkou neomezených formamidiniových solí, kde tato báze může působit jako nukleofil za vzniku aduktu triaminomethanu.
Příprava karbenu bez obsahu kovů

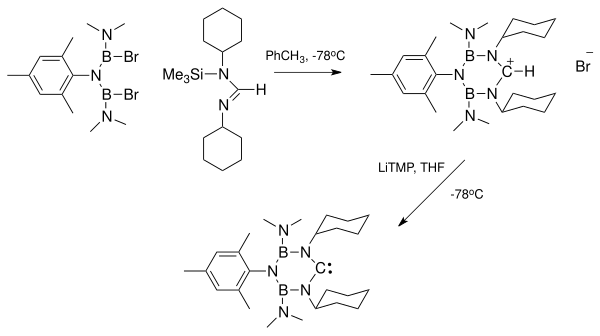
Bylo velmi žádáno, aby příprava stabilních karbenů bez kovových kationtů umožnila další studium druhů karbenů odděleně od těchto kovů. Oddělení karbenu od komplexu karben-kov může být problematické kvůli stabilitě komplexu. V souladu s tím je výhodné nejprve vyrobit karben bez těchto kovů. Ve skutečnosti byly některé ionty kovů namísto stabilizace karbenu zapleteny do katalytické dimerizace nerušených příkladů.
Na obrázku vpravo je rentgenová struktura ukazující komplex mezi diaminokarbenem a draslíkem HMDS. Tento komplex vznikl při přebytku KHMDS byl použit jako silná báze k deprotonaci formamidinium sůl. Odstranění iontů lithia, které jsou výsledkem deprotonace, pomocí činidel, jako je lithiumdiisopropylamid (LDA), může být obzvláště problematické. Vedlejší produkty draselné a sodné soli mají tendenci se vysrážet z roztoku a lze je odstranit. Lithiové ionty mohou být chemicky odstraněny vazbou na druhy, jako jsou krypty nebo ethery koruny.
Bezkovové karbeny byly připraveny několika způsoby, jak je uvedeno níže:
Dechalkogenace
Další přístup při přípravě karbenů se opíral o odsíření z thiomočoviny s draslík v THF.[27][70] K úspěchu této reakce přispívá skutečnost, že vedlejší produkt, sulfid draselný, je nerozpustný v rozpouštědle. Zvýšené teploty naznačují, že tato metoda není vhodná pro přípravu nestabilních dimerizujících karbenů. Jediný příklad deoxygenace a močovina s fluoren Rovněž byly hlášeny odvozené karbeny za vzniku tetramethyldiaminokarbenu a fluorenonu:[71]
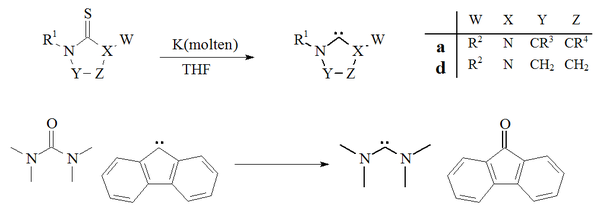
The odsíření thiomočovin s roztaveným draslík pro získání imidazol-2-ylidenů nebo diaminokarbenů nebyl široce používán. Tato metoda byla použita k přípravě dihydroimidazolkarbenů.[27]
Vakuová pyrolýza
Vakuová pyrolýza s odstraněním neutrálních těkavých vedlejších produktů (CH3OH, CHCI3), se používá k přípravě karbenů na bázi dihydroimidazolu a triazolu:
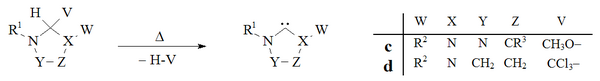
Historicky odstranění chloroformu pomocí vakuová pyrolýza z d adukty použil Wanzlick[8] v jeho raných pokusech o přípravu dihydroimidazol-2-ylidenů, ale tato metoda není široce používána. Enderská laboratoř[38] používá vakuovou pyrolýzu a C adukt za vzniku triazolium-5-yliden C.
Bis (trimethylsilyl) rtuť
Bis (trimethylsilyl) rtuť (CH3)3Si-Hg-Si (CH3)3 reaguje s chlor-iminium a chlor-amidinium soli za vzniku karbenu bez kovů a elementárních rtuť.[72] Například (CH3)3Si-Hg-Si (CH3)3 + R.2N = C (Cl) -NR2+ Cl− → R.2N-C: -NR2 + Hg(l) + (CH3)3Si-Cl
Fotochemický rozklad
Karbeny s perzistentním stavem tripletů byly připraveny fotochemické rozklad diazomethanového produktu vypuzením dusík plyn, na vlnové délce 300 nm v benzenu.
Čištění
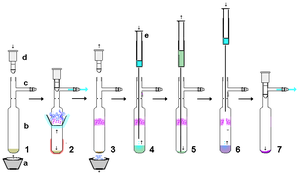
Stabilní karbeny jsou velmi reaktivní, a proto je při použití žádoucí minimální manipulace bezvzduchové techniky. Pokud jsou však použity přísně suché, relativně nekyselé a bez vzduchu materiály, stabilní karbeny jsou při manipulaci přiměřeně robustní per se. Jako příklad lze stabilní karben připravený z hydridu draselného filtrovat přes suchou vrstvu celitu, aby se odstranil přebytek KH (a výsledných solí) z reakce. V relativně malém měřítku lze suspenzi obsahující stabilní karben v roztoku nechat usadit a supernatantový roztok protlačit přes vysušenou membránu filtr stříkačky. Stabilní karbeny jsou snadno rozpustné v nepolárních rozpouštědlech, jako je hexan, a tak typicky rekrystalizace Stabilních karbenů může být obtížné kvůli nedostupnosti vhodných nekyselých polárních rozpouštědel. Bez vzduchu sublimace jak je ukázáno vpravo, může to být efektivní způsob čištění, i když jsou výhodné teploty pod 60 ° C za vysokého vakua, protože tyto karbeny jsou relativně těkavé a také by se mohly začít při těchto vyšších teplotách rozkládat. Sublimace v některých případech může poskytnout monokrystaly vhodné pro rentgenovou analýzu. Silná komplexace s kovovými ionty se však líbí lithium ve většině případů zabrání sublimaci.
Reference
- ^ Hopkinson, M. N .; Richter, C .; Schedler, M .; Glorius, F. (2014). "Přehled N-heterocyklických karbenů". Příroda. 510 (7506): 485–496. Bibcode:2014 Natur.510..485H. doi:10.1038 / příroda13384. PMID 24965649. S2CID 672379.
- ^ Ronald Breslow (1957). „Mechanism of Thiamine Action: Participation of a Thiazolium Zwitterion“. Chemie a průmysl. 26: 893.
- ^ Ronald Breslow (1958). „O mechanismu působení thiaminu. IV.1 Důkazy ze studií na modelových systémech“. Journal of the American Chemical Society. 80 (14): 3719–3726. doi:10.1021 / ja01547a064.
- ^ R. Breslow (1957). "Rychlá výměna deuteria v thiazoliových solích". Journal of the American Chemical Society. 79 (7): 1762–1763. doi:10.1021 / ja01564a064.
- ^ Berkessel A .; Elfert S .; Yatham V. R .; Neudörfl J.-M .; Schlörer N.E .; Teles J. H. (2012). "Umpolung pomocí N-heterocyklických karbenů: tvorba a reaktivita nepolapitelných 2,2-diamino enolů (Breslowovy meziprodukty)". Angew. Chem. Int. Vyd. 51 (49): 12370–12374. doi:10,1002 / anie.201205878. PMID 23081675.
- ^ Lékárny přistupují k nepolapitelnému Breslowovi Střední Carmen Drahl
- ^ Hans-Werner Wanzlick & E. Schikora (1960). „Ein neuer Zugang zur Carben-Chemie“. Angewandte Chemie. 72 (14): 494. doi:10,1002 / ange.19600721409.
- ^ A b H. W. Wanzlick a E. Schikora (1960). "Ein nukleofily Carben". Chemische Berichte. 94 (9): 2389–2393. doi:10.1002 / cber.19610940905.
- ^ A b H. W. Wanzlick (1962). „Aspects of Nucleophilic Carbene Chemistry“. Angew. Chem. Int. Vyd. Engl. 1 (2): 75–80. doi:10,1002 / anie.196200751.
- ^ D. M. Lemal; R. A. Lovald a K. I. Kawano (1964). „Tetraaminoethyleny. Otázka disociace“. J. Am. Chem. Soc. 86 (12): 2518–2519. doi:10.1021 / ja01066a044.
- ^ H. E. Winberg; J. E. Carnahan; D. D. Coffman & M. Brown (1965). "Tetraaminoethyleny". J. Am. Chem. Soc. 87 (9): 2055–2056. doi:10.1021 / ja01087a040.
- ^ Denk M. K .; Hatano K .; Ma M. (1999). "Nucleophilic Carbenes and the Wanzlick Equilibrium A Reinvestigation". Čtyřstěn dopisy. 40 (11): 2057–2060. doi:10.1016 / S0040-4039 (99) 00164-1.
- ^ Böhm Volker P. W .; Herrmann Wolfgang A. (2000). „Wanzlickova rovnováha“. Angewandte Chemie. 39 (22): 4036–4038. doi:10.1002 / 1521-3773 (20001117) 39:22 <4036 :: AID-ANIE4036> 3.0.CO; 2-L.
- ^ H. W. Wanzlick a H. J. Schonherr (1970). „Chemie nucleophiler Carbene, XVIII1) 1.3.4.5-Tetraphenyl-imidazoliumperchlorat“. Liebigs Ann. Chem. 731: 176–179. doi:10.1002 / jlac.19707310121.
- ^ R. Gleiter a R. Hoffmann (1968). "Stabilizace singletového methylenu". J. Am. Chem. Soc. 90 (20): 5457–5460. doi:10.1021 / ja01022a023.
- ^ A b A. Igau; H. Grutzmacher; A. Baceiredo; G. Bertrand (1988). „Analogické α, α'-bis-karbenoidy, trojitě vázané druhy: syntéza stabilního λ3-fosfino-karben-λ3-fosfacetylen ". J. Am. Chem. Soc. 110 (19): 6463–6466. doi:10.1021 / ja00227a028.
- ^ A b C G. Bertrand; R. Reed (1994). „λ3-Fosfinokarbeny λ5-fosfacetyleny “. Recenze koordinační chemie. 137: 323–355. doi:10.1016 / 0010-8545 (94) 03005-B.
- ^ A b C A. J. Arduengo, R. L. Harlow a M. Kline (1991). "Stabilní krystalický karben". J. Am. Chem. Soc. 113 (1): 361–363. doi:10.1021 / ja00001a054.
- ^ Tapu, Daniela; Dixon, David A .; Roe, Christopher (12. srpna 2009). „13C NMR spektroskopie„ karbenů “typu„ Arduengo “a jejich derivátů. Chemické recenze. 109 (8): 3385–3407. doi:10.1021 / cr800521g. PMID 19281270.
- ^ Arduengo, Anthony J .; Harlow, Richard L .; Kline, Michael (leden 1991). "Stabilní krystalický karben". Journal of the American Chemical Society. 113 (1): 361–363. doi:10.1021 / ja00001a054.
- ^ A b A. J. Arduengo; F. Davidson; H. V. R. Dias; J. R. Goerlich; D. Khasnis; W. J. Marshall; T. K. Prakasha (1997). Dimery „Vzduch stabilního karbenu a smíšeného karbenu“"". J. Am. Chem. Soc. 119 (52): 12742–12749. doi:10.1021 / ja973241o.
- ^ Christophe Buron; Heinz Gornitzka; Vadim Romanenko; Guy Bertrand (2000). „Stabilní verze přechodných karbenů Push-Pull: Prodloužení životnosti z nanosekund na týdny“. Věda. 288 (5467): 834–836. Bibcode:2000Sci ... 288..834B. doi:10.1126 / science.288.5467.834. PMID 10796999.
- ^ Solé, Stéphane; Gornitzka, Heinz; Schoeller, Wolfgang W .; Bourissou, Didier; Bertrand, Guy (2001). „(Amino) (Aryl) Carbenes: Stabilní singletové karbeny se zástupcem diváka“. Věda. 292 (5523): 1901–1903. Bibcode:2001Sci ... 292.1901S. doi:10.1126/science.292.5523.1901. PMID 11397943.
- ^ Lai Chun-Liang; Guo Wen-Hsin; Lee Ming-Tsung; Hu Ching-Han (2005). "Ligand properties of N-heterocyclic and Bertrand carbenes: A density functional study". Journal of Organometallic Chemistry. 690 (24–25): 5867–5875. doi:10.1016/j.jorganchem.2005.07.058.
- ^ A b C d A. J. Arduengo; H. V. R. Dias; R. L. Harlow & M. Kline (1992). "Electronic stabilization of nucleophilic carbenes". J. Am. Chem. Soc. 114 (14): 5530–5534. doi:10.1021 / ja00040a007.
- ^ A b C J. Arduengo; J. R. Goerlich & W. J. Marshall (1995). "Stabilní diaminokarbén". J. Am. Chem. Soc. 117 (44): 11027–11028. doi:10.1021 / ja00149a034.
- ^ A b C d E M. K. Denk; A. Thadani; K. Hatano & A. J. Lough (1997). "Steric Stabilization of Nucleophilic Carbenes". Angew. Chem. Int. Vyd. Engl. 36 (23): 2607–2609. doi:10.1002/anie.199726071.
- ^ A b C d Alder, RW; Chaker, L; Paolini, FP (2004). "Bis(diethylamino)carbene and the mechanism of dimerisation for simple diaminocarbenes". Chemická komunikace (Cambridge, Anglie) (19): 2172–3. doi:10.1039/b409112d. PMID 15467857.
- ^ A b C d R. W. Alder; P. R. Allen; M. Murray & A. G. Orpen (1996). "Bis(diisopropylamino)carbene". Angew. Chem. Int. Vyd. Engl. 35 (10): 1121–1123. doi:10.1002/anie.199611211.
- ^ A b C d E R. W. Alder & M. E. Blake (1997). "Bis(N-piperidyl)carbene and its slow dimerisation to tetrakis(N-piperidyl)ethene". Chem. Commun. (16): 1513–1514. doi:10.1039/a703610h.
- ^ A b R. W. Alder; M. E. Blake & J. M. Oliva (1999). "Diaminocarbenes; Calculation of Barriers to Rotation about CCarbene-N Bonds, Barriers to Dimerization, Proton Affinities, and 13C NMR Shifts". J. Phys. Chem. A. 103 (50): 11200–11211. Bibcode:1999JPCA..10311200A. doi:10.1021/jp9934228.
- ^ A b C d E A. J. Arduengo, J. R. Goerlich and W. J. Marshall (1997). "A Stable Thiazol-2-ylidene and Its Dimer". Liebigs Annalen. 1997 (2): 365–374. doi:10.1002/jlac.199719970213.
- ^ A b C R. W. Alder; C. P. Butts & A. G. Orpen (1998). "Stable Aminooxy- and Aminothiocarbenes". J. Am. Chem. Soc. 120 (44): 11526–11527. doi:10.1021/ja9819312.
- ^ A b Lavallo, Vincent; Canac, Yves; Donnadieu, Bruno; Schoeller, Wolfgang W .; Bertrand, Guy (2006). "Cyclopropenylidenes: From Interstellar Space to an Isolated Derivative in the Laboratory". Věda. 312 (5774): 722–724. Bibcode:2006Sci...312..722L. doi:10.1126/science.1126675. PMC 2427275. PMID 16614171.
- ^ A b C W. A. Herrmann; C. Kocher; L. J. Goossen & G. R. J. Artus (1996). "Heterocyclic Carbenes: A High-Yielding Synthesis of Novel, Functionalized N-Heterocyclic Carbenes in Liquid Ammonia". Chem. Eur. J. 2 (12): 1627–1636. doi:10.1002/chem.19960021222.
- ^ A b W. A. Herrmann; M. Elison; J. Fischer; C. Kocher & G. R. J. Artus (1996). "N-Heterocyclic Carbenes: Generation under Mild Conditions and Formation of Group 8–10 Transition Metal Complexes Relevant to Catalysis". Chem. Eur. J. 2 (7): 772–780. doi:10.1002/chem.19960020708.
- ^ A b H. V. R. Dias & W. C. Jin (1994). "A stable tridentate carbene ligand". Tetrahedron Lett. 35 (9): 1365–1366. doi:10.1016/S0040-4039(00)76219-8.
- ^ A b C d D. Enders; K. Breuer; G. Raabe; J. Runsink; J. H. Teles; J. P. Melder; K. Ebel & S. Brode (1995). "Preparation, Structure, and Reactivity of 1,3,4-Triphenyl-4,5-dihydro-1H-1,2,4-triazol-5-ylidene, a New Stable Carbene". Angew. Chem. Int. Vyd. Engl. 34 (9): 1021–1023. doi:10.1002/anie.199510211.
- ^ A b C d R. W. Alder; M. E. Blake; C. Bortolotti; S. Buffali; C. P. Butts; E. Lineham; J. M. Oliva; A. G. Orpen & M. J. Quayle (1999). "Complexation of stable carbenes with alkali metals". Chem. Commun. (3): 241–242. doi:10.1039/a808951e.
- ^ R. Breslow (1957). "Rapid Deuterium Exchange in Thiazolium Salts". J. Am. Chem. Soc. 79 (7): 1762–1763. doi:10.1021/ja01564a064.
- ^ H. D. Haztzler (1970). "Nucleophilic 1,3-dithiolium carbenes". J. Am. Chem. Soc. 92 (5): 1412–1413. doi:10.1021/ja00708a058.
- ^ H. D. Hartzler (1972). "1,3-Dithiolium carbenes from acetylenes and carbon disulfide". J. Am. Chem. Soc. 95 (13): 4379–4387. doi:10.1021/ja00794a039.
- ^ G. Bertrand; A. Igau; A. Baceiredo & G. Trinquier (1989). "[Bis(diisopropylamino)phosphino]trimethylsilylcarbene: A Stable Nucleophilic Carbene". Angew. Chem. Int. Vyd. Engl. 28 (5): 621–622. doi:10.1002/anie.198906211.
- ^ Präsang, C; Donnadieu, B; Bertrand, G (2005). "Stable Planar Six-π-Electron Six-Membered N-Heterocyclic Carbenes with Tunable Electronic Properties". J. Am. Chem. Soc. 127 (29): 10182–10183. doi:10.1021/ja052987g. PMC 2440681. PMID 16028925.
- ^ Tomioka, H; Iwamoto, E; Itakura, H; Hirai, K (2001). "Generation and characterization of a fairly stable triplet carbene". Příroda. 412 (6847): 626–8. Bibcode:2001Natur.412..626T. doi:10.1038/35088038. PMID 11493917. S2CID 4373216.
- ^ Michael Freemantle (2001-08-13). "Triplet Carbene has Long Life". Chemické a technické novinky. 79 (33): 11. doi:10.1021/cen-v079n033.p011a.
- ^ Itoh, T; Nakata, Y; Hirai, K; Tomioka, H (2006). "Triplet Diphenylcarbenes Protected by Trifluoromethyl and Bromine Groups. A Triplet Carbene Surviving a Day in Solution at Room Temperature". J. Am. Chem. Soc. 128 (3): 957–967. doi:10.1021/ja056575j. PMID 16417387.
- ^ A b R. W. Alder; P. R. Allen & S. J. Williams (1995). "Stable carbenes as strong bases". J. Chem. Soc., Chem. Commun. (12): 1267. doi:10.1039/c39950001267.
- ^ Massey Richard S (2012). "Proton Transfer Reactions of Triazol-3-ylidenes: Kinetic Acidities and Carbon Acid pKaValues for Twenty Triazolium Salts in Aqueous Solution" (PDF). Journal of the American Chemical Society. 134 (50): 20421–20432. doi:10.1021/ja308420c. PMID 23173841.
- ^ Higgins, Eleanor M.; Sherwood, Jennifer A.; Lindsay, Anita G.; Armstrong, James; Massey, Richard S.; Olše, Roger W .; O'Donoghue, Annmarie C. (2011). „P Kas of the conjugate acids of N-heterocyclic carbenes in water". Chem. Commun. 47 (5): 1559–1561. doi:10.1039/C0CC03367G. PMID 21116519. S2CID 205757477.
- ^ T. A. Taton & P. Chen (1996). "A Stable Tetraazafulvalene". Angew. Chem. Int. Vyd. Engl. 35 (9): 1011–1013. doi:10.1002/anie.199610111.
- ^ Olše, Roger W .; Blake, Michael E .; Chaker, Leila; Harvey, Jeremy N.; Paolini, François; Schütz, Jan (2004). "When and How Do Diaminocarbenes Dimerize?". Angewandte Chemie International Edition. 43 (44): 5896–911. doi:10.1002/anie.200400654. PMID 15457494.
- ^ D. Enders, K. Breuer, J. Runsink, and J. H. Teles (1996), Liebigs Ann. Chem., page 2019
- ^ A b D. Enders, K. Breuer, J. H. Teles, and K. Ebel (1997), Journal Fur Praktische Chemie-Chemiker-Zeitung volume 339, page 397
- ^ Wolf, J; Böhlmann, W; Findeisen, M; Gelbrich, T; Hofmann, HJ; Schulze, B (2007). "Synthesis of stable isothiazole carbenes". Angewandte Chemie International Edition v angličtině. 46 (17): 3118–21. doi:10.1002/anie.200604305. PMID 17372997.
- ^ Dehope, A; Lavallo, V; Donnadieu, B; Schoeller, WW; Bertrand, G (2007). "Recently reported crystalline isothiazole carbenes: Myth or reality". Angewandte Chemie International Edition v angličtině. 46 (36): 6922–5, discussion 6926. doi:10.1002/anie.200702272. PMID 17661300.
- ^ Wolf Janine; Böhlmann Winfried; Findeisen Matthias; Gelbrich Thomas; Hofmann Hans-Jorg; Schulze Borbel (2007). "Reply to "Recently Reported Crystalline Isothiazole Carbenes: Myth or Reality"". Angew. Chem. Int. Vyd. 46 (36): 6926. doi:10.1002/anie.200702746.
- ^ A b Wolfgang A. Herrmann; Christian Köcher (1997). "N-Heterocyclic Carbenes". Angew. Chem. Int. Vyd. Engl. 36 (20): 2162–2187. doi:10.1002/anie.199721621.
- ^ Gernot Boche; Christof Hilf; Klaus Harms; Michael Marsch; John C. W. Lohrenz (1995). "Crystal Structure of the Dimeric (4-tert-Butylthiazolato)(glyme)lithium: Carbene Character of a Formyl Anion Equivalent". Angew. Chem. Int. Vyd. Engl. 34 (4): 487–489. doi:10.1002/anie.199504871.
- ^ A b D. Enders; H. Gielen; G. Raabe; J. Runsink & J. H. Teles (1996). "Synthesis and Stereochemistry of the First Chiral (Imidazolinylidene)- and (Triazolinylidene)palladium(II) Complexes". Chem. Ber. 129 (12): 1483–1488. doi:10.1002/cber.19961291213.
- ^ A b Wolfgang A. Herrmann; Martina Elison; Jakob Fischer; Christian Köcher; Georg R. J. Artus (1995). "Metal Complexes of N-Heterocyclic Carbenes - A New Structural Principle for Catalysts in Homogeneous Catalysis". Angew. Chem. Int. Vyd. Engl. 34 (21): 2371–2374. doi:10.1002/anie.199523711.
- ^ A b Wolfgang A. Herrmann; Lukas J. Goossen; Christian Köcher; Georg R. J. Artus (1996). "Chiral Heterocylic Carbenes in Asymmetric Homogeneous Catalysis". Angew. Chem. Int. Vyd. Engl. 35 (23–24): 2805–2807. doi:10.1002/anie.199628051.
- ^ M. Scholl; T. M. Trnka; J. P. Morgan & R. H. Grubbs (1999). "Increased ring closing metathesis activity of ruthenium-based olefin metathesis catalysts coordinated with imidazolin-2-ylidene ligands". Tetrahedron Lett. 40 (12): 2247–2250. doi:10.1016/S0040-4039(99)00217-8.
- ^ Han Vinh Huynh; et al. (2009). "13C NMR Spectroscopic Determination of Ligand Donor Strengths Using N-Heterocyclic Carbene Complexes of Palladium(II)". Organometallics. 28 (18): 5395–5404. doi:10.1021/om900667d.
- ^ S. P. Nolan [editor] (2006). N-Heterocyclic carbenes in synthesis, Wiley-VCH ISBN 3-527-31400-8
- ^ F. Glorius [editor] (2007) N-Heterocyclic carbenes in transition metal catalysis Springer ISBN 3-540-36929-5
- ^ Díez-González, Silvia; Marion, Nicolas; Nolan, Steven P. (2009-08-12). "N-Heterocyclic Carbenes in Late Transition Metal Catalysis". Chemické recenze. 109 (8): 3612–3676. doi:10.1021/cr900074m. ISSN 0009-2665. PMID 19588961. S2CID 206902952.
- ^ Garrison Jered C.; Youngs Wiley J. (2005). "Ag(I) N-Heterocyclic Carbene Complexes: Synthesis, Structure, and Application". Chem. Rev. 105 (11): 3978–4008. doi:10.1021/cr050004s. PMID 16277368. S2CID 43090499.
- ^ Roger W. Alder; Michael E. Blake; Simone Bufali; Craig P. Butts; A. Guy Orpen; Jan Schütz; Stuart J. Williams (2001). "Příprava tetraalkylformamidiniových solí a příbuzných druhů jako prekurzorů stabilních karbenů". Journal of the Chemical Society, Perkin Transactions 1 (14): 1586–1593. doi:10.1039/b104110j.
- ^ N. Kuhn & T. Kratz (1993). "Synthesis of Imidazol-2-ylidenes by Reduction of Imidazole-2(3H)-thiones". Syntéza. 1993 (6): 561–562. doi:10.1055/s-1993-25902.
- ^ D. Kovacs; M. S. Lee; D. Olson & J. E. Jackson (1996). "Carbene-to-Carbene Oxygen Atom Transfer". J. Am. Chem. Soc. 118 (34): 8144–8145. doi:10.1021/ja961324j.
- ^ Michael Otto; Salvador Conejero; Yves Canac; Vadim D. Romanenko; Valentyn Rudzevitch & Guy Bertrand (2004). "Mono- and Diaminocarbenes from Chloroiminium and -amidinium Salts: Synthesis of Metal-Free Bis(dimethylamino)carbene". J. Am. Chem. Soc. 126 (4): 1016–1017. doi:10.1021/ja0393325. PMID 14746458.
Další čtení
Reviews on persistent carbenes:
- Hopkinson, M. N.; Richter, C.; Schedler, M.; Glorius, F. (2014). "An Overview of N-Heterocyclic Carbenes". Příroda. 510 (7506): 485–496. Bibcode:2014Natur.510..485H. doi:10.1038/nature13384. PMID 24965649. S2CID 672379.
- Carbene Chemistry: From Fleeting Intermediates to Powerful Reagents, (Chapter 4, Hideo Tomioka (triplet state); Chapter 5 (singlet state), Roger W. Alder) - ed. Guy Bertrand
- Reactive Intermediate Chemistry By Robert A. Moss, Matthew Platz, Maitland Jones (Chapter 8, Stable Singlet Carbenes, Guy Bertrand)
- R. W. Alder, in 'Diaminocarbenes: exploring structure and reactivity', ed. G. Bertrand, New York, 2002
- M. Regitz (1996). "Stable Carbenes—Illusion or Reality?". Angew. Chem. Int. Vyd. Engl. 30 (6): 674–676. doi:10.1002/anie.199106741.
For a review on the physico-chemical properties (electronics, sterics, ...) of N-heterocyclic carbenes:
- T. Dröge; F. Glorius (2010). "The Measure of All Rings - N-Heterocyclic Carbenes". Angew. Chem. Int. Vyd. Engl. 49 (39): 6940–6952. doi:10.1002/anie.201001865. PMID 20715233. [Angew. Chem. 2010, 122, 7094-7107.]
