Otrava paracetamolem - Paracetamol poisoning
| Otrava paracetamolem | |
|---|---|
| Ostatní jména | Toxicita pro acetaminofen, toxicita pro paracetamol, otrava acetaminofenem, předávkování paracetamolem, předávkování acetaminofenem, toxicita pro tylenol |
 | |
| Paracetamol | |
| Specialita | Toxikologie |
| Příznaky | Brzy: Nespecifické, pocit únavy, bolest břicha, nevolnost[Citace je zapotřebí ] Později: Nažloutlá kůže, problémy se srážením krve, zmatek[Citace je zapotřebí ] |
| Komplikace | Selhání jater, selhání ledvin, pankreatitida, nízká hladina cukru v krvi, laktátová acidóza.[Citace je zapotřebí ] |
| Obvyklý nástup | Po 24 hodinách (toxicita)[1] |
| Příčiny | Paracetamol (acetaminofen) obvykle> 7 g[2][1] |
| Rizikové faktory | Alkoholismus, podvýživa, některé další léky[1] |
| Diagnostická metoda | Hladiny v krvi v určitých časech po použití[1] |
| Diferenciální diagnostika | Alkoholismus, virová hepatitida, gastroenteritida[1] |
| Léčba | Aktivní uhlí, acetylcystein, transplantace jater[1][Citace je zapotřebí ] |
| Prognóza | Smrt nastává u ~ 0,1%[1] |
| Frekvence | > 100 000 ročně (USA)[1] |
Otrava paracetamolem, také známý jako otrava acetaminofenem, je způsobeno nadměrným užíváním léků paracetamol (acetaminofen).[2] Většina lidí má málo nebo nespecifické příznaky během prvních 24 hodin po předávkování. Mezi ně patří pocit únavy, bolest břicha nebo nevolnost. Obvykle následuje pár dní bez jakýchkoli příznaků, po kterých nažloutlá kůže, problémy se srážením krve, a zmatek dochází v důsledku selhání jater. Mohou zahrnovat další komplikace selhání ledvin, pankreatitida, nízká hladina cukru v krvi, a laktátová acidóza. Pokud nedojde k úmrtí, lidé mají tendenci se během několika týdnů plně zotavit. Bez léčby se některé případy vyřeší, zatímco jiné budou mít za následek smrt.[3][4]
Otrava paracetamolem může nastat náhodně nebo jako pokusit se ukončit život. Mezi rizikové faktory toxicity patří alkoholismus, podvýživa a užívání některých dalších léků.[1] Poškození jater výsledky ne ze samotného paracetamolu, ale z jednoho z jeho metabolity, N-acetyl-p-benzochinon imin (NAPQI).[5] NAPQI snižuje játra glutathion a přímo poškozuje buňky v játrech.[6] Diagnóza je založena na hladině paracetamolu v krvi v konkrétních dobách po podání léku.[1] Tyto hodnoty jsou často zakresleny na Rumack-Matthewův nomogram určit míru znepokojení.[1]
Léčba může zahrnovat aktivní uhlí pokud osoba vyhledá lékařskou pomoc brzy po předávkování.[1] Pokusit se osobu donutit zvracení se nedoporučuje.[5] Pokud existuje riziko toxicity, protijed acetylcystein je doporučeno.[1] Léčba se obvykle podává po dobu nejméně 24 hodin.[5] Psychiatrické po zotavení může být vyžadována opatrnost.[1] A transplantace jater může být zapotřebí, pokud dojde k vážnému poškození jater.[Citace je zapotřebí ] Potřeba transplantace je často založena na nízké pH krve, vysoká krevní laktát špatná srážlivost krve nebo významná jaterní encefalopatie.[Citace je zapotřebí ] Při včasné léčbě je selhání jater vzácné.[5] K úmrtí dochází přibližně v 0,1% případů.[1]
Otrava paracetamolem byla poprvé popsána v 60. letech.[5] Míra otravy se mezi regiony světa významně liší.[7] Ve Spojených státech se ročně vyskytne více než 100 000 případů.[1] Ve Velké Británii je za největší počet předávkování odpovědný lék.[6] Nejčastěji jsou postiženy malé děti.[1] Ve Spojených státech a Velké Británii je paracetamol nejčastější příčinou akutní selhání jater.[8][1]
Příznaky a symptomy
Známky a příznaky toxicity paracetamolu se vyskytují ve třech fázích. První fáze začíná během několika hodin po předávkování a skládá se z nevolnost zvracení, a bledý vzhled, a pocení.[9] Pacienti však často nemají během prvních 24 hodin otravy žádné specifické příznaky nebo pouze mírné příznaky. Zřídka se u pacientů po masivním předávkování mohou objevit příznaky metabolická acidóza a kóma brzy v průběhu otravy.[10][11]
Druhá fáze nastává mezi 24 hodinami a 72 hodinami po předávkování a skládá se ze známek zvyšujícího se poškození jater. K poškození obecně dochází v jaterní buňky protože metabolizují paracetamol. Jednotlivec může zažít pravý horní kvadrant břišní bolest. Rostoucí poškození jater také mění biochemické markery funkce jater; Mezinárodní normalizovaný poměr (INR) a játra transaminázy ALT a AST vzroste na abnormální úrovně.[12] Akutní selhání ledvin může také nastat během této fáze, obvykle způsobené kterýmkoli z nich hepatorenální syndrom nebo syndrom dysfunkce více orgánů. V některých případech může být primárním klinickým projevem toxicity akutní selhání ledvin. V těchto případech se předpokládá, že toxický metabolit se produkuje více v ledvinách než v játrech.[13]
Třetí fáze následuje po 3 až 5 dnech a je poznamenána komplikacemi masivní jater nekróza vedoucí k fulminantní selhání jater s komplikacemi koagulace vady, nízká hladina cukru v krvi, selhání ledvin, jaterní encefalopatie, otok mozku, sepse, selhání více orgánů a smrt.[9] Pokud třetí fáze přežije, běží nekróza jater a játra a funkce ledvin obvykle se vrátí do normálu za několik týdnů.[14] Závažnost toxicity paracetamolu se liší v závislosti na dávce a na tom, zda je podána vhodná léčba.
Způsobit
Toxická dávka paracetamolu je velmi variabilní. Obecně je doporučená maximální denní dávka pro zdravé dospělé osoby 4 gramy.[15][16] Vyšší dávky vedou ke zvýšení rizika toxicity. U dospělých mají jednotlivé dávky nad 10 gramů nebo 200 mg / kg tělesné hmotnosti, podle toho, která je nižší, přiměřenou pravděpodobnost, že způsobí toxicitu.[17][18] Toxicita může také nastat, když několik menších dávek během 24 hodin tyto úrovně překročí.[18] Po dávce 1 gramu paracetamolu čtyřikrát denně po dobu dvou týdnů mohou pacienti očekávat vzestup alanin transamináza v jejich játra na typicky asi trojnásobek normální hodnoty.[19] Je nepravděpodobné, že by tato dávka vedla k selhání jater.[20] Studie prokázaly, že významná hepatotoxicita je neobvyklá u pacientů, kteří užívali vyšší než normální dávky po dobu 3 až 4 dnů.[21] U dospělých může dávka 6 gramů denně během předchozích 48 hodin potenciálně vést k toxicitě,[18] zatímco u dětí by akutní dávky nad 200 mg / kg mohly potenciálně způsobit toxicitu.[22] Akutní předávkování paracetamolem u dětí zřídka způsobuje onemocnění nebo smrt a je velmi neobvyklé, že děti mají hladinu vyžadující léčbu, přičemž hlavní příčinou toxicity u dětí jsou chronické dávky vyšší než normální.[18]
Úmyslné předávkování (otrava se sebevražednými úmysly) je často spojeno s toxicitou paracetamolu.[23] V přehledu z roku 2006 byl paracetamol nejčastěji užívanou sloučeninou při úmyslném předávkování.[24]
U vzácných jedinců může toxicita paracetamolu vyplynout z běžného používání.[25] Může to být způsobeno jednotlivcem („výstřední ") rozdíly v expresi a aktivitě určitých enzymů v jednom z metabolické cesty které zpracovávají paracetamol (viz metabolismus paracetamolu ).
Rizikové faktory
Řada faktorů může potenciálně zvýšit riziko vzniku toxicity paracetamolu. Chronické nadměrné konzumace alkoholu umět vyvolat CYP2E1, čímž se zvyšuje potenciální toxicita paracetamolu. V jedné studii u pacientů s poškozením jater uvádělo 64% příjem alkoholu vyšší než 80 gramů denně, zatímco 35% užívalo 60 gramů denně nebo méně.[26] Někteří kliničtí toxikologové diskutovali o tom, zda by měl být chronický alkoholismus považován za rizikový faktor.[27][28] U chronických uživatelů alkoholu může mít akutní požití alkoholu v době předávkování paracetamolem ochranný účinek.[27][29] U nechronických uživatelů alkoholu neměla akutní konzumace alkoholu žádný ochranný účinek.
Půst je rizikovým faktorem, pravděpodobně z důvodu vyčerpání rezerv glutathionu v játrech.[18] Současné použití induktoru CYP2E1 isoniazid zvyšuje riziko hepatotoxicity, i když není jasné, zda v tomto případě indukce 2E1 souvisí s hepatotoxicitou.[30][31] Současné užívání jiných léků, které indukují enzymy CYP, jako jsou antiepileptika včetně karbamazepin, fenytoin, a barbituráty, byly rovněž hlášeny jako rizikové faktory.[32]
Patofyziologie

Pokud se paracetamol užívá v běžných terapeutických dávkách, bylo prokázáno, že je bezpečný.[12] Po terapeutické dávce se většinou převádí na netoxické metabolity prostřednictvím Metabolismus fáze II konjugací s síran a glukuronid, přičemž malá část je oxidována prostřednictvím cytochrom P450 enzymový systém.[33] Cytochromy P450 2E1 a 3A4 přeměnit přibližně 5% paracetamolu na vysoce reaktivní meziproduktový metabolit, N-acetyl-p-benzochinon imin (NAPQI).[33][12][34][35][36] Za normálních podmínek je NAPQI detoxikován konjugací s glutathion za vzniku konjugátů cystein a kyselina merkapturová.[33][37]
V případě předávkování paracetamolem dochází k nasycení sulfátové a glukuronidové dráhy a více paracetamolu je přemístěno do systému cytochromu P450 za vzniku NAPQI. V důsledku toho se vyčerpají hepatocelulární zásoby glutathionu, protože poptávka po glutathionu je vyšší než jeho regenerace.[37] NAPQI proto zůstává ve své toxické formě v játrech a reaguje s buněčná membrána molekuly, což vede k rozšíření hepatocytů poškození a smrt, vedoucí k akutní nekróze jater.[33][38] Ve studiích na zvířatech musí být zásoby glutathionu v játrech vyčerpány na méně než 70% normální hladiny, než dojde k jaterní toxicitě.[34]
Diagnóza

Historie užívání paracetamolu u osoby je pro diagnózu poněkud přesná.[39] Nejúčinnějším způsobem diagnostiky otravy je získání hladiny paracetamolu v krvi. Droga nomogram vyvinutý v roce 1975, nazvaný Rumack-Matthewův nomogram, odhaduje riziko toxicity na základě sérové koncentrace paracetamolu v daném počtu hodin po požití.[9] K určení rizika potenciální hepatotoxicity je sledována hladina paracetamolu podél nomogramu. Nejlepším markerem indikujícím možnost poškození jater se jeví použití časované hladiny paracetamolu v séru vynesené na nomogramu.[18] Hladina paracetamolu nasávaná během prvních čtyř hodin po požití může podceňovat množství v systému, protože paracetamol může být stále v procesu vstřebávání z gastrointestinální trakt. Sérová hladina odebraná před 4 hodinami se proto nedoporučuje.[17]
Klinické nebo biochemické důkazy jaterní toxicity se mohou vyvinout za jeden až čtyři dny, i když v závažných případech to může být patrné za 12 hodin.[40] Může být přítomna něha v pravém horním kvadrantu a může pomoci při diagnostice. Laboratorní studie mohou prokázat zvýšené hladiny nekrózy jater AST, ALT, bilirubin a prodloužené koagulační časy, zvláště zvýšené protrombinový čas.[41] Po předávkování paracetamolem, kdy AST a ALT překročí 1 000 IU / l, lze diagnostikovat hepatotoxicitu vyvolanou paracetamolem.[40] V některých případech mohou hladiny AST a ALT překročit 10 000 IU / l.[42]
Detekce v tělních tekutinách
Paracetamol může být kvantifikován v krvi, plazmě nebo moči jako diagnostický nástroj v situacích klinické otravy nebo jako pomoc při medikolegálním vyšetřování podezřelých úmrtí. Koncentrace v séru po typické dávce paracetamolu obvykle vrcholí pod 30 mg / l, což se rovná 200 µmol / l.[43] U pacientů s předávkováním jsou často pozorovány hladiny 30–300 mg / l (200–2 000 µmol / l). Hladiny po smrti se pohybovaly v rozmezí 50–400 mg / l u osob umírajících v důsledku akutního předávkování. Automatizovaný kolorimetrické techniky, plynová chromatografie a kapalinová chromatografie se v současné době používají pro laboratorní analýzu léčiva ve fyziologických vzorcích.[44][45]
Prevence
Omezení dostupnosti
V některých zemích se pokoušelo omezit dostupnost tablet paracetamolu. Ve Velké Británii je prodej volně prodejného paracetamolu omezen na balení po 32 x 500 mg tabletách v lékárnách a 16 x 500 mg tablet v lékárnách. Lékárníci mohou poskytnout až 100 tablet pro osoby s chronickým onemocněním podle uvážení lékárníka.[46][47] V Irsku je limit 24, respektive 12 tablet.[48] Následující studie naznačují, že snížená dostupnost ve velkém počtu měla významný účinek na snížení úmrtí na otravu předávkováním paracetamolem.[49]
Jednou z navrhovaných metod prevence je učinit z paracetamolu lék na předpis nebo jej zcela stáhnout z trhu. Předávkování je však relativně malým problémem; například 0,08% populace ve Velké Británii (více než 50 tisíc lidí) se každý rok předávkuje předávkováním paracetamolem. Naproti tomu paracetamol je bezpečný a účinný lék, který bez komplikací užívají miliony lidí.[50] Navíc alternativní úleva od bolesti léky jako aspirin jsou při předávkování toxičtější, zatímco nesteroidní protizánětlivé léky jsou spojeny s více nepříznivými účinky po běžném používání.[51]
Kombinace s jinými látkami
Jednou ze strategií snižování škod způsobených předávkováním acetaminofenem je prodej paracetamolu v prekombinované formě v tabletách dávivý[50] nebo protijed. Paradote byla tableta prodávaná ve Velké Británii, která kombinovala 500 mg paracetamolu se 100 mg methionin,[52] dříve aminokyselina[18] používaný při léčbě předávkování paracetamolem.
Dosud nebyly provedeny žádné studie o účinnosti paracetamolu, pokud se podává v kombinaci s jeho nejčastěji používaným antidotem, acetylcysteinem.[53]
Kalcitriol, aktivní metabolit Vitamín D3, se zdá být katalyzátorem produkce glutathionu.[54] Bylo zjištěno, že kalcitriol zvyšuje hladiny glutathionu v primárních kulturách potkaních astrocytů v průměru o 42%, což zvyšuje koncentrace glutathionového proteinu z 29 nmol / mg na 41 nmol / mg, 24 a 48 hodin po podání; nadále ovlivňoval hladiny glutathionu 96 hodin po podání.[55] Bylo navrženo, že současné podávání kalcitriolu prostřednictvím injekce může zlepšit výsledky léčby.
Náhrady paracetamolu
Ester paracetamolu proléčivo s kyselinou L-pyroglutamovou (PCA), biosyntetickým prekurzorem glutathionu, byl syntetizován za účelem snížení hepatotoxicity paracetamolu a zlepšení biologické dostupnosti. Toxikologické studie různých esterů paracetamolu ukazují, že L-5-oxo-pyrrolidin-2-paracetamolkarboxylát snižuje toxicitu po podání předávkování paracetamolem myším. Hodnoty jaterního glutathionu u myší vyvolané intraperitoneální injekcí esteru jsou superimposable s hladinami GSH zaznamenanými v kontrolní skupině neošetřených myší. Skupina myší ošetřená ekvivalentní dávkou paracetamolu vykázala významné snížení glutathionu o 35% (p <0,01 vs. neošetřená kontrolní skupina). Ústní LD50 bylo zjištěno, že je vyšší než 2 000 mg kg-1, zatímco intraperitoneální LD50 byla 1 900 mg kg-1. Tyto výsledky společně s dobrými údaji o hydrolýze a biologické dostupnosti ukazují, že tento ester je potenciálním kandidátem jako proléčivo paracetamolu.[56]
Léčba
Dekontaminace žaludku
U dospělých je počáteční léčbou předávkování paracetamolem gastrointestinální dekontaminace. Absorpce paracetamolu z gastrointestinálního traktu je za normálních okolností úplná do dvou hodin, takže dekontaminace je nejužitečnější, pokud je provedena v tomto časovém rámci. Výplach žaludku, lépe známý jako čerpání žaludku, lze zvážit, pokud je požité množství potenciálně život ohrožující a postup lze provést do 60 minut po požití.[57] Aktivní uhlí je nejběžnějším postupem dekontaminace trávicího traktu adsorbce paracetamol, což snižuje jeho gastrointestinální absorpci.[58][59] Podávání aktivního uhlí také představuje menší riziko aspirace než výplach žaludku.[60]
Zdá se, že největší užitek z aktivního uhlí je získán, pokud je podán do 30 minut až dvou hodin po požití.[61][62] U pacientů, kteří mohou mít, lze zvážit podání aktivního uhlí později než 2 hodiny opožděné vyprazdňování žaludku v důsledku současně užívaných léků nebo po požití paracetamolových přípravků s prodlouženým nebo zpožděným uvolňováním. Aktivní uhlí by se mělo podávat také v případě, že současně užívaná léčiva vyžadují dekontaminaci.[40] Při předávkování paracetamolem se zdráhalo podávat aktivní uhlí z důvodu obav, že může také absorbovat perorální antidotum acetylcystein.[63] Studie prokázaly, že při společném podávání se do těla vstřebává o 39% méně acetylcysteinu.[64] Existují protichůdná doporučení ohledně toho, zda změnit dávkování orálního acetylcysteinu po podání aktivního uhlí, a dokonce i to, zda je třeba dávkování acetylcysteinu vůbec změnit.[64][65] Intravenózní acetylcystin nemá žádnou interakci s aktivním uhlím.
Vyvolání zvracení pomocí sirup ipecac při předávkování paracetamolem nemá žádnou roli, protože zvracení, které vyvolává, zpomaluje účinné podávání aktivního uhlí a perorálního acetylcysteinu.[17] Po akutním náhodném požití u dětí mladších 6 let je poškození jater extrémně vzácné. Děti s náhodnou expozicí nevyžadují gastrointestinální dekontaminaci výplachem žaludku, aktivním uhlím nebo sirupem z ipecacu.[18]
Acetylcystein
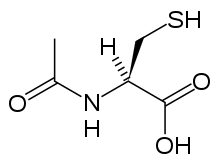
Acetylcystein, také zvaný N-acetylcystein nebo NAC, pracuje na snížení toxicity paracetamolu doplňováním zásob antioxidantu v těle glutathion. Glutathion reaguje s toxickým metabolitem NAPQI tak, že nepoškozuje buňky a může být bezpečně vylučován.[66] NAC byl obvykle podáván po léčbě nomogram (jeden pro pacienty s rizikovými faktory a jeden pro osoby bez), ale použití nomogramu se již nedoporučuje, protože důkazní základna pro podporu použití rizikových faktorů byla špatná a nekonzistentní a mnoho z rizikových faktorů je nepřesných a obtížně proveditelných určit s dostatečnou jistotou v klinické praxi.[67] Cysteamin a methionin byly také použity k prevenci hepatotoxicity,[68] ačkoli studie ukazují, že oba jsou spojeny s více nepříznivými účinky než acetylcystein.[18] Navíc se ukázalo, že acetylcystein je účinnějším antidotem, zejména u pacientů, kteří mají více než 8 hodin po požití[69] a pro ty, kteří mají příznaky selhání jater.[59]
Pokud se osoba projeví méně než osm hodin po předávkování paracetamolem, pak acetylcystein výrazně snižuje riziko závažné hepatotoxicity a zaručuje přežití.[18] Pokud je acetylcystein spuštěn více než 8 hodin po požití, dochází k prudkému poklesu jeho účinnosti, protože kaskáda toxických událostí v játrech již začala a riziko akutní nekrózy jater a úmrtí dramaticky stoupá. Ačkoli je acetylcystein nejúčinnější, pokud je podáván včas, stále má příznivé účinky, pokud je podáván až 48 hodin po požití.[70][potřebuje aktualizaci ] Pokud se osoba projeví více než osm hodin po předávkování paracetamolem, není aktivní uhlí aktivní a okamžitě se zahájí podávání acetylcysteinu. V dřívějších prezentacích lze uhlí podat, když přijde pacient a zahájí se podávání acetylcysteinu během čekání na návrat výsledků hladiny paracetamolu z laboratoře.[18]
V praxi Spojených států intravenózní (IV) a orální podání se považují za stejně účinné a bezpečné, pokud se podají do 8 hodin po požití.[71][72] IV je však jedinou doporučenou cestou v australasské a britské praxi.[18][73] Perorální acetylcystein se podává jako 140 mg / kg nasycovací dávka následně 70 mg / kg každé čtyři hodiny po dobu dalších 17 dávek, a pokud pacient zvrací do 1 hodiny po podání dávky, je třeba dávku opakovat.[74][75] Perorální acetylcystein může být špatně tolerován kvůli jeho nepříjemné chuti, zápachu a tendenci vyvolávat nevolnost a zvracení.[71] Pokud jsou indikovány opakované dávky aktivního uhlí z důvodu jiného požitého léčiva, měly by být následující dávky aktivního uhlí a acetylcysteinu rozloženy.[40]
Intravenózní acetylcystein se podává formou kontinuální infuze po dobu 20 hodin v celkové dávce 300 mg / kg. Doporučené podávání zahrnuje infuzi nasycovací dávky 150 mg / kg po dobu 15 až 60 minut, následovanou infuzí 50 mg / kg po dobu čtyř hodin; posledních 100 mg / kg se aplikuje infuzí po zbývajících 16 hodin protokolu.[18] Výhodou intravenózního acetylcysteinu je zkrácení pobytu v nemocnici, zvýšení pohodlí lékaře i pacienta a umožnění podávání aktivního uhlí ke snížení absorpce paracetamolu i všech současně užívaných léků bez obav z interference s perorálním acetylcysteinem.[76][potřebuje aktualizaci ] Intravenózní dávkování se liší podle hmotnosti, zejména u dětí. U pacientů s hmotností nižší než 20 kg je nasycovací dávka 150 mg / kg ve 3 ml / kg ředidla, podávaná po dobu 60 minut; druhá dávka je 50 mg / kg v 7 ml / kg ředidla po dobu 4 hodin; a třetí a poslední dávka je 100 mg / kg ve 14 ml / kg ředidla po dobu 16 hodin.[75]
Nejběžnějším nepříznivým účinkem léčby acetylcysteinem je anafylaktoidní reakce, obvykle se projevuje vyrážkou, sípáním nebo mírným projevem hypotenze. Nežádoucí účinky jsou častější u lidí léčených i.v. acetylcysteinem, vyskytují se až u 20% pacientů.[77][78] Anafylaktoidní reakce se pravděpodobněji vyskytnou při první infuzi (nasycovací dávce).[77] U predisponovaných jedinců, jako jsou pacienti s, se vzácně mohou objevit závažné život ohrožující reakce astma nebo atopická dermatitida a mohou být charakterizovány dýchacími potížemi, otoky obličeje a dokonce smrtí.[77][79][80]
Pokud dojde k anafylaktoidní reakci, je acetylcystein dočasně zastaven nebo zpomalen a antihistaminika a je poskytována další podpůrná péče.[77][81][82] Například nebulizovaný beta-agonista, jako je salbutamol, může být indikován v případě významného bronchospasmu (nebo profylakticky u pacientů s anamnézou bronchospasmu sekundárně k acetylcysteinu). Je také důležité pečlivě sledovat tekutiny a elektrolyty.[77]
Transplantace jater
U lidí, kteří se vyvíjejí akutní selhání jater nebo u nichž se jinak očekává, že zemřou na selhání jater, je základem managementu transplantace jater.[50] Transplantace jater se provádějí ve specializovaných centrech. Nejčastěji používaná kritéria pro transplantaci jater byla vyvinuta lékaři v King's College Hospital v Londýně. Pacientům se doporučuje transplantace, pokud mají pH arteriální krve nižší než 7,3 tekutá resuscitace nebo pokud má pacient encefalopatii stupně III nebo IV, protrombinový čas větší než 100 sekund a sérového kreatininu vyšší než 300 mmol / L za 24 hodin.[83] Byly použity i jiné formy podpory jater, včetně částečných transplantací jater. Výhodou těchto technik je podpora pacienta při regeneraci jeho vlastních jater. Jakmile se funkce jater vrátí imunosupresivní léky jsou zahájeny a musí po zbytek života užívat imunosupresivní léky.[84][85]
Prognóza
The úmrtnost předávkování paracetamolem se zvyšuje dva dny po požití, dosáhne maxima čtvrtého dne a poté postupně klesá. Acidóza je nejdůležitějším jediným ukazatelem pravděpodobné úmrtnosti a potřeby transplantace. Míra úmrtnosti 95% bez transplantace byla hlášena u pacientů, kteří měli dokumentovanou pH méně než 7,30. Mezi další ukazatele špatné prognózy patří chronické onemocnění ledvin (stupeň 3 nebo horší), jaterní encefalopatie, výrazně zvýšený protrombinový čas nebo zvýšená krev kyselina mléčná úroveň (laktátová acidóza ).[83][86] Jedna studie ukázala, že a faktor V hladina nižší než 10% normálu indikovala špatnou prognózu (91% úmrtnost), zatímco poměr faktor VIII faktor V menší než 30 indikoval dobrou prognózu (100% přežití).[87] Pacienti se špatnou prognózou jsou obvykle identifikováni pro pravděpodobnou transplantaci jater.[83] U pacientů, kteří nezemřou, se očekává úplné uzdravení a normální stav délka života a kvalita života.[88]
Epidemiologie
Mnoho volně prodejné a pouze na lékařský předpis léky obsahují paracetamol. Vzhledem k jeho široké dostupnosti spárované se srovnatelně vysokou toxicitou (ve srovnání s ibuprofen a aspirin ) existuje mnohem vyšší potenciál předávkování.[89] Toxicita paracetamolu je jednou z nejčastějších příčin otravy na celém světě.[23] Ve Spojených státech, Velké Británii, Austrálii a na Novém Zélandu je paracetamol nejčastější příčinou předávkování drogami.[18][90][91] Navíc ve Spojených státech a Velké Británii je nejčastější příčinou akutního selhání jater.[92][8]
v Anglie a Wales podle odhadů došlo v letech 1989 až 1990 k 41 200 případům otravy paracetamolem, přičemž úmrtnost činila 0,40%. Odhaduje se, že v Anglii a Walesu každoročně dochází v důsledku otravy k 150 až 200 úmrtím a 15 až 20 transplantacím jater.[78] Předávkování paracetamolem vede k většímu počtu volání toxikologická centra v USA než předávkování jakoukoli jinou farmakologickou látkou, což představuje více než 100 000 hovorů, stejně jako 56 000 návštěv pohotovosti, 2 600 hospitalizací a 458 úmrtí v důsledku akutního selhání jater ročně.[93] Studie případů akutního selhání jater provedená v období od listopadu 2000 do října 2004 Centra pro kontrolu a prevenci nemocí v USA zjistili, že paracetamol byl příčinou 41% všech případů u dospělých a 25% případů u dětí.[94]
Reference
- ^ A b C d E F G h i j k l m n Ó p q r Ferri, Fred F. (2016). E-kniha Ferriho klinického poradce 2017: 5 knih v 1. Elsevier Health Sciences. str. 11. ISBN 9780323448383. Archivováno od originálu 10. září 2017. Citováno 6. července 2017.
- ^ A b Woolley, David; Woolley, Adam (2017). Praktická toxikologie: hodnocení, predikce a rizika, třetí vydání. CRC Press. str. 330. ISBN 9781498709309. Archivováno od originálu 10. září 2017. Citováno 5. července 2017.
- ^ Proudfoot, A. T .; Wright, N. (5. září 1970). „Akutní otrava paracetamolem“. BMJ. 3 (5722): 557–558. doi:10.1136 / bmj.3.5722.557.
- ^ Ferner, R.E .; Vážený, J. W .; Bateman, D. N. (19. dubna 2011). "Řízení otravy paracetamolem". BMJ. 342 (19. dubna 2): d2218 – d2218. doi:10.1136 / bmj.d2218.
- ^ A b C d E Webb, Andrew; Gattinoni, Luciano (2016). Oxfordská učebnice kritické péče. Oxford University Press. str. 1518. ISBN 9780199600830. Archivováno od originálu 10. září 2017. Citováno 6. července 2017.
- ^ A b Prout, Jeremy; Jones, Tanya; Martin, Daniel (2014). Pokročilý výcvik v anestezii. OUP Oxford. str. 166. ISBN 9780191511776. Archivováno od originálu 10. září 2017.
- ^ Yamada, Tadataka (2011). Učebnice gastroenterologie. John Wiley & Sons. str. PT4008. ISBN 9781444359411. Archivováno od originálu 10. září 2017.
- ^ A b Ryder SD, Beckingham IJ (únor 2001). „Další příčiny onemocnění jater parenchymů“. BMJ (Clinical Research Ed.). 322 (7281): 290–2. doi:10.1136 / bmj.322.7281.290. PMC 1119531. PMID 11157536.
- ^ A b C Rumack B, Matthew H (1975). „Otrava a toxicita acetaminofenem“. Pediatrie. 55 (6): 871–76. PMID 1134886.
- ^ Zezulka A, Wright N (září 1982). "Těžká metabolická acidóza na počátku otravy paracetamolem". British Medical Journal (Clinical Research Ed.). 285 (6345): 851–2. doi:10.1136 / bmj.285.6345.851. PMC 1499688. PMID 6811039.
- ^ Roth B, Woo O, Blanc P (duben 1999). „Časná metabolická acidóza a kóma po požití acetaminofenu“. Annals of Emergency Medicine. 33 (4): 452–6. doi:10.1016 / S0196-0644 (99) 70312-4. PMID 10092726.
- ^ A b C Slyšel KJ (červenec 2008). "Acetylcystein pro otravu acetaminofenem". The New England Journal of Medicine. 359 (3): 285–92. doi:10.1056 / NEJMct0708278. PMC 2637612. PMID 18635433.
- ^ Boutis K, Shannon M (2001). "Nefrotoxicita po akutní těžké otravě acetaminofenem u dospívajících". Journal of Toxicology: Clinical Toxicology. 39 (5): 441–5. doi:10.1081 / CLT-100105413. PMID 11545233.
- ^ Linden CH, Rumack BH (únor 1984). „Předávkování acetaminofenem“. Kliniky urgentní medicíny v Severní Americe. 2 (1): 103–19. PMID 6394298.
- ^ Výzkum, Centrum pro hodnocení drog a. „Bezpečnost a dostupnost léků - upozornění pro průmysl: Konečné pokyny pro volně prodejné produkty, které obsahují acetaminofen“. www.fda.gov. Archivováno z původního 22. července 2017. Citováno 22. srpna 2017.
- ^ „Paracetamol pro dospělé: lék proti bolesti k léčbě bolestí, horeček - NHS.UK“. NHS.UK. Archivováno od originálu 22. srpna 2017. Citováno 22. srpna 2017.
- ^ A b C Dart RC, Erdman AR, Olson KR, Christianson G, Manoguerra AS, Chyka PA, Caravati EM, Wax PM, Keyes DC, Woolf AD, Scharman EJ, Booze LL, Troutman WG; Americká asociace toxikologických center (2006). „Otrava acetaminofenem: konsenzuální směrnice založená na důkazech pro řízení mimo nemocnici“. Klinická toxikologie. 44 (1): 1–18. doi:10.1080/15563650500394571. PMID 16496488.CS1 maint: více jmen: seznam autorů (odkaz)
- ^ A b C d E F G h i j k l m n Daly FF, Fountain JS, Murray L, Graudins A, Buckley NA (březen 2008). „Pokyny pro zvládání otravy paracetamolem v Austrálii a na Novém Zélandu - vysvětlení a rozpracování. Prohlášení konsensu od konzultací klinických toxikologů s informačními centry australaských jedů“. Medical Journal of Australia. 188 (5): 296–301. doi:10.5694 / j.1326-5377.2008.tb01625.x. PMID 18312195. Archivováno z původního 23. července 2008.
- ^ Watkins PB, Kaplowitz N, Slattery JT a kol. (Červenec 2006). „Zvýšení aminotransferázy u zdravých dospělých, kteří dostávají 4 gramy acetaminofenu denně: randomizovaná kontrolovaná studie“. JAMA: The Journal of the American Medical Association. 296 (1): 87–93. doi:10.1001 / jama.296.1.87. PMID 16820551.
- ^ Dart RC, Bailey E (2007). „Způsobuje terapeutické použití acetaminofenu akutní selhání jater?“. Farmakoterapie. 27 (9): 1219–30. doi:10.1592 / phco.27.9.1219. PMID 17723075.
- ^ Daly FF, O'Malley GF, Heard K, Bogdan GM, Dart RC (říjen 2004). "Perspektivní hodnocení opakovaného požití supratherapeutického požití acetaminofenu (paracetamolu)". Annals of Emergency Medicine. 44 (4): 393–8. doi:10.1016 / j.annemergmed.2004.05.005. PMID 15459622.
- ^ Tenenbein M (2004). „Acetaminofen: mýtus 150 mg / kg“. Journal of Toxicology: Clinical Toxicology. 42 (2): 145–8. doi:10.1081 / CLT-120030939. PMID 15214618.
- ^ A b Gunnell D, Murray V, Hawton K (2000). „Použití paracetamolu (acetaminofenu) k sebevraždě a nefatální otravě: celosvětové vzorce užívání a zneužití“. Sebevražda a život ohrožující chování. 30 (4): 313–26. PMID 11210057.
- ^ Kapur, Navneet; Turnbull, Pauline; Hawton, Keith; Simkin, Sue; Mackway-Jones, Kevin; Gunnel, David (červen 2006). „Nemocniční management smrtelné otravy v průmyslově vyspělých zemích: příležitost k prevenci sebevražd?“. Sebevražda a život ohrožující chování. 36 (3): 302–12. doi:10.1521 / suli.2006.36.3.302. PMID 16805658.
- ^ Vuppalanchi R, Liangpunsakul S, Chalasani N (březen 2007). „Etiologie nově vzniklé žloutenky: jak často je způsobena idiosynkratickým poškozením jater vyvolaným drogami ve Spojených státech?“. Dopoledne. J. Gastroenterol. 102 (3): 558–62, kvíz 693. PMID 17156142.
- ^ Zimmerman HJ, Maddrey WC (1995). „Acetaminofen (paracetamol) hepatotoxicita při pravidelném požívání alkoholu: analýza případů terapeutické nehody“. Hepatologie. 22 (3): 767–73. doi:10.1002 / hep. 1840220312. PMID 7657281.
- ^ A b Dargan PI, Jones AL (2002). „Měla by se při léčbě otravy paracetamolem u pacientů s chronickým alkoholismem použít nižší linie léčby: případ proti“. Bezpečnost léčiv. 25 (9): 625–32. doi:10.2165/00002018-200225090-00002. PMID 12137557.
- ^ Buckley NA, Srinivasan J (2002). „Měla by se při léčbě otravy paracetamolem u pacientů s chronickým alkoholismem použít nižší linie léčby: případ pro“. Bezpečnost léčiv. 25 (9): 619–24. doi:10.2165/00002018-200225090-00001. PMID 12137556.
- ^ Schmidt LE, Dalhoff K, Poulsen HE (duben 2002). „Akutní versus chronická konzumace alkoholu při hepatotoxicitě vyvolané acetaminofenem“. Hepatologie. 35 (4): 876–82. doi:10.1053 / jhep.2002.32148. PMID 11915034.
- ^ Crippin JS (duben 1993). "Acetaminofenová hepatotoxicita: potenciace isoniazidem". The American Journal of Gastroenterology. 88 (4): 590–2. PMID 8470644.
- ^ Nolan CM, Sandblom RE, Thummel KE, Slattery JT, Nelson SD (1994). „Hepatotoxicita spojená s užíváním acetaminofenu u pacientů léčených tuberkulózou na více lécích“. Hruď. 105 (2): 408–11. doi:10,1378 / hrudník.105.2.408. PMID 7508362.
- ^ Bray GP, Harrison PM, O'Grady JG, Tredger JM, Williams R (červenec 1992). „Dlouhodobá antikonvulzivní léčba zhoršuje výsledek fulminantního selhání jater vyvolaného paracetamolem“. Lidská a experimentální toxikologie. 11 (4): 265–70. doi:10.1177/096032719201100405. PMID 1354974.
- ^ A b C d Metabolismus acetaminofenu (paracetamolu), acetanilidu a fenacetinu Archivováno 30. srpna 2012, v Wayback Machine
- ^ A b Richardson, JA (červenec – září 2000). „Řízení toxikóz acetaminofenu a ibuprofenu u psů a koček“ (PDF). Journal of Veterinary Emergency and Critical Care. 10 (4): 285–291. doi:10.1111 / j.1476-4431.2000.tb00013.x. Archivovány od originál (PDF) dne 22. listopadu 2008.
- ^ Rumbeiha WK, Lin YS, Oehme FW (listopad 1995). „Srovnání N-acetylcysteinu a methylenové modři, samostatně nebo v kombinaci, pro léčbu toxikózy acetaminofenem u koček“. American Journal of Veterinary Research. 56 (11): 1529–33. PMID 8585668.
- ^ Corcoran GB, Mitchell JR, Vaishnav YN, Horning EC (listopad 1980). „Důkazy, že acetaminofen a N-hydroxyacetaminofen tvoří běžný arylační meziprodukt, N-acetyl-p-benzochinonimin“. Molekulární farmakologie. 18 (3): 536–42. PMID 7464816.
- ^ A b Mitchell JR, Jollow DJ, Potter WZ, Gillette JR, Brodie BB (říjen 1973). „Jaterní nekróza vyvolaná acetaminofenem. IV. Ochranná role glutathionu“. The Journal of Pharmacology and Experimental Therapeutics. 187 (1): 211–7. PMID 4746329.
- ^ Dai Y, Cederbaum AI (červen 1995). "Cytotoxicita acetaminofenu v buňkách HepG2 transfekovaných lidským cytochromem P4502E1". The Journal of Pharmacology and Experimental Therapeutics. 273 (3): 1497–505. PMID 7791125.
- ^ Camilleri, R. (červen 2015). „Metaanalýza spolehlivosti historie při podezření na otravu“. The Journal of Emergency Medicine. 48 (6): 679–84. doi:10.1016 / j.jemermed.2014.12.067. PMID 25827782.
- ^ A b C d Farrell, Susan E. (3. října 2007). „Toxicita, acetaminofen“. emedicína. Archivováno z původního 29. října 2008. Citováno 9. listopadu 2008.
- ^ Bartlett D (červen 2004). "Toxicita pro acetaminofen". Journal of Emergency Nursing. 30 (3): 281–3. doi:10.1016 / j.jen.2004.01.023. PMID 15192687.
- ^ Jones AL (březen 2000). „Nedávný pokrok v léčbě pozdní otravy paracetamolem“. Emergency Medicine Australasia. 12 (1): 14–21. doi:10.1046 / j.1442-2026.2000.00088.x.
- ^ John Marx; Ron Walls; Robert Hockberger (2013). Rosenova urgentní medicína - koncepty a klinická praxe. Elsevier Health Sciences. ISBN 9781455749874.
- ^ Shihana F, Dissanayake D, Dargan P, Dawson A (2010). „Upravená nízkonákladová kolorimetrická metoda pro měření paracetamolu (acetaminofenu) v plazmě“. Clin Toxicol. 48 (1): 42–46. doi:10.3109/15563650903443137. PMC 3145116. PMID 20095813.
- ^ R. Baselt, Dispozice toxických drog a chemických látek u člověka, 9. vydání, Biomedical Publications, Seal Beach, CA, 2011, s. 9–12.
- ^ Hughes B, Durran A, Langford NJ, Mutimer D (srpen 2003). „Otrava paracetamolem - dopad omezení velikosti balení“. Journal of Clinical Pharmacy and Therapeutics. 28 (4): 307–10. doi:10.1046 / j.1365-2710.2003.00497.x. PMID 12911683.
- ^ Sheen CL, Dillon JF, Bateman DN, Simpson KJ, Macdonald TM (září 2002). „Toxicita paracetamolu: epidemiologie, prevence a náklady na systém zdravotní péče“. QJM: Měsíční věstník Asociace lékařů. 95 (9): 609–19. doi:10.1093 / qjmed / 95,9609. PMID 12205339.
- ^ Laffoy M, Scallan E, Byrne G (2001). "Dostupnost paracetamolu a předávkování v Irsku". Irish Medical Journal. 94 (7): 212–4. PMID 11693213.
- ^ Gunnell D, Hawton K, Bennewith O, Cooper J, Simkin S, Donovan J, Evans J, Longson D, O'Connor S, Kapur N (říjen 2013). "3. Studie hodnotící dopad právních předpisů Spojeného království z roku 1998 omezujících velikost balení paracetamolu". Multicentrický program klinického výzkumu a výzkumu veřejného zdraví na podporu Národní strategie prevence sebevražd pro Anglii. Knihovna časopisů NIHR.
- ^ A b C Dargan PI, Jones AL (duben 2003). "Řízení otravy paracetamolem". Trendy ve farmakologických vědách. 24 (4): 154–7. doi:10.1016 / S0165-6147 (03) 00053-1. PMID 12706999.
- ^ Jones A (2002). „Volně prodejná analgetika: toxikologická perspektiva“. Jsem J Ther. 9 (3): 245–57. doi:10.1097/00045391-200205000-00010. PMID 11941384.
- ^ Heptonstall JP (duben 2006). „Je čas na výrobu paracetamolu s methioninem“. BMJ (Clinical Research Ed.). 332 (7544): 795. doi:10.1136 / bmj.332.7544.795-b. PMC 1420701. PMID 16575097.
- ^ Chang, Matthew. „Acetaminofen v kombinaci s N-acetylcysteinem (NAC) versus placebo při léčbě horečky“. Archivováno z původního dne 19. října 2012. Citováno 17. listopadu 2012.
- ^ Garcion, E .; Wion-Barbot, N .; Montero-Menei, C .; Berger, F .; Wion, D. (2002). "Nové stopy o funkcích vitaminu D v nervovém systému". Trendy v endokrinologii a metabolismu. 13 (3): 100–5. doi:10.1016 / S1043-2760 (01) 00547-1. PMID 11893522.
- ^ Garcion, E .; Sindji, L .; Leblondel, G .; Brachet, P .; Darcy, F. (2002). „1,25-Dihydroxyvitamin D3 reguluje syntézu hladin γ-glutamyltranspeptidázy a glutathionu v primárních astrocytech krysy“. Journal of Neurochemistry. 73 (2): 859–866. doi:10.1046 / j.1471-4159.1999.0730859.x. PMID 10428085.,
- ^ Bousquet E, Marrazzo A, Puglisi G, Spadaro A (1996). „Syntéza, fyzikální vlastnosti, toxikologické studie a biologická dostupnost esterů L-pyroglutamové a L-glutamové kyseliny paracetamolu jako potenciálně užitečných proléčiv“. J Pharm Pharmacol. 48 (5): 479–85. doi:10.1111 / j.2042-7158.1996.tb05958.x. PMID 8799871.
- ^ Vale JA, Kulig K; Americká akademie klinické toxikologie; Evropská asociace toxikologických center a klinických toxikologů (2004). "Poziční papír: výplach žaludku". Journal of Toxicology: Clinical Toxicology. 42 (7): 933–43. doi:10.1081 / CLT-200045006. PMID 15641639.CS1 maint: více jmen: seznam autorů (odkaz)
- ^ Spiller HA, Sawyer TS (srpen 2007). „Dopad aktivního uhlí po akutním předávkování acetaminofenem ošetřeném N-acetylcysteinem“. The Journal of Emergency Medicine. 33 (2): 141–4. doi:10.1016 / j.jemermed.2007.02.016. PMID 17692765.
- ^ A b Chiew, AL; Gluud, C; Brok, J; Buckley, NA (23. února 2018). „Intervence při předávkování paracetamolem (acetaminofenem)“. Cochrane Database of Systematic Reviews. 2: CD003328. doi:10.1002 / 14651858.CD003328.pub3. PMC 6491303. PMID 29473717.
- ^ Buckley NA, Whyte IM, O'Connell DL, Dawson AH (1999). „Aktivní uhlí snižuje potřebu léčby N-acetylcysteinem po předávkování acetaminofenem (paracetamol).“ Journal of Toxicology: Clinical Toxicology. 37 (6): 753–7. doi:10.1081 / CLT-100102452. PMID 10584587.
- ^ Isbister G, Whyte I, Dawson A (2001). „Předávkování dětským acetaminofenem“. Journal of Toxicology: Clinical Toxicology. 39 (2): 169–72. doi:10.1081 / CLT-100103834. PMID 11407504.
- ^ Buckley NA, Whyte IM, O'Connell DL, Dawson AH (1999). „Aktivní uhlí snižuje potřebu léčby N-acetylcysteinem po předávkování acetaminofenem (paracetamolem)“. Journal of Toxicology: Clinical Toxicology. 37 (6): 753–7. doi:10.1081 / CLT-100102452. PMID 10584587.
- ^ Renzi FP, Donovan JW, Martin TG, Morgan L, Harrison EF (červen 1985). "Souběžné použití aktivního uhlí a N-acetylcysteinu". Annals of Emergency Medicine. 14 (6): 568–72. doi:10.1016 / S0196-0644 (85) 80781-2. PMID 3994080.
- ^ A b Ekins BR, Ford DC, Thompson MI, Bridges RR, Rollins DE, Jenkins RD (November 1987). "The effect of activated charcoal on N-acetylcysteine absorption in normal subjects". American Journal of Emergency Medicine. 5 (6): 483–7. doi:10.1016/0735-6757(87)90166-5. PMID 3663288.
- ^ Spiller HA, Krenzelok EP, Grande GA, Safir EF, Diamond JJ (March 1994). "A prospective evaluation of the effect of activated charcoal before oral N-acetylcysteine in acetaminophen overdose". Annals of Emergency Medicine. 23 (3): 519–23. doi:10.1016/S0196-0644(94)70071-0. PMID 8135427.
- ^ Piperno E, Berssenbruegge DA (October 1976). "Reversal of experimental paracetamol toxicosis with N-acetylcysteine". Lanceta. 2 (7988): 738–9. doi:10.1016/S0140-6736(76)90030-1. PMID 61415.
- ^ "Paracetamol overdose: new guidance on treatment with intravenous acetylcysteine". Drug Safety Update. 6 (2): A1. Září 2012. Archivovány od originál 27. října 2012.
- ^ Mant TG, Tempowski JH, Volans GN, Talbot JC (July 1984). "Adverse reactions to acetylcysteine and effects of overdose". British Medical Journal (Clinical Research Ed.). 289 (6439): 217–9. doi:10.1136/bmj.289.6439.217. PMC 1442311. PMID 6234965.
- ^ Alsalim W, Fadel M (July 2003). "Oral methionine compared with intravenous n-acetyl cysteine for paracetamol overdose". Emergency Medicine Journal. 20 (4): 366–7. doi:10.1136/emj.20.4.366. PMC 1726135. PMID 12835357.
- ^ Keays R, Harrison P, Wendon J, Forbes A, Gove C, Alexander G, Williams R (1991). "Intravenous acetylcysteine in paracetamol induced fulminant hepatic failure: a prospective controlled trial". BMJ. 303 (6809): 1026–9. doi:10.1136/bmj.303.6809.1026. PMC 1671790. PMID 1954453.
- ^ A b Kanter MZ (October 2006). "Comparison of oral and i.v. acetylcysteine in the treatment of acetaminophen poisoning". American Journal of Health-System Pharmacy. 63 (19): 1821–7. doi:10.2146/ajhp060050. PMID 16990628.
- ^ Schwarz, E .; Cohn, B. (2014). "Is Intravenous Acetylcysteine More Effective Than Oral Administration for the Prevention of Hepatotoxicity in Acetaminophen Overdose?". Annals of Emergency Medicine. 63 (1): 79–80. doi:10.1016/j.annemergmed.2013.07.002. PMID 23927960.
- ^ Selvan VA, Calvert SH, Cavell G, Glucksman E, Kerins M, Gonzalez J (July 2007). "Weight‐based N‐acetylcysteine dosing chart to minimise the risk of calculation errors in prescribing and preparing N‐acetylcysteine infusions for adults presenting with paracetamol overdose in the emergency department". Emergency Medicine Journal. 24 (7): 482–4. doi:10.1136/emj.2006.043141. PMC 2796160. PMID 17582039.
- ^ Woo OF, Mueller PD, Olson KR, Anderson IB, Kim SY (April 2000). "Shorter duration of oral N-acetylcysteine therapy for acute acetaminophen overdose". Annals of Emergency Medicine. 35 (4): 363–8. doi:10.1016/S0196-0644(00)70055-2. PMID 10736123.
- ^ A b "Acetaminophen Overdose and NAC Dosing". MDCalc. Archivováno od originálu 4. února 2014. Citováno 10. února 2014.
- ^ Buckley N, Whyte I, O'Connell D, Dawson A (1999). "Oral or intravenous N-acetylcysteine: which is the treatment of choice for acetaminophen (paracetamol) poisoning?". Journal of Toxicology: Clinical Toxicology. 37 (6): 759–67. doi:10.1081/CLT-100102453. PMID 10584588.
- ^ A b C d E Warren, Gemma (February 2016). "Trust Wide Intravenous Acetylcysteine for Paracetamol Toxicity in Adults Guideline". Nottingham University Hospitals. Chybějící nebo prázdný
| url =(Pomoc) - ^ A b Buckley N, Eddleston M (December 2005). "Paracetamol (acetaminophen) poisoning". Klinické důkazy (14): 1738–44. PMID 16620471.
- ^ Appelboam AV, Dargan PI, Knighton J (November 2002). "Fatal anaphylactoid reaction to N-acetylcysteine: caution in patients with asthma". Emergency Medicine Journal. 19 (6): 594–5. doi:10.1136/emj.19.6.594. PMC 1756296. PMID 12421803.
- ^ Schmidt LE, Dalhoff K (January 2001). "Risk factors in the development of adverse reactions to N-acetylcysteine in patients with paracetamol poisoning". British Journal of Clinical Pharmacology. 51 (1): 87–91. doi:10.1046/j.1365-2125.2001.01305.x. PMC 2014432. PMID 11167669.
- ^ Prescott LF, Park J, Ballantyne A, Adriaenssens P, Proudfoot AT (August 1977). "Treatment of paracetamol (acetaminophen) poisoning with N-acetylcysteine". Lanceta. 2 (8035): 432–4. doi:10.1016/S0140-6736(77)90612-2. PMID 70646.
- ^ Bailey B, McGuigan MA (June 1998). "Management of anaphylactoid reactions to intravenous N-acetylcysteine". Annals of Emergency Medicine. 31 (6): 710–5. doi:10.1016/S0196-0644(98)70229-X. PMID 9624310.
- ^ A b C O'Grady JG, Alexander GJ, Hayllar KM, Williams R (August 1989). "Časné ukazatele prognózy při fulminantním selhání jater". Gastroenterologie. 97 (2): 439–45. doi:10.1016/0016-5085(89)90081-4. PMID 2490426.
- ^ Jaeck D, Boudjema K, Audet M, Chenard-Neu MP, Simeoni U, Meyer C, Nakano H, Wolf P (2002). "Auxiliary partial orthotopic liver transplantation (APOLT) in the treatment of acute liver failure". Journal of Gastroenterology. 37 Suppl 13: 88–91. doi:10.1007/BF02990107. PMID 12109674.
- ^ Lodge JP, Dasgupta D, Prasad KR, Attia M, Toogood GJ, Davies M, Millson C, Breslin N, Wyatt J, Robinson PJ, Bellamy MC, Snook N, Pollard SG (February 2008). "Emergency subtotal hepatectomy: a new concept for acetaminophen-induced acute liver failure: temporary hepatic support by auxiliary orthotopic liver transplantation enables long-term success". Annals of Surgery. 247 (2): 238–49. doi:10.1097/SLA.0b013e31816401ec. PMID 18216528.
- ^ Bernal W, Donaldson N, Wyncoll D, Wendon J (February 2002). "Blood lactate as an early predictor of outcome in paracetamol-induced acute liver failure: a cohort study". Lanceta. 359 (9306): 558–63. doi:10.1016/S0140-6736(02)07743-7. PMID 11867109.
- ^ Pereira LM, Langley PG, Hayllar KM, Tredger JM, Williams R (1992). "Coagulation factor V and VIII/V ratio as predictors of outcome in paracetamol induced fulminant hepatic failure: relation to other prognostic indicators". Střevo. 33 (1): 98–102. doi:10.1136/gut.33.1.98. PMC 1373872. PMID 1740285.
- ^ Ding GK, Buckley NA (September 2008). "Evidence and consequences of spectrum bias in studies of criteria for liver transplant in paracetamol hepatotoxicity". QJM: Měsíční věstník Asociace lékařů. 101 (9): 723–9. doi:10.1093/qjmed/hcn077. PMID 18606611.
- ^ Sheen C, Dillon J, Bateman D, Simpson K, Macdonald T (2002). "Paracetamol toxicity: epidemiology, prevention and costs to the health-care system". QJM: Měsíční věstník Asociace lékařů. 95 (9): 609–19. doi:10.1093/qjmed/95.9.609. PMID 12205339. Archivováno from the original on January 29, 2009.
- ^ Hawkins LC, Edwards JN, Dargan PI (2007). "Impact of restricting paracetamol pack sizes on paracetamol poisoning in the United Kingdom: a review of the literature". Bezpečnost léčiv. 30 (6): 465–79. doi:10.2165/00002018-200730060-00002. PMID 17536874.
- ^ Khashab M, Tector AJ, Kwo PY (March 2007). "Epidemiology of acute liver failure". Aktuální gastroenterologické zprávy. 9 (1): 66–73. doi:10.1007/s11894-008-0023-x. PMID 17335680.
- ^ Larson AM, Polson J, Fontana RJ, Davern TJ, Lalani E, Hynan LS, Reisch JS, Schiødt FV, Ostapowicz G, Shakil AO, Lee WM; Acute Liver Failure Study Group. (Prosinec 2005). "Acetaminophen-induced acute liver failure: results of a United States multicenter, prospective study". Hepatologie. 42 (6): 1364–72. doi:10.1002/hep.20948. PMID 16317692.CS1 maint: více jmen: seznam autorů (odkaz)
- ^ Lee WM (July 2004). "Acetaminophen and the U.S. Acute Liver Failure Study Group: lowering the risks of hepatic failure". Hepatologie. 40 (1): 6–9. doi:10.1002/hep.20293. PMID 15239078.[mrtvý odkaz ]
- ^ Bower WA, Johns M, Margolis HS, Williams IT, Bell BP (November 2007). "Population-based surveillance for acute liver failure". The American Journal of Gastroenterology. 102 (11): 2459–63. PMID 17608778.
externí odkazy
| Klasifikace | |
|---|---|
| Externí zdroje |
- Gerth, Jeff; T. Christian Miller (September 20, 2013). „Použít pouze podle pokynů“. ProPublica. Citováno 12. října 2013.
