Laktáza - Lactase
| Laktáza | |||||||||
|---|---|---|---|---|---|---|---|---|---|
 Laktamový tetramer, E-coli | |||||||||
| Identifikátory | |||||||||
| EC číslo | 3.2.1.108 | ||||||||
| Číslo CAS | 9031-11-2 | ||||||||
| Databáze | |||||||||
| IntEnz | IntEnz pohled | ||||||||
| BRENDA | Vstup BRENDA | ||||||||
| EXPASY | Pohled NiceZyme | ||||||||
| KEGG | Vstup KEGG | ||||||||
| MetaCyc | metabolická cesta | ||||||||
| PRIAM | profil | ||||||||
| PDB struktur | RCSB PDB PDBe PDBsum | ||||||||
| Genová ontologie | AmiGO / QuickGO | ||||||||
| |||||||||
| Glykosylceramidáza (Florizin hydroláza) | |||||||||
|---|---|---|---|---|---|---|---|---|---|
| Identifikátory | |||||||||
| EC číslo | 3.2.1.62 | ||||||||
| Číslo CAS | 9033-10-7 | ||||||||
| Databáze | |||||||||
| IntEnz | IntEnz pohled | ||||||||
| BRENDA | Vstup BRENDA | ||||||||
| EXPASY | Pohled NiceZyme | ||||||||
| KEGG | Vstup KEGG | ||||||||
| MetaCyc | metabolická cesta | ||||||||
| PRIAM | profil | ||||||||
| PDB struktur | RCSB PDB PDBe PDBsum | ||||||||
| Genová ontologie | AmiGO / QuickGO | ||||||||
| |||||||||
| Laktáza | |||||||
|---|---|---|---|---|---|---|---|
| Identifikátory | |||||||
| Symbol | LCT | ||||||
| Alt. symboly | LAC; LPH; LPH1 | ||||||
| Gen NCBI | 3938 | ||||||
| HGNC | 6530 | ||||||
| OMIM | 603202 | ||||||
| RefSeq | NM_002299 | ||||||
| UniProt | P09848 | ||||||
| Další údaje | |||||||
| EC číslo | 3.2.1.108 | ||||||
| Místo | Chr. 2 q21 | ||||||
| |||||||
Laktáza je enzym produkovaný mnoha organismy. Nachází se v okraj kartáče z tenké střevo lidí a jiných savců. Laktáza je nezbytná pro úplné trávení celku mléko; rozpadá se laktóza, a cukr což dává mléku jeho sladkost. Nedostatek laktázy může mít osoba konzumující mléčné výrobky příznaky laktózová intolerance.[1] Laktázu lze zakoupit jako doplněk stravy a přidává se do mléka k výrobě mléčných výrobků bez laktózy.
Laktáza (také známá jako laktáza-florizinová hydrolázanebo LPH), součást β-galaktosidáza rodina enzymy, je glykosid hydroláza podílí se na hydrolýza z disacharid laktózu do složky galaktóza a glukóza monomery. Laktáza je přítomna převážně podél okraj kartáče membrána diferencovaných enterocyty obložení klky z tenké střevo.[2] U lidí je laktáza kódována LCT gen.[3][4]
Použití
Použití potravin
Laktáza je enzym, který někteří lidé nejsou schopni produkovat v tenkém střevě.[5] Bez ní nemohou rozložit přirozenou laktózu v mléce a zanechat při pití běžného mléka průjem, plyn a nadýmání. Technologie na výrobu mléka, zmrzliny a jogurtu bez laktózy byla vyvinuta USDA Služba pro zemědělský výzkum v roce 1985.[6] Tato technologie se používá k přidání laktázy do mléka, čímž hydrolyzuje laktózu přirozeně se vyskytující v mléce a zanechává ji mírně sladkou, ale stravitelnou pro všechny.[7] Bez laktázy předávají lidé nesnášející laktózu laktózu nestrávenou do tlustého střeva[8] kde ho bakterie rozkládají a vytvářejí oxid uhličitý, což vede k nadýmání a nadýmání.
Lékařské použití
Laktázové doplňky se někdy používají k léčbě intolerance laktózy.[9]
Průmyslové použití
Laktázu vyráběnou komerčně lze extrahovat jak z droždí jako Kluyveromyces fragilis a Kluyveromyces lactis a z forem, jako je Aspergillus niger a Aspergillus oryzae.[10] Jeho hlavním komerčním využitím v doplňcích, jako jsou Lacteeze a Lactaid, je štěpení laktózy v mléce, aby byla vhodná pro lidi s intolerancí laktózy,[11][12] Nicméně US Food and Drug Administration formálně nehodnotila účinnost těchto produktů.[13]
Laktáza se také používá k screeningu Modrá bílá kolonie v více klonovacích stránek různých plazmidové vektory v Escherichia coli nebo jiné bakterie.[14]
Mechanismus
Optimální teplota pro lidskou laktázu je asi 37 ° C[15] a optimum pH je 6.[2]
v metabolismus, β-glykosidová vazba v D-laktóza se hydrolyzuje za vzniku D-galaktóza a D-glukóza, která může být absorbována střevními stěnami a do krevního řečiště. Celková reakce, kterou laktáza katalyzuje, je C.12H22Ó11 + H2O → C.6H12Ó6 + C.6H12Ó6 + teplo.
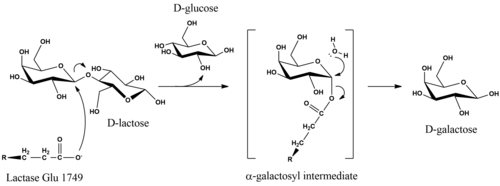
Katalytický mechanismus Dhydrolýza laktózy zachovává v produktech anomerní konfiguraci substrátu.[16] I když jsou podrobnosti mechanismu nejisté, stereochemické retence se dosáhne při reakci s dvojitým posunem. Studie z E-coli laktázy navrhly, že hydrolýza je zahájena, když glutamátový nukleofil na enzymu napadne z axiální strany galaktosyl uhlíku v p-glykosidové vazbě.[17] Odstranění D-glukóza odstupující skupina může být usnadněna kyselou katalýzou závislou na Mg.[17] Enzym se uvolňuje z α-galaktosylové části po rovníkovém nukleofilním útoku vodou, která produkuje D-galaktóza.[16]
Studie modifikace substrátu prokázaly, že 3'-OH a 2'-OH skupiny na galaktopyranózovém kruhu jsou nezbytné pro enzymatické rozpoznávání a hydrolýzu.[18] 3'-hydroxyskupina se účastní počáteční vazby na substrát, zatímco 2'-skupina není nezbytná pro rozpoznání, ale je nutná v následujících krocích. To dokazuje skutečnost, že 2-deoxy analog je účinným kompetitivním inhibitorem (K.i = 10 mM).[18] Eliminace specifických hydroxylových skupin na glukopyranosové části zcela nevylučuje katalýzu.[18]
Laktáza také katalyzuje přeměnu phlorizin na phloretin a glukóza.
Struktura a biosyntéza
Preprolaktáza, primární produkt translace, má primární primární strukturu jednoho polypeptidu sestávající z 1927 aminokyselin.[3] Lze jej rozdělit do pěti domén: (i) rozštěpená 19-aminokyselina sekvence signálu; (ii) velká prosekční doména, která není přítomna ve zralé laktáze; (iii) segment zralé laktázy; (iv) membránově překlenující hydrofobní kotva; a (v) krátký hydrofilní karboxylový konec.[3] Signální sekvence je štěpena v endoplazmatické retikulum a výsledný 215 kDa pro-LPH je odeslán do Golgiho aparát, kde je silně glykosylován a proteolyticky zpracován do své zralé formy.[19] Ukázalo se, že prodoména působí jako intramolekulární chaperon v ER, brání štěpení trypsinem a umožňuje LPH přijmout nezbytnou 3-D strukturu, která má být transportována do Golgiho aparátu.[20]

Zralá lidská laktáza se skládá z jediného 160-kDa polypeptidového řetězce, který se lokalizuje na membráně okraje štětce epiteliálních buněk střeva. Je orientován na N-konec vně buňky a C-konec v cytosolu.[3] LPH obsahuje dvě katalytická místa s kyselinou glutamovou. V lidském enzymu byla aktivita laktázy spojena s Glu-1749, zatímco Glu-1273 je místem funkce florizinhydrolázy.[21]
Genetické vyjádření a regulace
Laktáza je kódována jediným genetickým lokusem na chromozomu 2.[22] Je exprimován výlučně enterocyty tenkého střeva savců a ve velmi nízkých hladinách v tlustém střevě během vývoje plodu.[22] Lidé se rodí s vysokou úrovní exprese laktázy. U většiny světové populace je transkripce laktázy po odstavení snížena, což vede ke snížené expresi laktázy v tenkém střevě,[22] který způsobuje běžné příznaky hypolaktázie dospělého typu nebo nesnášenlivosti laktózy.[23]
Některé segmenty populace vykazují perzistenci laktázy jako důsledek mutace, u níž se předpokládá, že k ní došlo před 5 000–10 000 lety, což se shoduje se vzestupem domestikace skotu.[24] Tato mutace umožnila téměř polovině světové populace metabolizovat laktózu bez příznaků. Studie spojily výskyt persistence laktázy se dvěma různými jedno-nukleotidovými polymorfismy přibližně 14 a 22 kilobáz proti směru od 5'-konce genu LPH.[25] Obě mutace, C → T v poloze -13910 a G → A v poloze -22018, byly nezávisle spojeny s perzistencí laktázy.[26]
Laktázový promotor je dlouhý 150 párů bází a nachází se těsně před místem iniciace transkripce.[26] Sekvence je u savců vysoce konzervativní, což naznačuje, že se poblíž nacházejí kritické regulátory cis-transkripce.[26] Cdx-2, HNF-la, a GATA byly identifikovány jako transkripční faktory.[26] Studie nástupu hypolaktázie prokázaly, že navzdory polymorfismům existuje malý rozdíl v expresi laktázy u kojenců, což ukazuje, že mutace se během vývoje stávají stále relevantnějšími.[27] Vývojově regulované proteiny vázající DNA mohou down-regulovat transkripci nebo destabilizovat transkripty mRNA, což způsobí sníženou expresi LPH po odstavení.[27]
Viz také
Reference
- ^ Järvelä I, Torniainen S, Kolho KL (2009). "Molekulární genetika nedostatků lidské laktázy". Annals of Medicine. 41 (8): 568–75. doi:10.1080/07853890903121033. PMID 19639477. S2CID 205586720.
- ^ A b Skovbjerg H, Sjöström H, Norén O (březen 1981). „Čištění a charakterizace amfifilní laktázy / florizinové hydrolázy z lidského tenkého střeva“. European Journal of Biochemistry / FEBS. 114 (3): 653–61. doi:10.1111 / j.1432-1033.1981.tb05193.x. PMID 6786877.
- ^ A b C d Mantei N, Villa M, Enzler T, Wacker H, Boll W, James P, Hunziker W, Semenza G (září 1988). „Kompletní primární struktura lidské a králičí laktázy-florizinové hydrolázy: důsledky pro biosyntézu, zakotvení membrány a vývoj enzymu“. Časopis EMBO. 7 (9): 2705–13. doi:10.1002 / j.1460-2075.1988.tb03124.x. PMC 457059. PMID 2460343.
- ^ Harvey CB, Fox MF, Jeggo PA, Mantei N, Povey S, Swallow DM (červenec 1993). „Regionální lokalizace genu pro laktázu-florizinhydrolázu, LCT, na chromozom 2q21“. Annals of Human Genetics. 57 (Pt 3): 179–85. doi:10.1111 / j.1469-1809.1993.tb01593.x. PMID 8257087. S2CID 38604778.
- ^ "Laktózová intolerance". Klinika Mayo. Klinika Mayo. Citováno 13. března 2018.
- ^ Veranda, Kaitlyn (04.04.2018). „Mléko bez laktózy, nízkotučné sýry a další mléčné výrobky“. www.federallabs.org. Citováno 2018-10-26.
- ^ „Dotaz: Jak mlékárny vyrábějí mléko bez laktózy?“. USA dnes. 3. září 2014. Citováno 13. března 2018.
- ^ „Intolerance laktózy - příznaky a příčiny“. Klinika Mayo. Citováno 2020-11-08.
- ^ "Laktózová intolerance". NIDDK. Červen 2014. Citováno 25. října 2016.
- ^ Seyis I, Aksoz N (2004). "Produkce laktázy Trichoderma sp." (PDF). Food Technol Biotechnol. 42: 121–124.
- ^ „Re: Oznámení GRAS o kyselé laktáze z Aspergillus oryzae vyjádřené v Aspergillus niger“. United States Food and Drug Administration.
- ^ Holsinger VH (1992). "The Lactaid Story". Inovativní výrobky pro potravinářský průmysl. Sbírka publikací o rozvoji venkova. str. 256–8.
- ^ Tarantino, LM (2003-12-03). „Dopis agentury o reakci na oznámení GRAS č. GRN 000132“. US Food and Drug Administration. Archivovány od originál dne 26.03.2011. Citováno 2009-09-21.
- ^ "Úvod". Laktáza. Citováno 2018-11-16.
- ^ Hermida C, Corrales G, Cañada FJ, Aragón JJ, Fernández-Mayoralas A (červenec 2007). „Optimalizace enzymatické syntézy beta-D-galaktopyranosyl-D-xylosy pro jejich použití při hodnocení aktivity laktázy in vivo“. Bioorganická a léčivá chemie. 15 (14): 4836–40. doi:10.1016 / j.bmc.2007.04.067. hdl:10261/81580. PMID 17512743.
- ^ A b Sinnott M (listopad 1990). "Katalytické mechanismy přenosu enzymatického glykosylu". Chem. Rev. 90 (7): 1171–1202. doi:10.1021 / cr00105a006.
- ^ A b Juers DH, Heightman TD, Vasella A, McCarter JD, Mackenzie L, Withers SG, Matthews BW (prosinec 2001). „Strukturální pohled na působení beta-galaktosidázy z Escherichia coli (lacZ)“. Biochemie. 40 (49): 14781–94. doi:10.1021 / bi011727i. PMID 11732897.
- ^ A b C Fernandez P, Cañada FJ, Jiménez-Barbero J, Martín-Lomas M (červenec 1995). „Substrátová specificita laktázy v tenkém střevě: studium stérických účinků a vodíkových vazeb zapojených do interakce enzym-substrát“. Výzkum sacharidů. 271 (1): 31–42. doi:10.1016 / 0008-6215 (95) 00034-Q. PMID 7648581.
- ^ Naim HY, Sterchi EE, Lentze MJ (leden 1987). „Biosyntéza a zrání laktázy-florizinové hydrolázy v lidských epiteliálních buňkách tenkého střeva“. The Biochemical Journal. 241 (2): 427–34. doi:10.1042 / bj2410427. PMC 1147578. PMID 3109375.
- ^ Naim HY, Jacob R, Naim H, Sambrook JF, Gething MJ (říjen 1994). "Pro oblast lidské střevní laktázy-florizinové hydrolázy". The Journal of Biological Chemistry. 269 (43): 26933–43. PMID 7523415.
- ^ Zecca L, Mesonero JE, Stutz A, Poirée JC, Giudicelli J, Cursio R, Gloour SM, Semenza G (září 1998). „Intestinální laktáza-florizinová hydroláza (LPH): dvě katalytická místa; role slinivky břišní při dozrávání pro-LPH“. FEBS Dopisy. 435 (2–3): 225–8. doi:10.1016 / S0014-5793 (98) 01076-X. PMID 9762914. S2CID 33421778.
- ^ A b C Troelsen JT, Mitchelmore C, Spodsberg N, Jensen AM, Norén O, Sjöström H (březen 1997). „Regulace exprese genu laktázy-florizinové hydrolázy pomocí kaudálně příbuzného proteinu homoeodomény Cdx-2“. The Biochemical Journal. 322 (Pt 3) (Pt. 3): 833–8. doi:10.1042 / bj3220833. PMC 1218263. PMID 9148757.
- ^ Reference, Genetics Home. "Gen LCT". Genetická domácí reference. Citováno 3. dubna 2018.
- ^ Bersaglieri T, Sabeti PC, Patterson N, Vanderploeg T, Schaffner SF, Drake JA, Rhodes M, Reich DE, Hirschhorn JN (červen 2004). "Genetické podpisy nedávné silné pozitivní selekce na genu laktázy". American Journal of Human Genetics. 74 (6): 1111–20. doi:10.1086/421051. PMC 1182075. PMID 15114531.
- ^ Kuokkanen M, Enattah NS, Oksanen A, Savilahti E, Orpana A, Järvelä I (květen 2003). „Transkripční regulace genu laktázy-florizinové hydrolázy polymorfismy spojenými s hypolaktasií dospělého typu“. Střevo. 52 (5): 647–52. doi:10,1136 / gut. 52,5.647. PMC 1773659. PMID 12692047.
- ^ A b C d Troelsen JT (květen 2005). "Hypolaktasie dospělého typu a regulace exprese laktázy". Biochimica et Biophysica Acta (BBA) - Obecné předměty. 1723 (1–3): 19–32. doi:10.1016 / j.bbagen.2005.02.003. PMID 15777735.
- ^ A b Wang Y, Harvey CB, Hollox EJ, Phillips AD, Poulter M, Clay P, Walker-Smith JA, Swallow DM (červen 1998). „Geneticky naprogramovaná down-regulace laktázy u dětí“. Gastroenterologie. 114 (6): 1230–6. doi:10.1016 / S0016-5085 (98) 70429-9. PMID 9609760.
externí odkazy
- Laktázový protein
- E-coli β-galaktosidáza: PDB: 1JYY
- Genová ontologie pro laktázu
- Making of the Fittest: Got Lactase? Společný vývoj genů a kultury
- Perzistence laktázy ukazuje na souvislost s obezitou
- PDBe-KB poskytuje přehled všech strukturních informací dostupných v PDB pro lidskou beta-galaktosidázu
- PDBe-KB poskytuje přehled všech strukturních informací dostupných v PDB pro beta-galaktosidázu Escherichia coli
