Kanamycin kináza - Kanamycin kinase
| kanamycin kináza | |||||||||
|---|---|---|---|---|---|---|---|---|---|
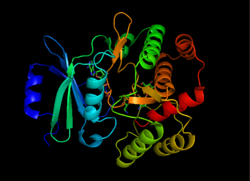 Struktura APH (3 '), převzato z 1L8T[1] | |||||||||
| Identifikátory | |||||||||
| EC číslo | 2.7.1.95 | ||||||||
| Číslo CAS | 62213-36-9 | ||||||||
| Databáze | |||||||||
| IntEnz | IntEnz pohled | ||||||||
| BRENDA | Vstup BRENDA | ||||||||
| EXPASY | Pohled NiceZyme | ||||||||
| KEGG | Vstup KEGG | ||||||||
| MetaCyc | metabolická cesta | ||||||||
| PRIAM | profil | ||||||||
| PDB struktur | RCSB PDB PDBe PDBsum | ||||||||
| Genová ontologie | AmiGO / QuickGO | ||||||||
| |||||||||
Aminoglykosid-3'-fosfotransferáza (APH (3 ')), také známý jako aminoglykosid kináza, je enzym že primárně katalyzuje přidání fosfát z ATP do 3'-hydroxylová skupina 4,6-disubstituovaného aminoglykosid, jako kanamycin.[2] Bylo však také zjištěno, že APH (3 ') fosforyluje na 5'-hydroxylové skupině ve 4,5-disubstituovaných aminoglykosidech, které postrádají 3'-hydroxylovou skupinu, a difosforyluje hydroxylové skupiny v aminoglykosidech, které mají jak 3'- a 5'-hydroxylové skupiny.[2][3] Aminoglykosidy, které jsou za biologických podmínek primárně kladně nabité, se vážou na záporně nabitou páteř nukleové kyseliny narušit proteosyntéza, účinně inhibující růst bakteriálních buněk.[4] Fosforylace aminoglykosidů zprostředkovaná APH (3 ') účinně narušuje jejich mechanismus účinku a zavádí fosfátovou skupinu, která snižuje jejich vazebná afinita kvůli sterické překážky a nepříznivé elektrostatické interakce.[5] APH (3 ') se primárně vyskytuje u určitých druhů grampozitivní bakterie.[6][7][8]

Tento enzym patří do rodiny transferázy, konkrétně ty, které přenášejí skupiny obsahující fosfor (fosfotransferázy ) s alkoholovou skupinou jako akceptorem. The systematické jméno této třídy enzymů je ATP: kanamycin 3'-O-fosfotransferáza. Tento enzym se také nazývá neomycin-kanamycin fosfotransferáza.[9]
Struktura
APH (3 ’) termodynamicky upřednostňuje a dimer forma dvou identických monomerů APH (3 ’), které jsou spojeny dvěma disulfidové vazby mezi Cys19 a Cys156, s aktivní stránky proti sobě.[2][10] Velká vzdálenost mezi aktivními místy obou monomerů však naznačuje, že jsou na sobě navzájem nezávislé a nepůsobí kooperativně. Dimerizace APH (3 ') navíc neovlivňuje aktivitu enzymu.[2][10][11]

Každý monomer se skládá ze dvou laloků, beta-list bohatý N-konec a alfa-šroubovice bohatý C-konec, s dvanáctkou aminokyselina oblast spojující dva. N-terminální lalok se skládá z 5 antiparalelní ß-listy, s a-šroubovicí mezi listy 3 a 4. C-koncový lalok je rozdělen na centrální oblast jádra (dvě α-šroubovice a vlásenka následovaný čtyřmi ß-listy), inzertní oblast (dvě α-šroubovice spojené smyčkovou strukturou) a C-koncová oblast (dvě α-helice).[11] Výsledná kapsa, která je zapouzdřena dvěma laloky, tvoří aktivní místo enzymu.[2] Tato kapsa je z velké části složena ze záporně nabitých aminokyselinových zbytků, které stabilizují pozitivní náboj a orientují substrát v aktivním místě. Dále se předpokládá, že tato kapsa přispívá k promiskuitě enzymu, což mu umožňuje přijímat a stabilizovat několik různých druhů aminoglykosidů.[6]
Mechanismus

Zatímco dřívější studie APH (3 ') podporovaly mechanismus zahrnující nukleofilní útok y-fosfátu 3'-hydroxylem, novější studie naznačují, že APH (3') katalyzuje přenos γ-fosfátu z ATP na aminoglykosid přes a disociativní mechanismus kde deprotonace substrátu není rozhodující pro přenos fosfátů, ale stabilizace a metafosfát přechodový stav.[8][12]APH (3 ') má navíc nukleotidovou polohovací smyčku (NPL), která se po navázání ATP uzavírá na aktivní místo enzymu, což usnadňuje fosforylaci 3'-hydroxylové skupiny. Klíčem ke správnému umístění fosfátové skupiny jsou zbytky Ser27 a Met26. Zpočátku dva hořčík ionty stabilizované Asn195 a Asp208 usnadňují vazbu ATP v aktivním místě a orientují ß- a y-fosfátové skupiny. NPL poté prochází konformační změnou za vzniku vodíkové vazby mezi Ser27 a ß-fosfátovou skupinou. Po navázání substrátu prochází APH (3 ') další konformační změnou pro orientaci Ser27 tak, že jeho amidový páteř narušuje seřazení ß-fosfátu a γ-fosfátu, čímž oslabuje γ-fosfátovou vazbu. Amidový páteř Met26 tvoří vodíkovou vazbu s metafosforečnanem ke stabilizaci přechodného stavu, protože iont hořčíku (označovaný jako Mg1) pak prodlužuje y-fosfátovou vazbu, rozbíjí ji a účinně fosforyluje hydroxylovou skupinu.[8]

Evoluce a biologická funkce
Oblast centrálního jádra APH (3 ’) má vysoký stupeň konformační podobnost s oblastmi serinu / tyrosinu a threoninu proteinové kinázy, funkčně ekvivalentní enzymy nalezené v eukaryotech. Dodatečně, Rentgenová krystalografie a mutageneze klíčových zbytků aktivního místa podporuje tvrzení, že APH (3 ') a eukaryotické proteinové kinázy jsou příbuzné, přestože sdílí méně než 10% celkového obsahu reziduí.[2][8][11] Několik studií naznačuje, že serinové / tyrosinové / threoninové proteinové kinázy, o nichž se předpokládá, že se vyskytují pouze u eukaryot, se také nacházejí v prokaryotech.[13][14]Dále bylo zjištěno, že biosyntéza aminoglykosidů vyžaduje během určitých kroků syntézy fosforylaci hydroxylových skupin. Předpokládá se tedy, že APH (3 ') a další proteinové kinázy pocházejí z enzymů z metabolické dráhy pro aminoglykosidy a byly vyvinuty za účelem potlačení toxických účinků těchto antibiotik na bakteriální buňku hostitele.[11][15]
Použití ve výzkumu
Geny rezistence na aminoglykosidy se běžně používají v oblasti genetické inženýrství za účelem výběru správně transformovaných bakteriálních organismů. Při konstrukci a vektorový plazmid, počítaje v to odolnost proti antibiotikům ve vektoru je zásadní pro efektivní expresi požadovaného genu. Antibiotika, jako jsou aminoglykosidy kanamycin nebo neomycin, se přidávají do kultur během růstových fází, aby se selektivně zničily buňky, které účinně nepřijímají plazmid.
Reference
- ^ Fong, DH, Berghuis, AM (2002). "Krystalová struktura komplexu 3 ', 5" -aminoglykosid fosfotransferázy typu IIIa ADP pro kanamycin A ". doi:10,2210 / pdb1l8t / pdb. Citovat deník vyžaduje
| deník =(Pomoc)CS1 maint: více jmen: seznam autorů (odkaz) - ^ A b C d E F G Wright, GD, Thompson, PR (1999). „Aminoglykosid fosfotransferázy: proteiny, struktura a mechanismus“. Přední Biosci. 4 (1–3): D9–21. doi:10,2741 / wright. PMID 9872733.CS1 maint: více jmen: seznam autorů (odkaz)
- ^ Thompson, PR, Hughes, DW, Wright, GD (1996). "Regiospecificita aminoglykosid fosfotransferázy z enterokoků a stafylokoků (APH (3 ') - IIIa)". Biochemie. 35 (26): 8686–95. doi:10.1021 / bi960389w. PMID 8679631.CS1 maint: více jmen: seznam autorů (odkaz)
- ^ Cavallo, G, Martinetto, P (1981). "Mechanismus účinku aminoglykosidů". G Batteriol Virol Immunol. 74 (7–12): 335–46. PMID 6182050.CS1 maint: více jmen: seznam autorů (odkaz)
- ^ Kotra, LP, Haddad J, Mobashery, S (2000). „Aminoglykosidy: Pohledy na mechanismy působení a rezistence a strategie boje proti rezistenci“. Antimikrobiální látky a chemoterapie. 44 (12): 3249–56. doi:10.1128 / aac.44.12.3249-3256.2000. PMC 90188. PMID 11083623.CS1 maint: používá parametr autoři (odkaz)
- ^ A b Fong, DH, Berghuis, AM (2002). „Substrátová promiskuita aminoglykosidového enzymu rezistence na antibiotika prostřednictvím cílové mimikry“. Časopis EMBO. 21 (10): 2323–31. doi:10.1093 / emboj / 21.10.2323. PMC 126009. PMID 12006485.CS1 maint: používá parametr autoři (odkaz)
- ^ Gray, GS, Fitch WM (1983). „Vývoj genů rezistence na antibiotika: sekvence DNA genu rezistence na kanamycin ze Staphylococcus aureus“. Mol Biol Evol. 1 (1): 57–66. doi:10.1093 / oxfordjournals.molbev.a040298. PMID 6100986.CS1 maint: používá parametr autoři (odkaz)
- ^ A b C d E Thompson, PR, Boehr, DD, Berghuis, AM, Wright, GD (2002). „Mechanism of Aminoglycosside Antibiotic Kinase APH (3 ') - IIIa: Role of the Nucleotide Positioning Loop“. Biochemie. 41 (22): 7001–7. doi:10.1021 / bi0256680. PMID 12033933.CS1 maint: používá parametr autoři (odkaz)
- ^ McKay GA, Wright GD (1996). „Katalytický mechanismus enterokokové kanamycin kinázy (APH (3 ') - IIIa): účinky viskozity, thio a izotopů rozpouštědla podporují mechanismus Theorell-Chance“. Biochemie. 35 (26): 8680–5. doi:10.1021 / bi9603884. PMID 8679630.
- ^ A b McKay, GA, Thompson, PR, Wright, GD (1994). "Širokospektrální aminoglykosid fosfotransferáza typu III od Enterococcus: nadměrná exprese, čištění a substrátová specificita". Biochemie. 33 (22): 6936–44. doi:10.1021 / bi00188a024. PMID 8204627.CS1 maint: používá parametr autoři (odkaz)
- ^ A b C d Hon, WC, McKay, GA, Thompson, PR, Sweet, RM, Yang, DSC, Wright, GD, Berhuis, AM (1997). „Struktura enzymu požadovaného pro rezistenci na antibiotika vůči aminoglykosidům odhaluje homologii s eukaryotickými proteinovými kinázami“. Buňka. 89 (6): 887–95. doi:10.1016 / s0092-8674 (00) 80274-3. PMID 9200607. S2CID 13251696.CS1 maint: používá parametr autoři (odkaz)
- ^ Boehr, DD, Thompson, PR, Wright, GD (2001). „Molekulární mechanismus aminoglykosidové antibiotické kinázy APH (3 ') - IIIa: role konzervovaných zbytků aktivního místa“. J Biol Chem. 276 (26): 23929–36. doi:10,1074 / jbc.m100540200. PMID 11279088.CS1 maint: používá parametr autoři (odkaz)
- ^ Kennelly, PJ (1996). „Rádi vás tu potkáme! Nový pohled na„ prokaryotickou “fosforylaci bílkovin“. J Bacteriol. 178 (16): 4759–64. doi:10.1128 / jb.178.16.4759-4764.1996. PMC 178254. PMID 8759835.CS1 maint: používá parametr autoři (odkaz)
- ^ Zhang, CC (1996). "Bakteriální signalizace zahrnující proteinové kinázy eukaryotického typu". Mol Microbiol. 20 (1): 9–15. doi:10.1111 / j.1365-2958.1996.tb02483.x. PMID 8861199. S2CID 33493179.CS1 maint: používá parametr autoři (odkaz)
- ^ Pierpersberg, W, Distler, J, Heinzel, P, Perez-Gonzalaez, JA (1988). „Antibiotická rezistence modifikací: Mnoho genů rezistence lze odvodit z buněčných kontrolních genů v aktinomycetech - hypotéza“. Actinomycetologica. 2 (2): 83–98. doi:10.3209 / saj.2_83.CS1 maint: používá parametr autoři (odkaz)
Další čtení
- Doi O, Ogura M, Tanaka N, Umezawa H (září 1968). „Inaktivace kanamycinu, neomycinu a streptomycinu enzymy získanými v buňkách Pseudomonas aeruginoa“. Aplikovaná mikrobiologie. 16 (9): 1276–81. doi:10.1128 / AEM.16.9.1276-1281.1968. PMC 547640. PMID 4970990.
- Dolin MI (březen 1957). „Oxidázy Streptococcus faecalis pro redukovaný difosfopyridinový nukleotid. III. Izolace a vlastnosti flavinperoxidázy pro redukovaný difosfopyridinový nukleotid“. The Journal of Biological Chemistry. 225 (1): 557–73. PMID 13416259.
