Vývoj nervového systému - Development of the nervous system
| Tento článek je součástí série o |
| Vývoj orgánové systémy |
|---|
| Nervový systém |
| Zažívací ústrojí |
| Rozmnožovací systém |
| Močový systém |
| Endokrinní systém |
| Lidský rozvoj |
| Oběhový systém |
The vývoj nervového systémunebo neurální vývojnebo neurovývoj, odkazuje na procesy, které generují, formují a přetvářejí nervový systém zvířat od nejranějších stadií embryonální vývoj do dospělosti. Pole neurálního vývoje čerpá z obou neurovědy a vývojová biologie popsat a poskytnout vhled do buněčných a molekulárních mechanismů, z nichž se vyvíjí složité nervové systémy hlístice a ovocné mušky na savci.
Poruchy nervového vývoje mohou vést k malformacím, jako jsou holoprosencephaly a širokou škálu neurologické poruchy počítaje v to končetinová paréza a ochrnutí poruchy rovnováhy a zraku a záchvaty,[1] a v lidé další poruchy jako např Rettův syndrom, Downův syndrom a mentální postižení.[2]
Přehled vývoje mozku obratlovců

The obratlovců centrální nervový systém (CNS) je odvozen z ektoderm —Vzdálenější zárodečná vrstva embrya. Část hřbetní ektodermy se stává specifikovanou pro nervovou ektodermu - neuroectoderm který tvoří neurální deska podél hřbetní strany embrya.[3] Jedná se o součást časného vzorkování embrya (včetně embrya bezobratlých), které také vytváří osu předozadní.[4] Nervová ploténka je zdrojem většiny neuronů a gliových buněk CNS. The nervová drážka se formuje podél dlouhé osy nervové ploténky a neurální ploténka se ohýbá, aby vznikla neurální trubice.[5] Když je tuba na obou koncích uzavřena, je naplněna embryonální mozkomíšním mokem.[6] Jak se embryo vyvíjí, přední část neurální trubice se rozpíná a tvoří tři primární mozkové vezikuly, které se stávají přední mozek (prosencephalon ), střední mozek (mesencephalon ), a zadní mozek (kosočtverec ). Tyto jednoduché, časné vezikuly se zvětšují a dále dělí na telencephalon (budoucnost mozková kůra a bazální ganglia ), diencephalon (budoucnost thalamus a hypotalamus ), mesencephalon (budoucnost colliculi ), metencephalon (budoucnost pons a mozeček ), a myelencephalon (budoucnost dřeň ).[7] Centrální komora naplněná mozkomíšním mísem je spojitá od telencephalonu po centrální kanál z mícha, a představuje vývoj komorový systém CNS. Embryonální mozkomíšní mok se liší od formy vytvořené v pozdějších vývojových stádiích a od mozkomíšního moku dospělých; ovlivňuje chování neurálních prekurzorů.[6] Protože neurální trubice vede k mozku a míchě, jakékoli mutace v této fázi vývoje mohou vést k fatálním deformacím, jako je anencefálie nebo celoživotní postižení jako spina bifida. Během této doby obsahují stěny neurální trubice nervové kmenové buňky, které podporují růst mozku, protože se mnohokrát dělí. Postupně se některé buňky přestanou dělit a diferencovat na neurony a gliové buňky, což jsou hlavní buněčné složky CNS. Nově generované neurony migrovat do různých částí vyvíjejícího se mozku, aby se samoorganizovaly do různých mozkových struktur. Jakmile neurony dosáhnou svých regionálních pozic, rozšiřují se axony a dendrity, které jim umožňují komunikovat s jinými neurony prostřednictvím synapse. Synaptická komunikace mezi neurony vede k zavedení funkčních neurální obvody které zprostředkovávají senzorické a motorické zpracování a jsou základem chování.[8]

Aspekty
Některé mezníky neurálního vývoje zahrnují narození a diferenciace z neurony z kmenová buňka prekurzory, migrace nezralých neuronů z jejich rodných míst v embryu do jejich konečných poloh, následek axony a dendrity z neuronů, vedení pohyblivosti růstový kužel skrz embryo směrem k postsynaptickým partnerům, generaci synapse mezi těmito axony a jejich postsynaptickými partnery a nakonec celoživotní Změny v synapsích, o nichž se předpokládá, že jsou základem učení a paměti.
Tyto procesy neurodevelopmentu lze obvykle rozdělit do dvou tříd: mechanismy nezávislé na činnosti a mechanismy závislé na činnosti. Obecně se předpokládá, že mechanismy nezávislé na aktivitě se vyskytují jako drátové procesy určené genetickými programy odehrávajícími se v jednotlivých neuronech. Tyto zahrnují diferenciace, migrace a axonové vedení do jejich původních cílových oblastí. Tyto procesy jsou považovány za nezávislé na nervové aktivitě a smyslové zkušenosti. Jednou axony dosáhnout svých cílových oblastí, vstupují do hry mechanismy závislé na činnosti. Ačkoli tvorba synapsí je událost nezávislá na aktivitě, modifikace synapsí a eliminace synapsí vyžaduje nervovou aktivitu.
Vývojová neurověda používá řadu zvířecí modely včetně myši Mus musculus, ovocná muška Drosophila melanogaster zebrafish Danio rerio, žába Xenopus laevis a škrkavka Caenorhabditis elegans.
Myelinizace, tvorba lipidového myelinového obalu kolem neuronových axonů, je proces, který je nezbytný pro normální funkci mozku. Myelinový obal poskytuje izolaci nervového impulsu při komunikaci mezi neurálními systémy. Bez ní by byl impuls narušen a signál by nedosáhl svého cíle, což by narušilo normální fungování. Protože tolik vývoje mozku nastává v prenatálním stadiu a v kojeneckém věku, je zásadní, aby myelinizace spolu s kortikálním vývojem probíhaly správně. Magnetická rezonance (MRI) je neinvazivní technika používaná k vyšetřování myelinizace a kortikální maturace (kůra je vnější vrstva mozku složená z šedá hmota ). Spíše než ukazovat skutečný myelin, MRI zachycuje podíl vody myelinu, což je míra obsahu myelinu. Vícesložková relaxometrie (MCR) umožňuje vizualizaci a kvantifikaci obsahu myelinu. MCR je také užitečné pro sledování zrání bílé hmoty, které hraje důležitou roli v kognitivním vývoji. Bylo zjištěno, že v kojeneckém věku dochází k myelinaci ve vzoru od zadního k přednímu. Protože existuje jen málo důkazů o vztahu mezi myelinací a kortikální tloušťkou, ukázalo se, že kortikální tloušťka je nezávislá na bílé hmotě. To umožňuje současně růst různých aspektů mozku, což vede k plně rozvinutému mozku.[9]
Neurální indukce
Během brzy embryonální vývoj u obratlovců je specifikován hřbetní ektoderm, který vede k pokožka a nervový systém; část hřbetní ektodermy bude upřesněna nervový ektoderm tvořit neurální deska což vede k nervové soustavě.[3][10] Konverze nediferencovaného ektodermu na neuroektoderm vyžaduje signály z mezoderm. Na počátku gastrulace se předpokládané mezodermální buňky pohybují dorzálním blastoporovým retem a tvoří vrstvu mezodermu mezi endoderm a ektoderm. Mesodermální buňky migrují podél hřbetní středové linie a vedou k notochord který se vyvine do páteř. Neuroectoderm překrývající notochord se vyvíjí do nervové desky v reakci na difuzní signál produkovaný notochordem. Zbytek ektodermy vede k epidermis. Schopnost mezodermu přeměnit nadložní ektoderm na nervovou tkáň se nazývá neurální indukce.
V časném embryu se nervová deska ohýbá směrem ven a tvoří nervová drážka. Počínaje budoucí oblastí krku, nervové záhyby této drážky blízko k vytvoření neurální trubice. Vznik neurální trubice z ektodermu se nazývá neurulace. Ventrální část neurální trubice se nazývá bazální dlaha; hřbetní část se nazývá výstražná deska. Dutý interiér se nazývá nervový kanál a otevřené konce neurální trubice, nazývané neuropóry, se uzavírají.[11]
Transplantovaný blastoporový ret může přeměnit ektoderm na nervovou tkáň a říká se, že má indukční účinek. Neurální induktory jsou molekuly, které mohou indukovat expresi nervových genů v ektodermu vysvětlivky bez vyvolání mezodermálních genů. Neurální indukce je často studována v Xenopus embrya, protože mají jednoduché tělesný plán a existují dobré markery pro rozlišení mezi nervovou a neurální tkání. Příklady neurálních induktorů jsou molekuly člun ze dřeva a chordin.
Když jsou embryonální ektodermální buňky kultivovány při nízké hustotě v nepřítomnosti mezodermálních buněk, podléhají neurální diferenciaci (exprimují neurální geny), což naznačuje, že neurální diferenciace je výchozím osudem ektodermálních buněk. v explantátové kultury (které umožňují přímé interakce mezi buňkami) se stejné buňky diferencují na epidermis. To je způsobeno akcí BMP4 (A TGF-p rodinný protein), který indukuje ektodermální kultury k diferenciaci na epidermis. Během neurální indukce jsou dorzální mezoderm (notochord) produkovány noggin a chordin a difundují do nadložního ektodermu, aby inhibovaly aktivitu BMP4. Tato inhibice BMP4 způsobuje, že se buňky diferencují na nervové buňky. Inhibice signalizace TGF-β a BMP (kostní morfogenetický protein) může účinně indukovat nervovou tkáň z pluripotentní kmenové buňky.[12]
Regionalizace
V pozdější fázi vývoje se nadřazená část neurální trubice ohýbá na úrovni budoucího středního mozku - mesencephalon, v mezencefalickém ohybu nebo mozková flexe. Nad mesencephalon je prosencephalon (budoucí přední mozek) a pod ním je kosočtverec (budoucí zadní mozek).
Výstražná deska prosencephalonu se rozšiřuje a tvoří telencephalon což vede k mozkové hemisféry, zatímco jeho bazální deska se stává diencephalon. The optický váček (které se nakonec stávají optickým nervem, sítnicí a duhovkou) se tvoří na bazální desce prosencephalonu.
Vzorec nervového systému
v strunatci dorzální ektoderm tvoří veškerou nervovou tkáň a nervový systém. Vzorování dochází v důsledku specifických podmínek prostředí - různé koncentrace signálních molekul
Dorsoventrální osa
Ventrální polovina neurální deska je řízen notochord, který funguje jako „organizátor“. Hřbetní polovina je řízena ektoderm deska, která boky po obou stranách neurální desky.[13]
Ectoderm sleduje výchozí cestu k tomu, aby se stal neurální tkání. Důkazy o tom pocházejí z jednotlivých kultivovaných buněk ektodermu, které dále vytvářejí nervovou tkáň. To se předpokládá kvůli nedostatku BMP, které jsou blokovány organizátorem. Organizátor může produkovat molekuly jako např follistatin, člun ze dřeva a chordin které inhibují BMP.
Ventrální neurální trubice je vzorována zvukový ježek (Pst) z notochordu, který působí jako indukující tkáň. Z Notochordu odvozené Psst signály do podlahovou desku, a indukuje Psst výraz v podlahové desce. Shh odvozený od podlahové desky následně signalizuje dalším buňkám v neurální trubici a je nezbytný pro správnou specifikaci progenitorových domén ventrálních neuronů. Ztráta Shh z notochordu a / nebo podlahové desky brání správné specifikaci těchto domén předků. Psst váže Oprava, zmírnění Patched-zprostředkované inhibice Uhlazen, což vede k aktivaci rodiny Gli z transkripční faktory (GLI1, GLI2, a GLI3 ).
V této souvislosti Shh působí jako a morfogen - indukuje diferenciaci buněk v závislosti na jeho koncentraci. Při nízkých koncentracích tvoří ventrální interneurony, při vyšších koncentracích indukuje motorický neuron vývoj a při nejvyšších koncentracích vyvolává diferenciaci podlahové desky. Selhání příčin diferenciace modulované Shh holoprosencephaly.
Hřbetní neurální trubice je vzorována BMP z epidermálního ektodermu lemujícího neurální desku. Ty aktivací vyvolávají senzorické interneurony Sr / Thr kinázy a pozměňovat SMAD úrovně transkripčních faktorů.
Rostrocaudální (předozadní) osa
Mezi signály, které řídí předozadní nervový vývoj, patří FGF a kyselina retinová, které působí na zadní mozek a míchu.[14] Například zadní mozek má vzor Hox geny, které jsou exprimovány v překrývajících se doménách podél anteroposteriorní osy pod kontrolou kyseliny retinové. The 3′ Geny (3 hlavní konec) v klastru Hox jsou indukovány kyselinou retinovou v zadním mozku, zatímco 5′ (5 prime end) Hox geny nejsou indukovány kyselinou retinovou a jsou exprimovány posteriorněji v míše. Hoxb-1 je vyjádřen v kosočtverci 4 a vede k lícní nerv. Bez tohoto výrazu Hoxb-1 by byl nerv podobný trigeminální nerv vzniká.
Neurogeneze
Neurogeneze je proces, při kterém jsou generovány neurony nervové kmenové buňky a progenitorové buňky. Neurony jsou „postmitotické“, což znamená, že se už nikdy nerozdělí po celý život organismu.[8]
Epigenetické modifikace hrají klíčovou roli při regulaci genová exprese v rozlišování nervové kmenové buňky a jsou rozhodující pro stanovení osudu buněk v mozku vyvíjejícího se a dospělého savce. Mezi epigenetické modifikace patří Methylace DNA cytosinu tvořit 5-methylcytosin a Demetylace 5-methylcytosinu.[15][16] Methylace DNA cytosinu je katalyzován DNA methyltransferázy (DNMT). Demetylace methylcytosinu je katalyzována v několika po sobě jdoucích krocích pomocí Enzymy TET které provádějí oxidační reakce (např. 5-methylcytosin na 5-hydroxymethylcytosin ) a enzymy DNA oprava základní excize (BER) cesta.[15]
Neuronální migrace
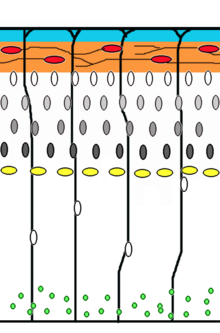
Neuronální migrace je metoda, kterou neurony cestují ze svého původu nebo rodiště do své konečné polohy v mozku. Existuje několik způsobů, jak toho dosáhnout, např. radiální migrací nebo tangenciální migrací. Byly zachyceny sekvence radiální migrace (známé také jako gliové vedení) a somální translokace časosběrná mikroskopie.[17]

Radiální migrace
Neuronální prekurzorové buňky se množí v komorová zóna vývoje neokortex, kde hlavní nervovou kmenovou buňkou je radiální gliální buňka. První postmitotický buňky musí opustit výklenek kmenových buněk a migrovat ven, aby vytvořily preplate, která se má stát Cajal-Retziusovy buňky a dílčí deska neurony. Tyto buňky tak činí somální translokací. Neurony migrující tímto režimem lokomoce jsou bipolární a připojují náběžnou hranu procesu k pia. The soma je poté transportován na povrch pial pomocí nukleokineze, proces, kterým a mikrotubul "klec" kolem jádra se prodlužuje a smršťuje ve spojení s centrosome navést jádro do jeho konečného cíle.[18] Radiální gliové buňky, jehož vlákna slouží jako lešení pro migraci buněk a prostředek radiální komunikace zprostředkované dynamickou aktivitou vápníku,[19][20] působí jako hlavní excitační neuronální kmenová buňka mozkové kůry[21][22] nebo translokovat na kortikální desku a rozlišit buď na astrocyty nebo neurony.[23] Somální translokace může nastat kdykoli během vývoje.[17]
Následné vlny neuronů rozdělily předlohu migrací podél radiální gliové vlákna k vytvoření kortikální desky. Každá vlna migrujících buněk cestuje kolem svých předchůdců a vytváří vrstvy naruby, což znamená, že nejmladší neurony jsou nejblíže k povrchu.[24][25] Odhaduje se, že gliálně řízená migrace představuje 90% migrujících neuronů u člověka a přibližně 75% u hlodavců.[26]
Tangenciální migrace
Většina interneuronů migruje tangenciálně několika způsoby migrace, aby dosáhla svého vhodného umístění v kůře. Příkladem tangenciální migrace je pohyb interneuronů z ganglionická eminence do mozkové kůry. Jedním příkladem probíhající tangenciální migrace ve zralém organismu, který je pozorován u některých zvířat, je rostrální migrační proud spojovací subventrikulární zóna a čichová žárovka.
Axofilní migrace
Mnoho neuronů migrujících podél přední-zadní osy těla využívá existující axon plochy pro migraci; tomu se říká axofilní migrace. Příklad tohoto režimu migrace je v Neurony exprimující GnRH, které dělají dlouhou cestu z rodiště v nose, předním mozkem a do hypotalamu.[27] Bylo zpracováno mnoho mechanismů této migrace, počínaje pokyny pro extracelulární navádění[28] které spouští intracelulární signalizaci. Tyto intracelulární signály, jako např signalizace vápníku, vést k aktin [29] a mikrotubul[30] cytoskeletální dynamika, která produkuje buněčné síly, které prostřednictvím interagují s extracelulárním prostředím proteiny buněčné adheze [31] způsobit pohyb těchto buněk.
Multipolární migrace
Existuje také metoda neuronální migrace multipolární migrace.[32][33] To je vidět v multipolárních buňkách, které jsou v člověku hojně přítomny v kortikální mezizóna. Nepodobají se buňkám migrujícím pohybem nebo somální translokací. Místo toho tyto multipolární buňky exprimují neuronové markery a rozšiřují několik tenkých procesů v různých směrech nezávisle na radiálních gliových vláknech.[32]
Neurotrofické faktory
Přežití neuronů je regulováno faktory přežití, které se nazývají trofické faktory. Neurotrofickou hypotézu formulovali Victor Hamburger a Rita Levi Montalcini na základě studií vyvíjejícího se nervového systému. Victor Hamburger zjistil, že implantace další končetiny do vyvíjejícího se kuřete vedla ke zvýšení počtu spinálních motorických neuronů. Zpočátku si myslel, že extra končetina indukuje proliferaci motorických neuronů, ale on a jeho kolegové později ukázali, že během normálního vývoje došlo k velkému odumírání motorických neuronů, a extra končetina této buněčné smrti zabránila. Podle neurotrofní hypotézy rostoucí axony soutěží o omezené množství trofických faktorů odvozených od cíle a axony, které nedostávají dostatečnou trofickou podporu, umírají apoptózou. Nyní je jasné, že faktory produkované řadou zdrojů přispívají k přežití neuronů.
- Nervový růstový faktor (NGF): Rita Levi Montalcini a Stanley Cohen vyčistili první trofický faktor Nerve Growth Factor (NGF), za který obdrželi Nobelovu cenu. Existují tři trofické faktory související s NGF: BDNF, NT3 a NT4, které regulují přežití různých populací neuronů. Proteiny Trk působí jako receptory pro NGF a související faktory. Trk je receptorová tyrosinkináza. Dimerizace a fosforylace Trk vede k aktivaci různých intracelulárních signálních drah, včetně drah MAP kinázy, Akt a PKC.
- CNTF: Ciliární neurotrofický faktor je další protein, který působí jako faktor přežití pro motorické neurony. CNTF působí prostřednictvím receptorového komplexu, který zahrnuje CNTFRa, GP130 a LIFRβ. Aktivace receptoru vede k fosforylaci a náboru JAK kinázy, která zase fosforyluje LIFR β. LIFRβ funguje jako dokovací místo pro transkripční faktory STAT. JAK kináza fosforyluje proteiny STAT, které se oddělí od receptoru a translokují se do jádra za účelem regulace genové exprese.
- GDNF: Neurotrofický faktor odvozený od glialu je členem TGFb rodina proteinů a je silným trofickým faktorem pro striatální neurony. Funkčním receptorem je heterodimer složený z receptorů typu 1 a typu 2. Aktivace receptoru typu 1 vede k fosforylaci proteinů Smad, které se translokují do jádra a aktivují genovou expresi.
Tvorba synapse
Neuromuskulární spojení
Velká část našeho chápání tvorby synapsí pochází ze studií na neuromuskulárním spojení. Vysílačem v této synapse je acetylcholin. Acetylcholinový receptor (AchR) je přítomen na povrchu svalových buněk před tvorbou synapsí. Příchod nervu vyvolává shlukování receptorů v synapse. McMahan a Sanes ukázali, že synaptogenní signál je koncentrován na bazální lamina. Ukázali také, že synaptogenní signál je produkován nervem, a identifikovali faktor jako Úšklebek. Agrin indukuje shlukování AchRs na povrchu svalu a tvorba synapsí je narušena u myší s vyřazeným agrinem. Agrin přenáší signál přes MuSK receptor na rapsyn. Fischbach a kolegové prokázali, že receptorové podjednotky jsou selektivně transkribovány z jader vedle synaptického místa. To je zprostředkováno neureguliny.
Ve zralé synapse je každé svalové vlákno inervováno jedním motorickým neuronem. Během vývoje je však mnoho vláken inervováno několika axony. Lichtman a kolegové studovali proces eliminace synapsí.[34] Toto je událost závislá na činnosti. Částečné blokování receptoru vede k zatažení příslušných presynaptických terminálů.
CNS synapse
Zdá se, že Agrin není centrálním mediátorem tvorby synapsí CNS a existuje aktivní zájem o identifikaci signálů, které zprostředkovávají synaptogenezi CNS. Neurony v kultuře vyvíjejí synapsie podobné těm, které se tvoří in vivo, což naznačuje, že synaptogenní signály mohou správně fungovat in vitro. Studie synaptogeneze CNS se zaměřily hlavně na glutamatergické synapsie. Zobrazovací experimenty ukazují, že dendrity jsou během vývoje vysoce dynamické a často navazují kontakt s axony. Poté následuje nábor postsynaptických proteinů na místo kontaktu. Stephen Smith a kolegové ukázali, že kontakt inicioval dendritická filopodia se může vyvinout v synapse.
Indukce tvorby synapsí gliovými faktory: Barres a kolegové učinili pozorování, že faktory v gliálním podmíněném médiu indukují tvorbu synapsí v buněčných kulturách ganglií sítnice. Tvorba synapsí v CNS koreluje s diferenciací astrocytů, což naznačuje, že astrocyty mohou poskytovat synaptogenní faktor. Identita astrocytových faktorů dosud není známa.
Neuroliginy a SynCAM jako synaptogenní signály: Sudhof, Serafini, Scheiffele a kolegové prokázali, že neuroliginy a SynCAM mohou působit jako faktory, které indukují presynaptickou diferenciaci. Neuroliginy jsou koncentrovány v postsynaptickém místě a působí prostřednictvím neurexinů koncentrovaných v presynaptických axonech. SynCAM je molekula buněčné adheze, která je přítomna v pre- i postsynaptických membránách.
Mechanismy závislé na činnosti při sestavování nervových obvodů
Procesy neuronální migrace, diferenciace a axonové vedení jsou obecně považovány za mechanismy nezávislé na aktivitě a spoléhají na drátové genetické programy v samotných neuronech. Zjištění výzkumu však implikovala roli pro mechanismy závislé na činnosti při zprostředkování některých aspektů těchto procesů, jako je rychlost migrace neuronů,[35] aspekty neuronové diferenciace[36] a hledání axonů.[37] Mechanismy závislé na činnosti ovlivňují vývoj nervových obvodů a jsou zásadní pro rozvržení časných map konektivity a pokračující zdokonalování synapsí, ke kterým dochází během vývoje.[38] Existují dva odlišné typy nervové aktivity, které pozorujeme při vývoji obvodů - časná spontánní aktivita a aktivita vyvolaná smysly. Spontánní aktivita nastává brzy během neurální obvod vývoj, i když smyslový vstup chybí a je pozorován v mnoha systémech, jako je vývoj vizuální systém,[39][40] sluchový systém,[41][42] motorový systém,[43] hipokampus,[44] mozeček[45] a neokortex.[46]
Experimentální techniky, jako je přímý elektrofyziologický záznam, fluorescenční zobrazování pomocí indikátorů vápníku a optogenetické techniky, osvětlily povahu a funkci těchto časných dávek aktivity.[47][48] Během vývoje mají odlišné prostorové a časové vzorce[49] a je známo, že jejich ablace během vývoje má za následek deficity v zdokonalování sítě ve vizuálním systému.[50] U nezralých sítnice, vlny spontánních akčních potenciálů vznikají z gangliové buňky sítnice a zamést přes povrch sítnice v prvních několika postnatálních týdnech.[51] Tyto vlny jsou zprostředkovány neurotransmiter acetylcholin v počáteční fázi a později glutamát.[52] Říká se, že dávají pokyny k vytvoření dvou smyslových map - retinotopický mapa a oční specifická segregace.[53] Upřesnění retinotopické mapy se vyskytuje v následných vizuálních cílech v mozku superior colliculus (SC) a hřbetní boční geniculate jádro (LGN).[54] Farmakologické narušení a myší modely postrádající podjednotku β2 nikotinový acetylcholinový receptor ukázal, že nedostatek spontánní aktivity vede k výrazným defektům v retinotopy a segregace specifická pro oči.[53]
Ve vývoji sluchový systém, rozvíjející se kochlea generovat výbuchy aktivity, které se šíří napříč vnitřní vlasové buňky a spirální ganglion neurony, které přenášejí sluchové informace do mozku.[55] ATP uvolnění z podpůrných buněk spouští akční potenciály v vnitřní vlasové buňky.[56] V sluchovém systému se předpokládá, že spontánní aktivita se podílí na tvorbě tonotopické mapy segregací axonů kochleárních neuronů naladěných na vysoké a nízké frekvence.[55] V motorickém systému jsou periodické výbuchy spontánní aktivity poháněny excitační GABA a glutamát v raných fázích a do acetylcholin a glutamát v pozdějších fázích.[57] Ve vývoji zebrafish mícha je nutná časná spontánní aktivita pro tvorbu stále synchronnějších střídavých výbuchů mezi ipsilaterálními a kontralaterálními oblastmi míchy a pro integraci nových buněk do obvodu.[58] V kůra, v USA byly pozorovány první vlny aktivity mozeček a kortikální řezy.[59] Jakmile je k dispozici senzorický stimul, finální doladění senzoricky kódovacích map a zdokonalování obvodů se stále více a více spoléhá na senzorem vyvolanou aktivitu, jak dokazují klasické experimenty o účincích senzorické deprivace během kritická období.[59]
Současná difúzní váha MRI techniky mohou také odhalit makroskopický proces axonálního vývoje. The konektom lze postavit z difúzní MRI data: vrcholy grafu odpovídají anatomicky označeným oblastem šedé hmoty a dva takové vrcholy, řekněme u a proti, jsou spojeny hranou, pokud traktografie fáze zpracování dat najde axonální vlákno, které spojuje dvě oblasti, odpovídající u a proti.
Četné braingrafy, počítané z Projekt Human Connectome lze stáhnout z http://braingraph.org stránky. Consensus Connectome Dynamics (CCD) je pozoruhodný jev, který byl objeven kontinuálním snižováním minimálního parametru spolehlivosti na grafickém rozhraní Budapešť Reference Connectome Server.[60][61] Budapešťský referenční server Connectome (http://connectome.pitgroup.org ) zobrazuje mozkové vazby n = 418 subjektů s frekvenčním parametrem k: Pro libovolné k = 1,2, ..., n lze zobrazit graf hran, které jsou přítomny alespoň v k connectomech. Pokud se parametr k sníží jeden po druhém z k = n na k = 1, objeví se v grafu stále více a více hran, protože podmínka zahrnutí je uvolněná. Překvapivým poznatkem je, že vzhled hran není zdaleka náhodný: připomíná rostoucí, složitou strukturu, jako je strom nebo keř (vizualizace na animaci vlevo).
Předpokládá se v [62] že rostoucí struktura kopíruje axonální vývoj lidského mozku: nejčasnější rozvíjející se spojení (axonální vlákna) jsou běžná u většiny subjektů a následně se rozvíjející spojení mají stále větší rozptyl, protože jejich odchylky se hromadí v procesu axonálního vývoje.
Eliminace synapse
Několik motorneuronů soutěží o každé neuromuskulární spojení, ale pouze jeden přežije až do dospělosti.[34] Soutěž in vitro Bylo prokázáno, že zahrnuje omezenou neurotrofickou látku, která se uvolňuje, nebo že nervová aktivita přináší výhodu silným postsynaptickým spojením tím, že poskytuje odolnost vůči toxinu uvolněnému také při nervové stimulaci. In vivo, navrhuje se, aby svalová vlákna vybrala nejsilnější neuron prostřednictvím retrográdního signálu.
Neurogeneze dospělých
Neurogeneze také se vyskytuje ve specifických částech dospělého mozku.
Viz také
Reference
- ^ „Neurologické příznaky a nemoci“. 2. listopadu 2016. Archivovány od originál dne 02.11.2016. Citováno 1. května 2020.
- ^ „Poruchy neurální trubice“. Citováno 6. prosince 2011.
- ^ A b Gilbert, Scott (2006). Vývojová biologie (8. vydání). Vydavatelé Sinauer Associates. str.373 –379. ISBN 9780878932504.
- ^ Wolpert, Lewis (2015). Zásady rozvoje (Páté vydání.). str. 522–526. ISBN 9780199678143.
- ^ Saladin, Kenneth (2011). Anatomie a fyziologie Jednota formy a funkce. New York: McGraw Hill. str. 514. ISBN 9780073378251.
- ^ A b Gato, A; Alonso, MI; Martín, C .; et al. (28. srpna 2014). „Embryonální cerebrospinální tekutina ve vývoji mozku: kontrola nervového předka“. Chorvatský lékařský deník. 55 (4): 299–305. doi:10,3325 / cmj.2014.55.299. PMC 4157377. PMID 25165044.
- ^ Gilbert, Scott (2013). Vývojová biologie (Desáté vydání). Sinauer Associates Inc. ISBN 978-1605351926.[stránka potřebná ]
- ^ A b Kandel, Eric R. (2006). Principy neurální vědy (5. vyd.). Appleton a Lange: McGraw Hill. ISBN 978-0071390118.[stránka potřebná ]
- ^ Croteau-Chonka, Elise C .; Dean, Douglas C., III; Remer, Justin; Dirks, Holly; O'Muircheartaigh, Jonathan; Deoni, Sean C.L. (15. října 2015). „Zkoumání vztahů mezi kortikálním zráním a myelinací bílé hmoty v raném dětství“. NeuroImage. 125: 413–421. doi:10.1016 / j.neuroimage.2015.10.038. PMC 4691410. PMID 26499814.

- ^ Wolpert, Lewis (2015). Zásady rozvoje (Páté vydání.). str. 163. ISBN 9780199678143.
- ^ Estomih Mtui; Gregory Gruener (2006). Klinická neuroanatomie a neurovědy. Philadelphia: Saunders. str. 1. ISBN 978-1-4160-3445-2.
- ^ Chambers, S. M .; Fasano, C. A .; Papapetrou, E. P .; Tomishima, M .; Sadelain, M .; Studer, L. (2009). „Vysoce účinná neurální přeměna lidských buněk ES a iPS pomocí duální inhibice signalizace SMAD“. Přírodní biotechnologie. 27 (3): 275–280. doi:10,1038 / nbt.1529. PMC 2756723. PMID 19252484.
- ^ Jessell, Thomas M .; Kandel, Eric R .; Schwartz, James H. (2000). „Kapitola 55“. Principy neurální vědy (4. vydání). New York: McGraw-Hill. ISBN 978-0838577011.
- ^ Duester, G (září 2008). „Syntéza a signalizace kyseliny retinové během časné organogeneze“. Buňka. 134 (6): 921–31. doi:10.1016 / j.cell.2008.09.002. PMC 2632951. PMID 18805086.
- ^ A b Wang, Zhiqin; Tang, Beisha; On, Yuquan; Jin, Peng (březen 2016). "Dynamika methylace DNA v neurogenezi". Epigenomika. 8 (3): 401–414. doi:10.2217 / epi.15.119. PMC 4864063. PMID 26950681.
- ^ Noack, Florian; Pataskar, Abhijeet; Schneider, Martin; Buchholz, Frank; Tiwari, Vijay K; Calegari, Federico (27. února 2019). „Hodnocení a site-specific manipulace s DNA (hydroxy-) methylací během myší kortikogeneze“. Life Science Alliance. 2 (2): e201900331. doi:10,26508 / lsa.201900331. PMC 6394126. PMID 30814272.
- ^ A b Nadarajah B, Brunstrom J, Grutzendler J, Wong R, Pearlman A (2001). "Dva způsoby radiální migrace v časném vývoji mozkové kůry". Nat Neurosci. 4 (2): 143–50. doi:10.1038/83967. PMID 11175874.
- ^ Samuels B, Tsai L (2004). "Nucleokinesis osvětlené". Nat Neurosci. 7 (11): 1169–70. doi:10.1038 / nn1104-1169. PMID 15508010.
- ^ Rakic, P (květen 1972). "Režim buněčné migrace do povrchových vrstev neokortexu plodu opice". The Journal of Comparative Neurology. 145 (1): 61–83. doi:10,1002 / k.901450105. PMID 4624784.
- ^ Vyrážka, BG; Ackman, JB; Rakic, P (únor 2016). „Obousměrná radiální aktivita Ca (2+) reguluje neurogenezi a migraci během rané tvorby kortikální kolony“. Vědecké zálohy. 2 (2): e1501733. Bibcode:2016SciA .... 2E1733R. doi:10.1126 / sciadv.1501733. PMC 4771444. PMID 26933693.
- ^ Noctor, SC; Flint, AC; Weissman, TA; Dammerman, RS; Kriegstein, AR (8. února 2001). "Neurony odvozené od radiálních gliových buněk vytvářejí radiální jednotky v neokortexu". Příroda. 409 (6821): 714–20. Bibcode:2001Natur.409..714N. doi:10.1038/35055553. PMID 11217860.
- ^ Tamamaki N, Nakamura K, Okamoto K, Kaneko T (září 2001). „Radial glia is a progenitor of neocortical neurons in the developing cerebral cortex“. Neurosci. Res. 41 (1): 51–60. doi:10.1016 / S0168-0102 (01) 00259-0. PMID 11535293.
- ^ Miyata T, Kawaguchi A, Okano H, Ogawa M (září 2001). "Asymetrická dědičnost radiálních gliových vláken kortikálními neurony". Neuron. 31 (5): 727–41. doi:10.1016 / S0896-6273 (01) 00420-2. PMID 11567613.
- ^ Nadarajah B, Parnavelas J (2002). "Režimy neuronální migrace ve vyvíjející se mozkové kůře". Recenze přírody Neurovědy. 3 (6): 423–32. doi:10.1038 / nrn845. PMID 12042877.
- ^ Rakic P (1972). "Režim buněčné migrace do povrchových vrstev neokortexu plodu opice". Journal of Comparative Neurology. 145 (1): 61–83. doi:10,1002 / k.901450105. PMID 4624784.
- ^ Letinic K, Zoncu R, Rakic P (červen 2002). "Původ GABAergních neuronů v lidském neokortexu". Příroda. 417 (6889): 645–9. Bibcode:2002 Natur.417..645L. doi:10.1038 / nature00779. PMID 12050665.
- ^ Wray S (2010). "Od nosu k mozku: vývoj neuronů uvolňujících gonadotropin 1-hormon". Journal of Neuroendocrinology. 22 (7): 743–753. doi:10.1111 / j.1365-2826.2010.02034.x. PMC 2919238. PMID 20646175.
- ^ Giacobini P, Messina A, Wray S, Giampietro C, Crepaldi T, Carmeliet P, Fasolo A (2007). „Hepatocytový růstový faktor působí jako motogen a řídící signál pro neuronální migraci hormonu uvolňujícího gonadotropin-1“ (PDF). Journal of Neuroscience. 27 (2): 431–445. doi:10.1523 / JNEUROSCI.4979-06.2007. PMC 6672060. PMID 17215404.
- ^ Hutchins BI, Klenke U, Wray S (2013). „Tok aktinu závislý na uvolňování vápníku v hlavním procesu zprostředkovává axofilní migraci“. Journal of Neuroscience. 33 (28): 11361–71. doi:10.1523 / JNEUROSCI.3758-12.2013. PMC 3724331. PMID 23843509.
- ^ Hutchins, B. Ian; Wray, Susan (2014). „Zachycení plusových konců mikrotubulů v kůře aktinu podporuje migraci axofilních neuronů zvýšením napětí mikrotubulů v hlavním procesu“. Hranice v buněčné neurovědě. 8: 400. doi:10.3389 / fncel.2014.00400. PMC 4245908. PMID 25505874.
- ^ Parkash J, Cimino I, Ferraris N, Casoni F, Wray S, Cappy H, Prevot V, Giacobini P (2012). „Potlačení β1-integrinu v hormonálních buňkách uvolňujících gonadotropin narušuje migraci a prodloužení axonů, což vede k závažným reprodukčním změnám“. Journal of Neuroscience. 32 (47): 16992–7002. doi:10.1523 / JNEUROSCI.3057-12.2012. PMC 5238668. PMID 23175850.
- ^ A b Tabata H, Nakajima K (5. listopadu 2003). „Multipolární migrace: třetí způsob migrace radiálních neuronů ve vyvíjející se mozkové kůře“. Journal of Neuroscience. 23 (31): 9996–10001. doi:10.1523 / JNEUROSCI.23-31-09996.2003. PMC 6740853. PMID 14602813.
- ^ Nadarajah B, Alifragis P, Wong R, Parnavelas J (2003). „Neuronální migrace ve vyvíjející se mozkové kůře: pozorování založená na zobrazování v reálném čase“. Mozková kůra. 13 (6): 607–11. doi:10.1093 / cercor / 13.6.607. PMID 12764035.
- ^ A b Turney, Stephen G .; Lichtman, Jeff W .; Harris, William A. (26. června 2012). „Zvrácení výsledku eliminace synapse při vývoji neuromuskulárních spojení in vivo: důkazy o synaptické soutěži a jejím mechanismu“. PLOS Biology. 10 (6): e1001352. doi:10.1371 / journal.pbio.1001352. PMC 3383738. PMID 22745601.
- ^ Komuro, Hitoshi; Rakic, Pasko (srpen 1996). "Intracelulární fluktuace Ca2 + modulují rychlost migrace neuronů". Neuron. 17 (2): 275–285. doi:10.1016 / s0896-6273 (00) 80159-2. PMID 8780651.
- ^ Gu, X; Olson, E.C .; Spitzer, NC (1994). „Spontánní neuronální vápníkové skoky a vlny během časné diferenciace“. Journal of Neuroscience. 14 (11): 6325–35. doi:10.1523 / JNEUROSCI.14-11-06325.1994.
- ^ Hanson, M.G .; Milner, L.D; Landmesser, L.T (2008). „Spontánní časná aktivita v míchu kuřat ovlivňuje odlišná rozhodnutí o hledání dráhy motorického axonu“. Brain Res. Rev. 57 (1): 77–85. doi:10.1016 / j.brainresrev.2007.06.021. PMC 2233604. PMID 17920131.
- ^ Kirkby, L. A.; Sack, GS; Firl, A; Feller, M.B. (4. prosince 2013). „Role pro korelovanou spontánní aktivitu při sestavování nervových obvodů“. Neuron. 80 (5): 1129–44. doi:10.1016 / j.neuron.2013.10.030. PMC 4560201. PMID 24314725.
- ^ Huberman, A.D. (2007). "Mechanismy vývoje zrakového obvodu specifického pro oko". Aktuální názor v neurobiologii. 17 (1): 73–80. doi:10.1016 / j.conb.2007.01.005. PMID 17254766.
- ^ Meister, M; Wong, R.O.L; Baylor, D.A .; Shatz, C.J (1991). "Synchronní výbuchy akčních potenciálů v gangliových buňkách vyvíjející se sítnice". Věda. 252 (5008): 939–43. Bibcode:1991Sci ... 252..939M. doi:10.1126 / science.2035024. PMID 2035024.
- ^ Lippe, W. R. (1994). „Rytmická spontánní aktivita ve vyvíjejícím se ptačím sluchovém systému“. The Journal of Neuroscience. 14 (3): 1486–95. doi:10.1523 / JNEUROSCI.14-03-01486.1994.
- ^ Jones, T. A.; Jones, S.M .; Paggett, K.C (15. října 2001). „Prvotní rytmické prasknutí v embryonálních kochleárních gangliových buňkách“. The Journal of Neuroscience. 21 (20): 8129–35. doi:10.1523 / JNEUROSCI.21-20-08129.2001. PMC 6763868. PMID 11588185.
- ^ O'Donovan, M. J. (1999). "Počátek spontánní aktivity při vývoji sítí nervového systému obratlovců". Aktuální názor v neurobiologii. 9 (1): 94–104. doi:10.1016 / s0959-4388 (99) 80012-9. PMID 10072366.
- ^ Crepel, V; Aronov, D; Jorquera, I; Represa, A; Ben-Ari, Y; Cossart, R (2007). „Nesynaptický koherentní vzor aktivity spojený s porodem ve vyvíjejícím se hipokampu“. Neuron. 54 (1): 105–120. doi:10.1016 / j.neuron.2007.03.007. PMID 17408581.
- ^ Watt, A.J .; Cuntz, H; Mori, M; Nusser, Z; Sjostrom, P.J; Hausser, M (2009). „Cestovní vlny ve vývoji mozkové kůry zprostředkované asymetrickou konektivitou Purkyňových buněk“. Přírodní neurovědy. 12 (4): 463–73. doi:10.1038 / nn.2285. PMC 2912499. PMID 19287389.
- ^ Corlew, Rebekah; Bosma, Martha M .; Moody, William J. (říjen 2004). "Spontánní, synchronní elektrická aktivita v neonatálních myších kortikálních neuronech". The Journal of Physiology. 560 (2): 377–390. doi:10.1113 / jphysiol.2004.071621. PMC 1665264. PMID 15297578.
- ^ Feller, Marla B. (duben 1999). "Spontánní korelovaná aktivita při vývoji neurálních obvodů". Neuron. 22 (4): 653–656. doi:10.1016 / s0896-6273 (00) 80724-2. PMID 10230785.
- ^ O'Donovan, Michael J .; Chub, Nikolai; Wenner, Peter (říjen 1998). "Mechanismy spontánní aktivity při vývoji spinálních sítí". Journal of Neurobiology. 37 (1): 131–145. doi:10.1002 / (sici) 1097-4695 (199810) 37: 1 <131 :: aid-neu10> 3.0.co; 2-h. PMID 9777737.
- ^ Stafford, Ben K .; Sher, Alexander; Litke, Alan M .; Feldheim, David A. (říjen 2009). „Časoprostorové vzory sítnicových vln, které jsou základem aktivity závislé na zdokonalení sítnicových projekcí“. Neuron. 64 (2): 200–212. doi:10.1016 / j.neuron.2009.09.021. PMC 2771121. PMID 19874788.
- ^ Torborg, Christine L .; Feller, Marla B. (červenec 2005). "Spontánní vzorovaná aktivita sítnice a upřesnění projekcí sítnice". Pokrok v neurobiologii. 76 (4): 213–235. doi:10.1016 / j.pneurobio.2005.09.002. PMID 16280194.
- ^ Galli, L; Maffei, L (7. října 1988). "Spontánní impulzní aktivita krysích gangliových buněk sítnice v prenatálním životě". Věda. 242 (4875): 90–91. Bibcode:1988Sci ... 242 ... 90G. doi:10.1126 / science.3175637. PMID 3175637.
- ^ Ford, Kevin J .; Feller, Marla B. (26. července 2011). „Montáž a demontáž sítnice cholinergní sítě“. Vizuální neurověda. 29 (1): 61–71. doi:10.1017 / S0952523811000216. PMC 3982217. PMID 21787461.
- ^ A b Kirkby, Lowry A .; Sack, Georgeann S .; Firl, Alana; Feller, Marla B. (prosinec 2013). „Role pro korelovanou spontánní aktivitu při sestavování neurálních obvodů“. Neuron. 80 (5): 1129–1144. doi:10.1016 / j.neuron.2013.10.030. PMC 4560201. PMID 24314725.
- ^ Ackman, James B .; Burbridge, Timothy J .; Crair, Michael C. (10. října 2012). „Vlny sítnice koordinují vzorovanou aktivitu v celém vyvíjejícím se vizuálním systému“. Příroda. 490 (7419): 219–225. Bibcode:2012 Natur.490..219A. doi:10.1038 / příroda11529. PMC 3962269. PMID 23060192.
- ^ A b Kandler, Karl; Clause, Amanda; Noh, Jihyun (10. května 2009). „Tonotopická reorganizace vývoje obvodů sluchového mozkového kmene“. Přírodní neurovědy. 12 (6): 711–717. doi:10.1038 / č. 2332. PMC 2780022. PMID 19471270.
- ^ Tritsch, Nicolas X; Rodríguez-Contreras, Adrián; Crins, Tom TH; Wang, Han Chin; Borst, J. Gerard G; Bergles, Dwight E (1. srpna 2010). „Akční potenciály vápníku ve vlasových buňkách vytvářejí aktivitu sluchových neuronů před nástupem sluchu“. Přírodní neurovědy. 13 (9): 1050–1052. doi:10.1038 / č. 2604. PMC 2928883. PMID 20676105.
- ^ Momose-Sato, Yoko; Sato, Katsushige (2013). "Velká synchronizovaná aktivita v embryonálním mozkovém kmeni a míchě". Hranice v buněčné neurovědě. 7: 36. doi:10,3389 / fncel.2013.00036. PMC 3625830. PMID 23596392.
- ^ Warp, Erica; Agarwal, Gautam; Wyart, Claire; Friedmann, Drew; Oldfield, Claire S .; Conner, Alden; Del Bene, Filippo; Arrenberg, Aristides B .; Baier, Herwig; Isacoff, Ehud Y. (leden 2012). „Vznik vzorované aktivity ve vyvíjející se míchě Zebrafish“. Aktuální biologie. 22 (2): 93–102. doi:10.1016 / j.cub.2011.12.002. PMC 3267884. PMID 22197243.
- ^ A b Sanes, Dan; Reh, Thomas; Harris, William. Vývoj nervového systému (Třetí vydání.). Elsevier.[stránka potřebná ]
- ^ Szalkai, Balázs; Kerepesi, Csaba; Varga, Bálint; Grolmusz, Vince (květen 2015). "Budapest Reference Connectome Server v2.0". Neurovědy Dopisy. 595: 60–62. arXiv:1412.3151. doi:10.1016 / j.neulet.2015.03.071. PMID 25862487.
- ^ Szalkai, Balázs; Kerepesi, Csaba; Varga, Bálint; Grolmusz, Vince (15. září 2016). „Parametrizovatelné konsensuální konektomy z projektu Human Connectome: Budapest Reference Connectome Server v3.0“. Kognitivní neurodynamika. 11 (1): 113–116. arXiv:1602.04776. doi:10.1007 / s11571-016-9407-z. PMC 5264751. PMID 28174617.
- ^ Kerepesi, Csaba; Szalkai, Balázs; Varga, Bálint; Grolmusz, Vince; Shi, Yongtang (30. června 2016). „Jak nasměrovat hrany Connectomes: Dynamika konsensuálního Connectomes a rozvoj spojení v lidském mozku“. PLOS ONE. 11 (6): e0158680. arXiv:1509.05703. Bibcode:2016PLoSO..1158680K. doi:10.1371 / journal.pone.0158680. PMC 4928947. PMID 27362431.
externí odkazy
| Prostředky knihovny o Vývoj nervového systému |
- Neurální vývoj (recenzovaný deník s otevřeným přístupem).
- Překládání času neurového vývoje napříč druhy savců
- Dětský mozek
- Vývoj mozku
- Jak může chudoba změnit mozek
- Teenage Brain


