Synaptická stabilizace - Synaptic stabilization
Tato stránka popisuje proces stabilizace synapsí zprostředkovaný molekulami buněčné adheze. Související články najdete na stránkách na Synaptogeneze, Synaptická plasticita, Molekula buněčné adheze, Vývoj nervového systému.

Synaptická stabilizace je zásadní pro vývojový a dospělý nervový systém a je považován za výsledek pozdní fáze dlouhodobé potenciace (LTP). Mechanismus zahrnuje posílení a udržení aktivní činnosti synapse prostřednictvím zvýšené exprese prvků cytoskeletální a extracelulární matrix a postsynaptické proteiny lešení, zatímco prořezávají méně aktivní. Například, molekuly buněčné adheze (CAM) hrají velkou roli v synaptické údržbě a stabilizaci. Gerald Edelman objevili CAM a studovali jejich funkce během vývoje, což ukázalo, že CAM jsou potřebné pro migrace buněk a formování celého nervového systému.[1][2] V nervovém systému dospělých hrají CAM nedílnou roli synaptická plasticita vztahující se učení se a Paměť.[3]
Typy CAM
SynCAM
Synaptické buněčné adhezní molekuly (CAM) hrají klíčovou roli při hledání axonové dráhy a synaptickém usazování mezi neurony během neurovývoj a jsou integrálními členy mnoha synaptických procesů, včetně správného zarovnání pre- a postsynaptických procesů dráhy přenosu signálu, vezikulární recyklace s ohledem na endocytóza a exocytóza, integrace postsynaptických receptorů a ukotvení k cytoskelet zajistit stabilitu synaptických komponent [4]
SynCAM's (také známé jako Cadm nebo molekuly podobné nektinu) jsou specifickým typem synaptických CAM nalezených v obratlovců který podporuje růst a stabilizaci excitačních (ne inhibičních) synapsí. SynCAM jsou lokalizovány primárně v mozek na pre- i postsynaptických místech a jejich struktury se skládají z intracelulárních vazebných domén FERM a PDZ, jedné transmembránové domény a tří extracelulárních Ig domény. Během neurového vývoje fungují SynCAM jako SynCAM1 jako „kontaktní senzory“ axonů růstové kužele rychle se hromadí, když jsou vytvářena axo-dendritická spojení, a pomáhá vytvářet stabilní přilnavost komplex.[5]
synCAM1 spolu s neuroligin jsou dva CAM, o nichž je známo, že jsou dostatečné k zahájení tvorby presynaptických terminálů, protože přidání synCAM1 k médiu společně kultivovaných neuronálních a neuronálních buněk vede k vytvoření presynaptických terminálů. Homofilní vazba dvou synCAM1 molekul na filopodii axonálního růstového kuželu a dendritické páteře umožňuje počáteční kontakt mezi pre- a postsynaptickou buňkou.[6]
synCAM patří do Ig nadčeleď bílkovin. Cytosolické PDZ domény synCAM vložené do postsynaptické membrány interagují s postsynaptickým proteinem lešení PSD-95 což pomáhá ukotvit komplex k podkladovému cytoskeletu.[7]
Kadherin-katenin

Kadheriny jsou závislí na vápníku, homofilní molekuly buněčné adheze které tvoří komplexy s cytosolickými partnery známými jako kateniny.[8] Složky tohoto komplexu se vážou na řadu různých proteinů lešení, fosfatáz, kináz a receptorů.[9] Klasické kadheriny mají pět extracelulárních opakujících se struktur, které vážou vápník, jednu transmembránovou doménu a intracelulární ocas s distální cytosolickou doménou, která váže kateninového partnera.[9][10] Nedávná práce zahrnovala komplex kadherin-katenin do řady různých procesů centrálního nervového systému, jako je synaptická stabilizace a plasticita.[8][9][10]
Mnoho kadherinů v centrální nervový systém vykazují odlišné prostorové a časové výrazové vzorce.[9] Například, N-kadherin je široce vyjádřen na rozvíjející se synapse a později zůstává poblíž zralé aktivní zóny, což naznačuje, že tento komplex může být vhodný pro poskytnutí spojení mezi strukturálními změnami a synaptickou stabilitou.[9] Ve skutečnosti mají místní synaptické změny aktivity vliv na vyjádření kadherin-katenin komplexy.[9] Zvýšení aktivity u konkrétního páteř vede k dimerizaci N-kadherinu, který se poté štěpí, což vede k represi CBP /CREB transkripce.[9] Tato represe má mnoho vývojových a plastických důsledků.
V případě dendritická páteř formace a prořezávání, byla navržena a potvrzena hypotéza konkurence.[11][12] Tato hypotéza naznačuje, že relativní hladiny komplexů kadherin-katenin, které jsou distribuovány mezi trny v místní oblasti způsobem závislým na aktivitě, určují osud jednotlivých trnů. To znamená, že interpáteřní soutěž o β-katenin určuje, zda bude páteř vyzrálá (zvýšený počet komplexů) nebo prořezána (snížený počet komplexů).[12] Toto je kritický mechanismus během zdokonalování kortikálních obvodů, ke kterému dochází během vývoje.[11]
Nektin
Nektiny jsou zřetelná rodina molekuly buněčné adheze. Tyto CAM jsou zapojeny do počátečního kontaktu uživatele presynaptický a postsynaptické neuronální procesy během tvorby synapsí. U nás jsou pouze čtyři dobře charakterizované nektiny synapse, jsou to Nektin-1, 2, 3 a 4.[13] Všechno membrána navázané nektiny mají extracelulární oblast se třemi smyčkami podobnými imunoglobulinům. Nejvzdálenější smyčka z membrány se nazývá smyčka typu V a dvě další smyčky uvnitř jsou smyčky typu C2. Několik nektinů na jedné buněčné membráně se bude vázat na smyčce typu V za vzniku shluku proteinů nektinu, což je proces zvaný shlukování cis. Když dvě buňky, které mají jednotlivé cis-klastry, přijdou do kontaktu, vytvoří silný komplex zvaný a trans-interakce který zajišťuje adhezi a v některých případech signalizaci mezi dvěma buňkami.[14]
Nejsilnější znalost role nektinu v synaptické stabilizaci pochází ze synapsí vytvořených mezi nimi mechové vlákno terminály a pyramidová buňka dendrity v Oblast CA3 hipokampu.[15] Nektiny podílející se na tvorbě a stabilizaci této synapsie jsou Nektin-1 a Nektin-3, které vyčnívají z plazmatické membrány postsynaptické buňky a presynaptické buňky a vytvářejí heterofilní extracelulární kontakty. Intracelulární doména všech nektinů se přímo váže na protein zvaný L-Afadin. L-Afadin je aktin vazebný protein, který se váže na F-aktin aktinu cytoskelet. Tímto způsobem nektiny vytvářejí vyvýšená spojení architektury aktinových buněk, což umožňuje vývoj synapse v kontrolovaném a stabilním prostředí.[16]
Jak synapse dozrávají v oblasti CA3, nektiny a kadheriny, které úzce spolupracují v synaptické stabilizaci, jsou posunuty na periferii aktivní zóna a tvoří spojení puncta adherens (PAJ). PAJ funguje podobně jako dodržuje spojení v epiteliální papírové kapesníky. Přesun těchto CAM a tvorba tohoto spojení poskytuje rodícím se synaptickým membránám prostor pro interakci a zrání, zatímco se oddělují od okolní membrány a zajišťují cytoskeletální fixaci.[14]
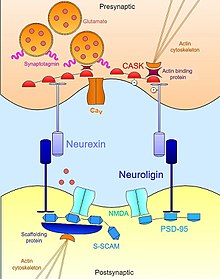
Neurexin-neuroligin
Neurexin -Neuroligin Interakce pomáhají vytvořit transsynaptickou funkční asymetrii nezbytnou pro stabilizaci a udržení správné funkce synaptický přenos.[17] Presynaptický neurexin a jeho postsynaptický vazebný partner, neuroligin, jsou na počátku nervového vývoje komplexní a je známo, že jsou silnými induktory synaptogeneze.[18] Neneuronální buňky, které uměle exprimují neurexin, jsou dostatečné k mobilizaci postsynaptických specializací v kokultivovaných neuronech;[19] buňky exprimující neuroligin jsou rovněž schopné indukovat markery presynaptické diferenciace v sousedních neuronech.[20][21] I když oba hrají důležitou roli v synaptogenezi, tyto molekula buněčné adheze nejsou nutné pro tvorbu neuronových spojení během vývoje.[22] Trojnásobný knockout myš mutant buď neurexinů nebo neuroliginů vykazuje normální počet synapsí, ale exprimuje embryonální letální fenotyp kvůli narušení normálního synaptického přenosu.[23] Proto nejsou pro tvorbu synapsí nezbytné per se ale jsou nezbytné pro zrání a integraci synapsí do funkčních obvodů nezbytných pro přežití.
Kromě svého extracelulárního kontaktu mezi sebou se neurexiny a neuroliginy také vážou intracelulárně na rozsáhlou síť adaptační proteiny a lešení, které ve shodě s aktinový cytoskelet, pomozte lokalizovat nezbytné součásti synaptického přenosu. Například první neuroligin (NLGN1 ) objeveno bylo identifikováno jeho Doména PDZ na které se váže PSD95, známý a protein lešení na glutamátergní synapse které funkčně odkazují NMDA receptory do správného postsynaptického národního prostředí.[21][24] Podobně další izoforma neuroliginu (NLGN2 ) interaguje s gephyrin, protein lešení specifický pro GABA-ergické synapse, a je zodpovědný za aktivaci synaptického adaptorového proteinu collybistin.[25] V případě neurexinů jsou jejich intracelulární vazebné interakce stejně důležité při získávání základního aparátu pro synaptický přenos v aktivní zóně. Stejně jako neuroliginy, i neurexiny mají doménu PDZ, která se s ní spojuje SUD (Proteinová kináza závislá na vápníku a kalmodulinu ).[24] Kromě samotné fosforylace a neurexinu podporuje CASK interakce mezi neurexiny a proteiny vázajícími aktin, čímž poskytuje přímou vazbu, kterou může neurexin modulovat cytoskeletální dynamiku, která je nezbytná pro synaptickou stabilitu a plasticitu. Neurexin se může také vázat synaptotagmin, protein zabudovaný v membráně synaptických vezikul, a může také podporovat asociace s napěťově řízený vápníkový kanál které zprostředkovávají iontový tok potřebný pro neurotransmiter exocytóza při synaptické stimulaci.[26][23] Tímto způsobem neurexin a neuroligin koordinují morfologické a funkční aspekty synapse, což zase umožňuje stabilizaci rodících se nezralých kontaktů do plnohodnotných funkčních platforem pro neurotransmisi.
Signalizace Ephrin-Eph

Netradiční adhezní molekuly, například efriny, také pomáhají stabilizovat synaptické kontakty. Eph receptory a jejich ligandy vázané na membránu, efriny, jsou zapojeny do různých buněčných procesů během vývoje a zrání, včetně axonové vedení, neuronální migrace, synaptogeneze, a prořezávání axonů.[27][28] V hipokampus, dendritická páteř morfologie mohou být regulovány astrocyty prostřednictvím obousměrné signalizace ephrin / EphA.[29] Astrocyty a jejich procesy se vyjadřují ephrin A3 zatímco EphA4 receptor je obohacen o hipokampální neurony. Tato interakce zprostředkovaná signalizací ephrin A3 / EphA4 indukuje nábor a aktivaci cyklin-dependentní kináza 5 (Cdk5), který pak fosforyluje guaninový směnný faktor (GEF), ephexin1.[30] Fosforylovaný ephexin1 pak může aktivovat malý GTPáza, RhoA, což vede k následné aktivaci jeho efektoru, Rho-kináza (ROCK), což má za následek přeskupení aktinových vláken.[30] Prostřednictvím tohoto mechanismu jsou astrocytární procesy schopné stabilizovat jednotlivé dendritické výčnělky a také jejich zrání do trnů prostřednictvím signalizace ephrin / EphA. Forward signalizace zahrnující aktivaci EphA4 má za následek stabilizaci synaptických proteinů na neuromuskulární spojení.[30] Stejně jako v interakci neuron-glia zprostředkovanou EphA4 / ephrinA3 reguluje tento proces dynamiku aktinového cytoskeletu aktivací ROCK prostřednictvím ephexinu.[30]
Signalizace Ephrin B / EphB se také podílí na synaptické stabilizaci různými mechanismy. Tyto molekuly obsahují cytoplazmatické ocasy, které prostřednictvím jejich interakcí reagují s bílkovinami lešení PDZ domény ke stabilizaci nově vytvořených synapsí CNS.[28] Například, Ephrin B3 interaguje s adaptorovým proteinem glutamát-receptor interagujícím proteinem 1 (GRIP-1) k regulaci vývoje excitačních dendritických hřídelí synapsí.[28] Tento proces, který byl identifikován v kulturách hipokampálních neuronů, odhalil, že reverzní signalizace Eph / ephrin B3 rekrutuje GRIP1 na membránu postsynaptické šachty.[31] Jakmile je GRIP1 na membránovém hřídeli, pomáhá ukotvit receptory glutamátu pod presynaptickým terminálem. Tento proces také zahrnuje fosforylaci serinového zbytku v blízkosti ephrin-B karboxylový konec (proximálně k motivu vázajícímu PDZ), který vede ke stabilizaci AMPA receptory na synapsích.[27]
Další mechanismus nalezený v hipokampálních neuronech odhalil, že signalizace EphB může podporovat zrání páteře modulací aktivity Rho GTPázy, jak je pozorováno u EphAs.[32] Na rozdíl od EphAs však EphB2 Ukázalo se, že receptor interaguje s postsynaptikem N-methyl-D-aspartátové receptory (NMDARs) k navázání GEF Tiam1 do komplexu po navázání ephrinB.[32][30][33] Fosforylace Tiam1 nastává v reakci na aktivitu NMDAR, což umožňuje příliv vápníku, který aktivuje Tiam1. Tento mechanismus také vede k modulaci aktinového cytoskeletu. V důsledku této stabilizace bylo zjištěno, že jak dopředná signalizace EphB2, tak reverzní signalizace ephrin-B3 indukují LTP prostřednictvím NMDAR.[34]
Reference
- ^ Rutishauser U, Jessell TM (červenec 1988). "Molekuly buněčné adheze v nervovém vývoji obratlovců". Fyziologické recenze. 68 (3): 819–57. doi:10.1152 / fyzrev.1988.68.3.819. PMID 3293093.
- ^ „Gerald M. Edelman životopis“. Nobelprize.org. Citováno 13. března 2018.
- ^ Benson DL, Schnapp LM, Shapiro L, Huntley GW (listopad 2000). „Vytváření vzpomínek: molekuly adheze buněk v synaptické plasticitě“. Trendy v buněčné biologii. 10 (11): 473–82. doi:10.1016 / S0962-8924 (00) 01838-9. PMID 11050419.
- ^ Bukalo, Olena; Dityatev, Alexander (27. prosince 2012). Synaptický vývoj dynamiky plasticity a nemoci. Pokroky v experimentální medicíně a biologii. 970. Vídeň: Springer, Vídeň. 97–128. doi:10.1007/978-3-7091-0932-8_5. ISBN 978-3-7091-0932-8. PMID 22351053.
- ^ Biederer, Thomas; Missler, Markus; Südhof, Thomas. "Synaptická buněčná adheze". Perspektivy přístavu Cold Springs v biologii. Cold Spring Harbor Laboratory Press. Citováno 12. března 2018.
- ^ Washbourne, Philip; Dityatev, Alexander; Scheiffele, Peter; Biederer, Thomas; Weiner, Joshua A .; Christopherson, Karen S .; El-Husseini, Alaa (20. října 2004). "Molekuly buněčné adheze ve formaci Synapse". Journal of Neuroscience. 24 (42): 9244–9249. doi:10.1523 / JNEUROSCI.3339-04.2004. PMC 6730099. PMID 15496659.
- ^ Dalva, Matthew; McClelland, Andrew; Kayser, Matthew (14. února 2007). "Molekuly buněčné adheze: signalizační funkce v synapse". Příroda. 8 (3): 206–220. doi:10.1038 / nrn2075. PMC 4756920. PMID 17299456.
- ^ A b Bamji SX (červenec 2005). "Kadheriny: aktin s cytoskeletem za vzniku synapsí". Neuron. 47 (2): 175–8. doi:10.1016 / j.neuron.2005.06.024. PMID 16039559.
- ^ A b C d E F G Arikkath J, Reichardt LF (září 2008). „Kadheriny a kateniny na synapsích: role v synaptogenezi a synaptické plasticitě“. Trendy v neurovědách. 31 (9): 487–94. doi:10.1016 / j.tins.2008.07.001. PMC 2623250. PMID 18684518.
- ^ A b Seong E, Yuan L, Arikkath J (duben 2015). „Kadheriny a kateniny v morfogenezi dendritů a synapsí“. Buněčná adheze a migrace. 9 (3): 202–13. doi:10.4161/19336918.2014.994919. PMC 4594442. PMID 25914083.
- ^ A b Whalley K (říjen 2015). „Neurální vývoj: komplexní soutěž o trny“. Recenze přírody. Neurovědy. 16 (10): 577. doi:10.1038 / nrn4024. PMID 26307326.
- ^ A b Bian WJ, Miao WY, He SJ, Qiu Z, Yu X (srpen 2015). „Koordinované prořezávání a zrání páteře zprostředkované soutěží mezi páteři o komplexy kadherin / katenin“. Buňka. 162 (4): 808–22. doi:10.1016 / j.cell.2015.07.018. PMID 26255771.
- ^ Sanes D (25. ledna 2011). Vývoj nervového systému (3. vyd.). Elsevier. ISBN 978-0-08-092320-8.
- ^ A b Irie K, Shimizu K, Sakisaka T, Ikeda W, Takai Y (prosinec 2004). "Role a způsoby působení nektinů při adhezi mezi buňkami". Semináře z buněčné a vývojové biologie. 15 (6): 643–56. doi:10.1016 / s1084-9521 (04) 00088-6. PMID 15561584.
- ^ Rikitake Y, Mandai K, Takai Y (srpen 2012). „Role nektinů v různých typech adheze mezi buňkami“. Journal of Cell Science. 125 (Pt 16): 3713–22. doi:10.1242 / jcs.099572. PMID 23027581.
- ^ Takai Y, Shimizu K, Ohtsuka T (říjen 2003). "Role kadherinů a nektinů při tvorbě interneuronální synapsy". Aktuální názor v neurobiologii. 13 (5): 520–6. doi:10.1016 / j.conb.2003.09.003. PMID 14630213.
- ^ Craig AM, Kang Y (únor 2007). „Neurexin-neuroliginová signalizace ve vývoji synapsí“. Aktuální názor v neurobiologii. 17 (1): 43–52. doi:10.1016 / j.conb.2007.01.011. PMC 2820508. PMID 17275284.
- ^ Dean C, Dresbach T (leden 2006). "Neuroliginy a neurexiny: spojování buněčné adheze, tvorba synapsí a kognitivní funkce". Trendy v neurovědách. 29 (1): 21–9. doi:10.1016 / j.tins.2005.11.003. PMID 16337696.
- ^ Nam CI, Chen L (duben 2005). „Postsynaptické shromáždění vyvolané interakcí neurexin-neuroligin a neurotransmiterem“. Sborník Národní akademie věd Spojených států amerických. 102 (17): 6137–42. Bibcode:2005PNAS..102,6137N. doi:10.1073 / pnas.0502038102. PMC 1087954. PMID 15837930.
- ^ Brady ST, Siegel GJ, Albers RW, Price DL (2012). Základní neurochemie: principy molekulární, buněčné a lékařské neurobiologie (Osmá ed.). Waltham, Massachusetts. ISBN 978-0-12-374947-5. OCLC 754167839.
- ^ A b Missler M, Südhof TC, Biederer T (duben 2012). "Synaptická buněčná adheze". Perspektivy Cold Spring Harbor v biologii. 4 (4): a005694. doi:10.1101 / cshperspect.a005694. PMC 3312681. PMID 22278667.
- ^ Hortsch M (2009). „Krátká historie synapse - Golgi versus Ramón y Cajal“. V Hortsch M, Umemori H (eds.). Lepkavá synapse. Springer, New York, NY. s. 1–9. doi:10.1007/978-0-387-92708-4_1. ISBN 978-0-387-92707-7.
- ^ A b Missler M, Zhang W, Rohlmann A, Kattenstroth G, Hammer RE, Gottmann K, Südhof TC (červen 2003). „Alfa-neurexiny spojují kanály Ca2 + s exocytózou synaptických vezikul“. Příroda. 423 (6943): 939–48. Bibcode:2003 Natur.423..939M. doi:10.1038 / nature01755. PMID 12827191.
- ^ A b Squire LR (2009). Encyklopedie neurovědy. Amsterdam: Academic Press. ISBN 978-0-08-096393-8. OCLC 503584095.
- ^ Zhang C, Atasoy D, Araç D, Yang X, Fucillo MV, Robison AJ, Ko J, Brunger AT, Südhof TC (květen 2010). „Neurexiny fyzicky a funkčně interagují s receptory GABA (A)“. Neuron. 66 (3): 403–16. doi:10.1016 / j.neuron.2010.04.008. PMC 3243752. PMID 20471353.
- ^ Hata Y, Davletov B, Petrenko AG, Jahn R, Südhof TC (únor 1993). "Interakce synaptotagminu s cytoplazmatickými doménami neurexinů". Neuron. 10 (2): 307–15. doi:10.1016 / 0896-6273 (93) 90320-Q. PMID 8439414.
- ^ A b Lisabeth EM, Falivelli G, Pasquale EB (září 2013). "Signalizace Eph receptoru a efriny". Perspektivy Cold Spring Harbor v biologii. 5 (9): a009159. doi:10.1101 / cshperspect.a009159. PMC 3753714. PMID 24003208.
- ^ A b C Bianchi L (2018). Vývojová neurobiologie. New York, NY: Garland Science. 299–302. ISBN 9780815344827.
- ^ Bolton MM, Eroglu C (říjen 2009). "Podívej, kdo tká neurální síť: gliové ovládání tvorby synapsí". Aktuální názor v neurobiologii. 19 (5): 491–7. doi:10.1016 / j.conb.2009.09.007. PMID 19879129.
- ^ A b C d E Rubenstein J (květen 2013). Buněčná migrace a formování neuronových spojení: komplexní vývojová neurověda. San Diego, CA: Elsevier Science & Technology. str. 659–669. ISBN 978-0-12-397266-8.
- ^ Flannery DB (září 1988). "Nedisjunkce u Downova syndromu". American Journal of Medical Genetics. 31 (1): 181–2. doi:10,1002 / ajmg.1320310123. PMID 2975924.
- ^ A b Lerner AM (říjen 1990). „Virová myokarditida jako náhodný objev“. Nemocniční praxe. 25 (10): 81–4, 87–90. doi:10.1016 / j.brainres.2006.11.033. PMC 2170431. PMID 2170431.
- ^ Arvanitis D, Davy A (únor 2008). "Signalizace Eph / Ephrin: sítě". Geny a vývoj. 22 (4): 416–29. doi:10.1101 / gad.1630408. PMC 2731651. PMID 18281458.
- ^ Lundgren A, Tibbling L, Henriksson NG (březen 2018). „Posun nystagmusového rytmu stanovený stejnosměrným proudem v rotačních testech“. Praxe Oto-Rhino-Laryngologica. 31 (1): 54–64. doi:10,3892 / etm.2018.5702. PMID 5795627.
