Neurální obvod - Neural circuit - Wikipedia

A neurální obvod je populace neurony propojeny synapse provést určitou funkci, když je aktivována.[1] Neuronové obvody se navzájem propojují a tvoří rozsáhlé mozkové sítě.[2] Biologický neuronové sítě inspirovali design umělé neuronové sítě, ale umělé neuronové sítě obvykle nejsou přísnými kopiemi jejich biologických protějšků.
Včasné studium
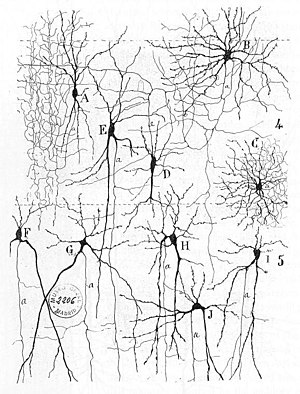
Včasná léčba neurální sítí najdete v Herbert Spencer je Principy psychologie, 3. vydání (1872), Theodor Meynert je Psychiatrie (1884), William James ' Zásady Psychologie (1890) a Sigmund Freud Projekt vědecké psychologie (složený v roce 1895).[3] První pravidlo neuronálního učení popsal Hebb v roce 1949, v Hebbian theory. Hebbovské párování předsynaptické a postsynaptické aktivity tedy může podstatně změnit dynamické charakteristiky synaptického spojení, a proto buď usnadnit nebo inhibovat přenos signálu. V roce 1959 neurovědy, Warren Sturgis McCulloch a Walter Pitts publikoval první práce o zpracování neuronových sítí.[4] Teoreticky ukázali, že sítě umělých neuronů mohou nářadí logický, aritmetický, a symbolický funkce. Zjednodušený modely biologických neuronů byly zřízeny, nyní obvykle volané perceptrony nebo umělé neurony. Tyto jednoduché modely odpovídaly neurální součet (tj. potenciály na postsynaptické membráně budou součet v buněčné tělo ). Pozdější modely také poskytovaly excitační a inhibiční synaptický přenos.
Spojení mezi neurony
Spojení mezi neurony v mozku jsou mnohem složitější než spojení neuronů v mozku umělé neurony použitý v spojovací pracovník neurální výpočetní modely umělé neuronové sítě. Základní druhy spojení mezi neurony jsou synapse: oba chemikálie a elektrické synapse.
Zřízení synapsí umožňuje spojení neuronů do milionů překrývajících se a propojujících neurálních obvodů. Nazývají se presynaptické proteiny neurexiny jsou v tomto procesu ústřední.[5]
Jeden princip, podle kterého fungují neurony, je neurální součet – potenciály na postsynaptická membrána se shrne v těle buňky. Pokud depolarizace neuronu na Axon Hillock překročí prahovou hodnotu, dojde k akčnímu potenciálu, který cestuje dolů axon do koncových zakončení k přenosu signálu do dalších neuronů. Excitační a inhibiční synaptický přenos je realizován většinou pomocí excitační postsynaptické potenciály (EPSP) a inhibiční postsynaptické potenciály (IPSP).
Na elektrofyziologické úrovni existují různé jevy, které mění charakteristiky odezvy jednotlivých synapsí (tzv synaptická plasticita ) a jednotlivé neurony (vnitřní plasticita ). Často se dělí na krátkodobou plasticitu a dlouhodobou plasticitu. Nejpravděpodobnější je často považována dlouhodobá synaptická plasticita Paměť Podklad. Výraz „neuroplasticity „označuje změny v mozku, které jsou způsobeny aktivitou nebo zkušeností.
Spojení zobrazují časové a prostorové charakteristiky. Časové charakteristiky se týkají kontinuálně modifikované účinnosti synaptického přenosu závislé na aktivitě, tzv plasticita závislá na časování špiček. V několika studiích bylo pozorováno, že synaptická účinnost tohoto přenosu může krátkodobě vzrůst (tzv usnadnění ) nebo snížit (Deprese ) podle aktivity presynaptického neuronu. Indukce dlouhodobých změn synaptické účinnosti do dlouhodobé potenciace (LTP) nebo Deprese (LTD), silně závisí na relativním načasování nástupu excitační postsynaptický potenciál a postsynaptický akční potenciál. LTP je indukován řadou akčních potenciálů, které způsobují různé biochemické reakce. Reakce nakonec způsobí expresi nových receptorů na buněčných membránách postsynaptických neuronů nebo zvýší účinnost stávajících receptorů prostřednictvím fosforylace.
Zpětné šíření akčních potenciálů nemůže nastat, protože poté, co akční potenciál cestuje dolů po daném segmentu axonu, se m brány na napěťově řízené sodíkové kanály zavřít, a tím zablokovat přechodné otevření h brána způsobení změny v intracelulárním iontu sodíku (Na+) koncentrace a prevence tvorby akčního potenciálu zpět k tělu buňky. V některých buňkách však neurální backpropagation dochází prostřednictvím dendritické větvení a může mít důležité účinky na synaptickou plasticitu a výpočet.
Neuron v mozku vyžaduje jediný signál k neuromuskulární spojení stimulovat kontrakci postsynaptické svalové buňky. V míše však nejméně 75 aferentní neurony jsou povinny produkovat střelbu. Tento obraz je dále komplikován změnami v časové konstantě mezi neurony, protože některé buňky mohou zažít své EPSP v širším časovém období než ostatní.
Zatímco v synapsích v vývoj mozku synaptická deprese byla obzvláště široce pozorována, spekulovalo se, že se změní na usnadnění u dospělých mozků.
Obvody
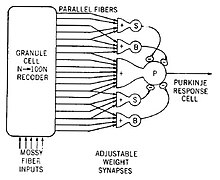
Příkladem neurálního obvodu je trisynaptický obvod v hipokampus. Další je Papezův obvod spojující hypotalamus do limbický lalok. Existuje několik neurálních obvodů v kortiko-bazální ganglia-thalamo-kortikální smyčka. Tyto obvody přenášejí informace mezi kůrou, bazální ganglia, thalamus a zpět do kůry. Největší struktura v bazálních gangliích, striatum, je považováno za zařízení s vlastní vnitřní mikroobvodem.[6]
Neuronové obvody v mícha volala centrální generátory vzorů jsou zodpovědní za řízení motorických pokynů zapojených do rytmického chování. Rytmické chování zahrnuje chůzi, močení, a ejakulace. Centrální generátory vzorů jsou tvořeny různými skupinami spinální interneurony.[7]
Existují čtyři hlavní typy neurálních obvodů, které jsou zodpovědné za širokou škálu neurálních funkcí. Tyto obvody jsou a rozbíhající se obvod, a konvergující obvod, a dozvukový obvoda paralelní obvod po vybití.[8]
V rozbíhajícím se obvodu jeden neuron synapzuje s řadou postsynaptických buněk. Každá z nich může být synapse s mnoha dalšími, což umožňuje jednomu neuronu stimulovat až tisíce buněk. Příkladem toho je způsob, jakým lze stimulovat tisíce svalových vláken z počátečního vstupu z jediného motorický neuron.[8]
V konvergenčním obvodu jsou vstupy z mnoha zdrojů konvergovány do jednoho výstupu, což ovlivňuje pouze jeden neuron nebo neuronovou skupinu. Příkladem tohoto typu obvodu je dýchací centrum z mozkový kmen, který reaguje na řadu vstupů z různých zdrojů vydáním vhodného dýchacího vzorce.[8]
Dozvukový obvod vytváří opakovaný výstup. V signální proceduře z jednoho neuronu do druhého v lineární sekvenci může jeden z neuronů poslat signál zpět k iniciaci neuronu. Pokaždé, když první neuron vystřelí, druhý neuron dále dolů sekvence vystřelí znovu a pošle jej zpět ke zdroji . To restimuluje první neuron a také umožňuje, aby cesta přenosu pokračovala na svůj výstup. Výsledný opakující se vzor je výsledek, který se zastaví pouze v případě, že selže jedna nebo více synapsí, nebo pokud způsobí zastavení inhibiční zdroj z jiného zdroje. Tento typ dozvukového obvodu se nachází v dýchacím centru, které vysílá signály do dýchací svaly způsobující vdechování. Když je obvod přerušen inhibičním signálem, svaly se uvolní a způsobí výdech. Tento typ obvodu může hrát roli epileptické záchvaty.[8]
V paralelním obvodu po výboji vstupuje neuron do několika řetězců neuronů. Každý řetězec je tvořen jiným počtem neuronů, ale jejich signály konvergují do jednoho výstupního neuronu. Každá synapse v obvodu působí tak, že zpožďuje signál přibližně o 0,5 ms, takže čím více synapsí bude, tím delší zpoždění bude mít výstupní neuron. Po zastavení vstupu se výstup po určitou dobu spustí. Tento typ obvodu nemá zpětnou vazbu, stejně jako dozvukový obvod. Je vyvoláno pokračování střelby po zastavení stimulu po vybití. Tento typ obvodu se nachází v reflexní oblouky jisté reflexy.[8]
Studijní metody
Odlišný neuroimaging byly vyvinuty techniky pro zkoumání aktivity neurálních obvodů a sítí. Používání „mozkových skenerů“ nebo funkčního neuroimagingu ke zkoumání struktury nebo funkce mozku je běžné, buď jako jednoduše způsob lepšího hodnocení poranění mozku pomocí obrázků s vysokým rozlišením, nebo zkoumáním relativních aktivací různých oblastí mozku. Tyto technologie mohou zahrnovat funkční magnetická rezonance (fMRI), mozková pozitronová emisní tomografie (mozek PET) a počítačová axiální tomografie (CAT) skenuje. Funkční neuroimaging používá specifické technologie zobrazování mozku k pořizování skenů z mozku, obvykle když člověk dělá konkrétní úkol, ve snaze pochopit, jak aktivace konkrétních oblastí mozku souvisí s úkolem. Ve funkčním neuroimagingu, zejména fMRI, který měří hemodynamická aktivita (použitím Tučně kontrastní zobrazování ) který úzce souvisí s nervovou aktivitou, PET a elektroencefalografie Používá se (EEG).
Konekcionista modely slouží jako testovací platforma pro různé hypotézy reprezentace, zpracování informací a přenosu signálu. Studie lézí v takových modelech, např. umělé neuronové sítě, kde jsou části uzlů záměrně zničeny, aby se zjistilo, jak síť funguje, může také přinést důležité informace o fungování několika sestav buněk. Podobně simulace dysfunkčních neurotransmiterů v neurologických podmínkách (např. Dopamin v bazálních gangliích Parkinsonova choroba pacienti) mohou poskytnout vhled do základních mechanismů pro vzorce kognitivních deficitů pozorovaných u konkrétní skupiny pacientů. Předpovědi z těchto modelů lze testovat na pacientech nebo pomocí farmakologických manipulací a tyto studie lze zase použít k informování modelů, čímž je proces iterativní.
Moderní rovnováha mezi konekcionistickým přístupem a jednobuněčným přístupem neurobiologie bylo dosaženo prostřednictvím dlouhé diskuse. V roce 1972 Barlow oznámil jediná neuronová revoluce: „naše vnímání je způsobeno aktivitou poměrně malého počtu neuronů vybraných z velmi velké populace převážně tichých buněk.“[9] Tento přístup byl stimulován myšlenkou buňka babičky předloženo o dva roky dříve. Barlow formuloval „pět dogmat“ neuronové doktríny. Nedávné studiebuňka babičky „a řídké jevy kódování tyto myšlenky rozvíjejí a upravují.[10] Jednobuněčné experimenty používaly intrakraniální elektrody ve středním temporálním laloku (hipokampu a okolní kůře). Moderní vývoj koncentrace opatření teorie (věty o stochastické separaci) s aplikacemi na umělé neuronové sítě dát matematické pozadí neočekávané účinnosti malých nervových souborů ve vysokodimenzionálním mozku.[11]
Klinický význam
Někdy mohou být nervové obvody patologické a způsobit problémy jako např Parkinsonova choroba když bazální ganglia jsou zapojeny.[12] Problémy v Papezův obvod může také vést k řadě neurodegenerativní poruchy včetně Parkinsonovy choroby.
Viz také
- Zpětná vazba
- Seznam oblastí v lidském mozku
- Síťová věda
- Neurální kódování
- Neurální inženýrství
- Neurální oscilace
- Impulsně vázané sítě
- Systémová neurověda
Reference
- ^ Purves, Dale (2011). Neurovědy (5. vydání). Sunderland, Massachusetts: Sinauer. p. 507. ISBN 9780878936953.
- ^ "Neurální obvody | Centrum excelence pro integrační funkci mozku". Centrum excelence pro integrační funkci mozku. 13. června 2016. Citováno 4. června 2018.
- ^ Michael S. C. Thomas; James L. McClelland. „Spojovací modely poznání“ (PDF). Stanfordská Univerzita. Archivovány od originál (PDF) dne 06.09.2015. Citováno 2015-08-31.
- ^ J. Y. Lettvin; H. R. Maturana; W. S. McCulloch; W. H. Pitts (1959), „Co říká žabí oko mozku žáby.“, Proc. Inst. Radio Engr. (47), s. 1940–1951
- ^ Südhof, TC (2. listopadu 2017). „Synaptické komplexy neurexinu: molekulární kód pro logiku neurálních obvodů“. Buňka. 171 (4): 745–769. doi:10.1016 / j.cell.2017.10.024. PMC 5694349. PMID 29100073.
- ^ Stocco, Andrea; Lebiere, Christian; Anderson, John R. (2010). „Podmíněné směrování informací do mozkové kůry: model role bazální ganglie v kognitivní koordinaci“. Psychologický přehled. 117 (2): 541–74. doi:10.1037 / a0019077. PMC 3064519. PMID 20438237.
- ^ Guertin, PA (2012). „Centrální generátor vzorů pro pohyb: anatomické, fyziologické a patofyziologické aspekty“. Hranice v neurologii. 3: 183. doi:10.3389 / fneur.2012.00183. PMC 3567435. PMID 23403923.
- ^ A b C d E Saladin, K. Anatomie člověka (3. vyd.). McGraw-Hill. p. 364. ISBN 9780071222075.
- ^ Barlow, HB (1. prosince 1972). „Jednotlivé jednotky a senzace: neuronová doktrína pro percepční psychologii?“. Vnímání. 1 (4): 371–394. doi:10.1068 / p010371. PMID 4377168.
- ^ Quian Quiroga, R; Reddy, L; Kreiman, G; Koch, C; Fried, I (23. června 2005). "Invariantní vizuální znázornění jednotlivými neurony v lidském mozku". Příroda. 435 (7045): 1102–1107. doi:10.1038 / nature03687. PMID 15973409.
- ^ Gorban, Alexander N .; Makarov, Valeri A .; Tyukin, Ivan Y. (červenec 2019). „Nepřiměřená účinnost malých nervových souborů ve vysokodimenzionálním mozku“. Recenze fyziky života. 29: 55–88. arXiv:1809.07656. doi:10.1016 / j.plrev.2018.09.005. PMID 30366739.
- ^ Francouzština, IT; Muthusamy, KA (2018). „Přehled jádra pedunkulopontinu u Parkinsonovy nemoci“. Frontiers in Aging Neuroscience. 10: 99. doi:10.3389 / fnagi.2018.00099. PMC 5933166. PMID 29755338.
Další čtení
- Vnitřní plasticita Robert H. Cudmore, Niraj S. Desai Scholarpedia 3(2):1363. doi: 10,4249 / scholarpedia.1363
externí odkazy
- Srovnání neuronových sítí v mozku a umělých neuronových sítí
- Poznámky k přednášce na MIT OpenCourseWare
- Výpočet v mozku
- Sada nástrojů pro biologickou neurální síť - Zdarma sada nástrojů Matlab pro simulaci sítí několika různých typů neuronů
- WormWeb.org: Interaktivní vizualizace neuronové sítě C. elegans - C. elegans, nematoda s 302 neurony, je jediným organismem, pro který byla odkryta celá neurální síť. Tato stránka slouží k procházení sítí ak hledání cest mezi libovolnými 2 neurony.
- Úvod do neuronů a neuronových sítí, Neurovědy online (elektronická učebnice neurovědy)
- Zpoždění pulsních sítí (vlnové interferenční sítě)
