Syndrom rakoviny - Cancer syndrome

A syndrom rakovinynebo syndrom rodinné rakoviny, je genetická porucha, při které se dědí genetické mutace v jednom nebo více geny předisponují postižené jedince ke vzniku rakoviny a mohou také způsobit jejich časný nástup. Rakovinové syndromy často vykazují nejen vysokou hladinu celoživotní riziko vzniku rakoviny, ale také vývoje několika nezávislých primárních nádorů.[1]
Mnoho z těchto syndromů je způsobeno mutacemi v geny potlačující nádory geny, které se podílejí na ochraně buňky před rakovinou. Jiné geny, které mohou být ovlivněny, jsou Oprava DNA geny, onkogeny a geny podílející se na tvorbě krevních cév (angiogeneze ).[2] Běžnými příklady zděděných rakovinových syndromů jsou syndrom dědičné rakoviny prsu a vaječníků a dědičná nepolypózní rakovina tlustého střeva (Lynchův syndrom).[3][4]
Pozadí
Syndromy dědičné rakoviny jsou základem 5 až 10% všech typů rakoviny a existuje více než 50 identifikovatelných dědičných forem rakoviny.[5] Vědecké chápání syndromů náchylnosti k rakovině se aktivně rozšiřuje: nacházejí se další syndromy,[6] základní biologie se stává jasnější a komercializace metodologie diagnostické genetiky zlepšuje klinický přístup.[Citace je zapotřebí ] Vzhledem k prevalenci rakoviny prsu a tlustého střeva patří mezi nejznámější syndromy syndrom dědičné rakoviny prsu a vaječníků a dědičná nepolypózní rakovina tlustého střeva (Lynchův syndrom).[6]
Některé vzácné druhy rakoviny jsou silně spojeny se syndromem dědičné predispozice k rakovině. Genetické testování by mělo být zváženo s adrenokortikální karcinom; karcinoidní nádory; šířit rakovina žaludku; vejcovod / primární peritoneální rakovina; leiomyosarkom; medulární rakovina štítné žlázy; paraganglioma / feochromocytom; renální buněčný karcinom chromofobu, hybridní onkocytární nebo onkocytom histologie; mazový karcinom; a nádory pohlavních kordů s prstencovými tubuly.[6] Lékaři primární péče dokáže identifikovat lidi, kterým hrozí syndrom dědičného rakoviny.[7]
Genetika rakoviny
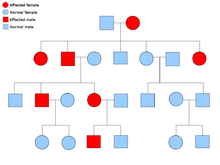
Dvě kopie každého genu jsou přítomny ve všech buňkách těla a každé z nich se říká an alela. Většina rakovinových syndromů se přenáší v a Mendelian autosomálně dominantní způsob. V těchto případech musí být přítomna pouze jedna vadná alela, aby jedinec měl predispozici k rakovině. Jedinci s jednou normální alelou a jednou vadnou alelou jsou známí jako heterozygotní. Heterozygotní jedinec a osoba se dvěma normálními alelami (homozygotní ) bude mít 50% šanci na produkci postiženého dítěte.[8] Mutace v zděděném genu je známá jako a zárodečná mutace a další mutace v normální alele vede k rozvoji rakoviny. Toto je známé jako Knudsonova hypotéza se dvěma zásahy, kde první zásah genu je zděděná mutace a druhý zásah nastane později v životě.[2] Protože je potřeba mutovat pouze jednu alelu (ve srovnání s oběma u tzv. „Sporadických rakovin“), má jedinec vyšší šanci na rozvoj rakoviny než obecná populace.[Citace je zapotřebí ]
Méně často mohou být syndromy přenášeny jako autozomálně recesivní vlastnost. Obě alely genu musí být mutovány u autozomálně recesivních poruch, aby měl jedinec predispozici k rakovině. Osoba se dvěma recesivními alelami je známá jako homozygotní recesivní. Aby bylo dítě homozygotně recesivní, musí mít oba rodiče alespoň jednu vadnou alelu. Pokud oba rodiče mají jednu mutovanou alelu a jednu normální alelu (heterozygotní ) pak mají 25% šanci na produkci homozygotního recesivního dítěte (má predispozici), 50% šanci na produkci heterozygotního dítěte (nositele vadného genu) a 25% šanci na produkci dítěte se dvěma normálními alelami.[8]
Příklady syndromů autosomálně dominantní rakoviny jsou autoimunitní lymfoproliferativní syndrom (Canale-Smithův syndrom), Beckwith – Wiedemannův syndrom (ačkoli 85% případů je sporadických),[Citace je zapotřebí ] Birt – Hogg – Dubého syndrom, Carneyho syndrom, familiární chordoma, Cowdenův syndrom, syndrom dysplastického nevusu s familiárním melanomem, familiární adenomatózní polypóza, syndrom dědičné rakoviny prsu a vaječníků, dědičné rozptýlené rakovina žaludku (HDGC), Dědičná nepolypóza kolorektálního karcinomu (Lynchův syndrom), Howel – Evansův syndrom rakoviny jícnu s tylózou, syndrom juvenilní polypózy, Li – Fraumeniho syndrom, mnohočetná endokrinní neoplazie typ 1/2, mnohočetná osteochondromatóza, neurofibromatóza typ 1/2, syndrom nevoidního bazocelulárního karcinomu (Gorlinův syndrom), Peutz – Jeghersův syndrom, familiární rakovina prostaty dědičná leiomyomatóza rakovina ledvinových buněk (LRCC), dědičná papilární rakovina ledvinových buněk, dědičné paraganglioma syndrom feochromocytomu, retinoblastom, tuberózní skleróza, von Hippel – Lindauova choroba a Wilmův nádor.[9]
Příklady syndromů autozomálně recesivní rakoviny jsou ataxie – telangiektázie, Bloomův syndrom, Fanconiho anémie, Polypóza spojená s MUTYH, Rothmund – Thomsonův syndrom, Wernerův syndrom a Xeroderma pigmentosum.[9]
Příklady
Ačkoli rakovinové syndromy vykazují zvýšené riziko rakoviny, riziko se liší. U některých z těchto onemocnění není rakovina jejich primárním rysem. Diskuse se zde zaměřuje na jejich souvislost se zvýšeným rizikem rakoviny. Tento seznam není zdaleka vyčerpávající.
Fanconiho anémie
Fanconiho anémie je porucha se širokým klinickým spektrem, včetně: časného nástupu a zvýšeného rizika rakoviny; selhání kostní dřeně; a vrozené abnormality. Nejvýznamnějšími projevy této poruchy jsou projevy související s krvetvorba (produkce krve kostní dřeň ); tyto zahrnují aplastická anémie, myelodysplastický syndrom a Akutní myeloidní leukémie. Jaterní nádory a spinocelulární karcinomy z jícen, orofaryngu a uvula jsou solidní nádory běžně spojené s FA. Vrozené vady zahrnují: anomálie skeletu (zejména ty, které postihují ruce), kavárny au lait a hypopigmentace. K dnešnímu dni geny, o nichž je známo, že způsobují FA, jsou: FANCA, FANCB, FANCC, FANCD2, FANCE, FANCF, FANCG, FANCI, FANCJ, FANCL, FANCM, FANCN, FANCO, FANCP a BRCA2 (dříve známý jako FANCD1). Dědičnost tohoto syndromu je primárně autozomálně recesivní, ale FANCB lze zdědit po mateřské nebo otcovské x-chromozom (x-vázaná recesivní dědičnost ). Cesta FA se podílí na opravě DNA, když jsou dva řetězce DNA nesprávně spojeny dohromady (mezivláknové křížové odkazy ). Mnoho cest je pro tento případ koordinováno cestou FA oprava nukleotidové excize, syntéza překladů a homologní rekombinace.[10][11][12][13][14]
Familiární adenomatózní polypóza
Familiární adenomatózní polypóza (FAP) je autosomálně dominantní syndrom, který výrazně zvyšuje riziko kolorektální karcinom. Asi 1 z 8 000 lidí bude mít toto onemocnění a má přibližně 100% pronikavost. Jedinec s tímto onemocněním bude mít stovky až tisíce benigní adenomy skrz jejich dvojtečka, která bude ve většině případů postupovat k rakovině. Mezi další nádory se zvýšenou frekvencí patří; osteomy, nadledvina adenomy a karcinomy, nádory štítné žlázy a desmoidní nádory. Příčinou této poruchy je mutovaný Gen APC, který je zapojen do β-katenin nařízení. Chybný APC způsobí, že se β-katenin hromadí v buňkách a aktivuje se transkripční faktory zahrnutý do něčeho, zůčastnit se čeho proliferace buněk, migrace, diferenciace a apoptóza (programovaná buněčná smrt).[15][16][17]
Dědičná rakovina prsu a vaječníků
Syndrom dědičné rakoviny prsu a vaječníků je autosomálně dominantní genetická porucha zapříčiněno genetické mutace z BRCA1 a BRCA2 geny. U žen tato porucha primárně zvyšuje riziko prsa a rakovina vaječníků, ale také zvyšuje riziko karcinom vejcovodu a papilární serózní karcinom pobřišnice. U mužů riziko rakovina prostaty se zvyšuje. Jiné druhy rakoviny, které jsou v rozporu s tímto syndromem, jsou rakovina slinivky, mužská rakovina prsu, kolorektální karcinom a rakoviny děloha a čípek. Genetické mutace tvoří přibližně 7% a 14% rakoviny prsu a vaječníků a BRCA1 a BRCA2 tvoří 80% těchto případů. BRCA1 a BRCA2 jsou oba geny potlačující nádory podílí se na udržování a opravě DNA, což vede k nestabilitě genomu. Mutace v těchto genech umožňují další poškození DNA, které může vést k rakovině.[18][19]
Dědičná rakovina tlustého střeva bez polypózy
Dědičná rakovina tlustého střeva bez polypózy, známý také jako Lynchův syndrom, je autosomálně dominantní syndrom rakoviny, který zvyšuje riziko kolorektálního karcinomu. Je to způsobeno genetickými mutacemi v Oprava nesouladu DNA (MMR), zejména MLH1, MSH2, MSH6 a PMS2. Kromě rakoviny tlustého střeva a konečníku je častější výskyt mnoha dalších druhů rakoviny. Tyto zahrnují; rakovina endometria, rakovina žaludku, rakovina vaječníků, rakoviny tenkého střeva a rakovina slinivky. Dědičná nepolypózní rakovina tlustého střeva je také spojena s časným nástupem kolorektálního karcinomu. Geny MMR se podílejí na opravě DNA, když základny na každém řetězci DNA se neshodují. Vadné geny MMR umožňují kontinuální vložení a vymazání mutace v oblastech DNA známé jako mikrosatelity. Tyto krátké opakující se sekvence DNA se stávají nestabilními, což vede ke stavu nestabilita mikrosatelitu (MSI). Mutované mikrosatelity se často nacházejí v genech zapojených do iniciace a progrese nádoru a MSI může zlepšit přežití buněk, což vede k rakovině.[4][20][21][22]
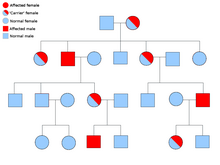
Syndrom dědičného paragangliomu-feochromocytomu
Většina případů familiárního paragangliomu je způsobena mutacemi v sukcinát dehydrogenáza (sukcinát: ubichinon oxidoreduktáza) podjednotkové geny (SDHD, SDHAF2, SDHC, SDHB ).
PGL-1 je spojen s mutací SDHD a většina jedinců s PGL-1 s paragangliomem ovlivnila spíše otce než postižené matky. PGL1 a PGL2 jsou autozomálně dominantní s potisk. PGL-4 je spojen s mutací SDHB a je spojen s vyšším rizikem feochromocytomu, stejně jako s rakovinou ledvinových buněk a nemedulární rakovinou štítné žlázy.[23]
Li-Fraumeniho syndrom
Li-Fraumeniho syndrom je autosomálně dominantní syndrom primárně způsobený mutace v Gen TP53, což výrazně zvyšuje riziko mnoha druhů rakoviny a je také vysoce spojeno s časným nástupem těchto druhů rakoviny. Rakoviny spojené s touto poruchou zahrnují; sarkomy měkkých tkání (často se vyskytuje v dětství), osteosarkom, rakovina prsu, rakovina mozku, leukémie a adrenokortikální karcinom. Jedinci s Li-Fraumeniho syndromem mají často několik nezávislých primárních rakovin. Důvodem pro velké klinické spektrum této poruchy mohou být jiné genové mutace, které tuto chorobu modifikují. Podílí se na proteinu produkovaném genem TP53, p53 zástava buněčného cyklu, Oprava DNA a apoptóza. Vadný p53 nemusí být schopen správně provádět tyto procesy, což může být příčinou vzniku nádoru. Protože pouze 60-80% jedinců s poruchou má detekovatelné mutace v TP53, mohou se na Li-Fraumeni syndromu podílet i další mutace v dráze p53.[24][25][26][27]
Polypóza spojená s MUTYH
Polypóza spojená s MUTYH sdílí většinu svých klinických rysů s FAP; rozdíl je v tom, že se jedná o autozomálně recesivní porucha způsobená mutacemi v MUTYH Oprava DNA gen. Nádory se zvýšeným rizikem této poruchy jsou kolorektální karcinom, žaludeční adenomy a duodenální adenomy.[15][28]

Syndrom bazocelulárního karcinomu Nevoid
Syndrom bazocelulárního karcinomu Nevoid, známý také jako Gorlinův syndrom, je autosomálně dominantní syndrom rakoviny, u kterého je riziko bazocelulární karcinom je velmi vysoká. Toto onemocnění je charakterizováno bazální buňka nevi, čelist keratocysty a kosterní abnormality. Odhady prevalence syndromu nevoidního bazocelulárního karcinomu se liší, ale jsou přibližně 1 z 60 000. Přítomnost bazocelulárního karcinomu je u bílých jedinců mnohem vyšší; 80%, respektive 38%. Odontogenní keratocysty se vyskytují přibližně u 75% jedinců s tímto onemocněním a často se vyskytují na začátku života. Nejběžnější kostní abnormality se vyskytují v hlavě a obličeji, ale často jsou ovlivněny i jiné oblasti, jako je hrudní koš. Příčinná souvislost genetická mutace této choroby se vyskytuje v Gen PTCH a produktem PTCH je a supresor nádoru zahrnutý do něčeho, zůčastnit se čeho buněčná signalizace. Ačkoli přesná role tohoto proteinu v syndromu nevoidních bazocelulárních karcinomů není známa, podílí se na ježková signální dráha, o kterém je známo, že ho ovládá růst buněk a rozvoj.[29][30]
Von Hippel – Lindauova choroba
Von Hippel – Lindauova choroba je vzácný, autozomálně dominantní genetický stav, který předurčuje jedince k benigním a maligním nádorům. Nejběžnějšími nádory u Von Hippel – Lindauovy choroby jsou centrální nervový systém a retinální hemangioblastomy, renální karcinomy jasných buněk, feochromocytomy, pankreatické neuroendokrinní tumory, pankreatické cysty, tumory endolymfatického vaku a epididymální papilární cystadenomy.[31][32] Von Hippel – Lindauova choroba je výsledkem mutace genu pro potlačování nádoru von Hippel – Lindau na chromozomu 3p25.3.[33]
Xeroderma pigmentosum
Xeroderma pigmentosum je autozomálně recesivní porucha charakterizovaná citlivostí na ultrafialové (UV) světlo, výrazně zvýšené riziko úžeh a zvýšené riziko rakoviny kůže. Riziko rakoviny kůže je více než 10 000krát vyšší než u normálních jedinců a zahrnuje mnoho typů rakoviny kůže, včetně melanom a nemelanomové rakoviny kůže. Také oblasti jazyka, rtů a očí vystavené slunci mají zvýšené riziko rakoviny. Xeroderma pigmentosum může být spojena s jinými vnitřními druhy rakoviny a benigními nádory.[Citace je zapotřebí ] Kromě rakoviny některé genetické mutace které způsobují xeroderma pigmentosum neurodegenerace. Xeroderma pigmentosum může být způsobena genetickými mutacemi v 8 genech, které produkují následující enzymy: XPA, XPB, XPC, XPD, XPE, XPF, XPG a Pol η. XPA-XPF jsou oprava nukleotidové excize enzymy, které opravují DNA poškozenou UV zářením a vadné proteiny, umožní hromadění mutací způsobených UV zářením. Pol η je a polymeráza, což je enzym podílející se na replikaci DNA. Existuje mnoho polymeráz, ale pol η je enzym, který replikuje DNA poškozenou UV zářením. Mutace v tomto genu vytvoří vadný pol η enzym, který nemůže replikovat DNA s poškozením UV zářením. Jednotlivci s mutacemi tohoto genu mají podmnožinu XP; Onemocnění variantou XP.[34][35]
Poruchy opravy DNA a zvýšené riziko rakoviny
Mnoho rakovinových syndromů je způsobeno zděděným poškozením v Oprava DNA schopnost.[Citace je zapotřebí ] Když zdědil mutace je přítomen v opravném genu DNA, opravný gen nebude buď exprimován, nebo exprimován v pozměněné formě. Pak bude pravděpodobně opravná funkce nedostatečná a v důsledku toho bude mít poškození DNA tendenci se hromadit. Takové poškození DNA může způsobit chyby během Syntéza DNA vedoucí k mutacím, z nichž některé mohou vést k rakovině. Mutace pro opravu zárodečné linie DNA, které zvyšují riziko rakoviny, jsou uvedeny v tabulce.
| Gen pro opravu DNA | Protein | Ovlivněné cesty opravy * | Rakoviny se zvýšeným rizikem |
|---|---|---|---|
| mutovaná ataxie telangiectasia | bankomat | Různé mutace v bankomat snížit HRR, SSA nebo NHEJ [36] | leukémie, lymfom, prsa [36][37] |
| Bloomův syndrom | BLM (helikáza ) | HRR [38] | leukémie, lymfom, tlusté střevo, prsa, kůže, plíce, zvukovod, jazyk, jícen, žaludek, mandle, hrtan, děloha [39] |
| rakovina prsu 1 a 2 | BRCA1 BRCA2 | HRR dvojitých zlomů pramenů a mezer dceřiných pramenů[40] | prsa, vaječníky [41] |
| Fanconiho anémie geny FANCA, B, C, D1, D2, E, F, G, I, J, L, M, N, O, P | FANCA atd. | HRR a TLS [42] | leukémie, jaterní nádory, solidní nádory v mnoha oblastech [43] |
| Dědičná nepolypóza kolorektálního karcinomu geny MSH2 MSH6 MLH1 PMS2 | MSH2 MSH6 MLH1 PMS2 | MMR [44] | kolorektální, endometriální, ovariainové, gastrointestinální trakt (žaludek a tenké střevo, pankreas, žlučové cesty), močové cesty, mozek (glioblastomy) a kůže (keratoakantomy a mazové adenomy) [45] |
| Li-Fraumeniho syndrom gen TP53 | P53 | Přímá role v HRR, BER, NER a působí při poškození DNA[46] pro tyto cesty a pro NHEJ a MMR [47] | sarkomy, rakoviny prsu, mozkové nádory a adrenokortikální karcinomy [48] |
| MRE11A | MRE11 | HRR a NHEJ [49] | prsa [50] |
| MUTYH | MUTYH glykosyláza | BER z A spárovaný s 8-oxo-dG [51] | rakoviny tlustého střeva, konečníku, dvanáctníku, vaječníků, močového měchýře a kůže [52] |
| Syndrom rozpadu Nijmegen | NBS (NBN) | NHEJ [53] | lymfoidní rakoviny [53] |
| NTHL1 | NTHL1 | BER pro Tg, FapyG, 5-hC, 5-hU v dsDNA[54] | Rakovina tlustého střeva, rakovina endometria, duodenální rakovina, bazocelulární karcinom[55] |
| RECQL4 | RECQ4 | Helicase pravděpodobně aktivní v HRR [56] | bazocelulární karcinom, spinocelulární karcinom, intraepidermální karcinom [57] |
| Wernerův syndrom gen WRN | Wernerův syndrom ATP-dependentní helikáza | HRR, NHEJ, dlouhý patch BER [58] | sarkom měkkých tkání, kolorektální karcinom, kůže, štítná žláza, slinivka břišní [59] |
| Xeroderma pigmentosum geny XPA, XPB, XPD, XPF, XPG | XPA XPB XPD XPF XPG | Přepis spojený NER opravuje přepsal řetězce transkripčně aktivních genů [60] | rakovina kůže (melanom a nemelanom) [60] |
| Xeroderma pigmentosum geny XPC, XPE (DDB2 ) | XPC, XPE | Globální genomický NER, opravuje poškození přepsané i nepřepisované DNA [61][62] | rakovina kůže (melanom a non-melanom) [61][62] |
| XPV (nazývané také polymeráza H) | DNA polymeráza eta (Pol η) | Překladová syntéza (TLS) [63] | rakoviny kůže (bazální buňky, dlaždicové buňky, melanom) [63] |
- Zkratky pro cesty opravy DNA jsou HRR homologní rekombinace oprava, SSA sub-cesta HRR, NHEJ nehomologní spojování konců, BER oprava základní excize, TLS syntéza překladů, NER oprava nukleotidové excize, MMR oprava nesouladu.
Genetický screening
Genetické testování lze použít k identifikaci mutované geny nebo chromozomy které procházejí generacemi. Lidé, kteří mají pozitivní test na přítomnost genetické mutace, nemusí být nutně odsouzeni k rozvoji rakoviny spojené s mutací, nicméně mají zvýšené riziko vzniku rakoviny ve srovnání s běžnou populací. Doporučuje se, aby lidé podstoupili genetický test, pokud jde o jejich rodinu zdravotní historie zahrnuje: Několik členů rodiny s rakovinou, někdo v jejich rodině, který dostal rakovinu ve zvláště mladém věku nebo tím, že byl součástí určité osoby etnická skupina.[64]

Proces genetického screeningu je jednoduchý, neinvazivní postup. Než však budou geny testovány na mutace, pacient obvykle musí jít k poskytovateli zdravotní péče a projít skrz jeden na jednoho konzultace, kde diskutují o osobní i rodinné anamnéze rakoviny. Lékař pak může posoudit pravděpodobnost, že pacient bude mít mutaci, a může je vést procesem, kterým je genetický screening.[65] Je důležité, aby tato konzultace proběhla, protože zajišťuje, že daná osoba dává informovaný souhlas se zapojením do genetického testování, je si vědoma a chápe kroky, výhody a omezení postupu a je lépe informována o důsledcích výsledků testů sluchu.[66] Test lze provést pomocí tělní tekutiny nebo buňky pacienta, to zahrnuje; krev (která je nejběžnější), sliny, plodová voda a dokonce i buňky z vnitřku úst byly získány z bukální výtěr. Tento materiál je poté odeslán do specializované genetické laboratoře, kde jej technici prozkoumají, výsledky testů jsou odeslány zpět poskytovateli zdravotní péče, který požadoval analýzu, a výsledky jsou prodiskutovány s pacientem.[64]
Přímé testování pro spotřebitele lze získat bez zdravotnického pracovníka, ale nedoporučuje se to, protože spotřebitel ztrácí příležitost diskutovat o svém rozhodnutí se vzdělaným odborníkem.[67] Podle National Library of Medicine v USA genetické testování v Americe stojí v cenovém rozpětí 100–2 000 $ v závislosti na typu a složitosti testu.[68]
Preventivní opatření
Genetické testování je důležité, protože pokud je test pozitivní, jsou si více vědomi svého osobního zdraví a zdraví nejbližších členů rodiny.[69] S pomocí a radami od lékaře mohou podniknout kroky ke snížení jejich zvýšeného rizika vzniku rakoviny prostřednictvím:
- Pravidelné cvičení
- Zdravá a vyvážená strava
- Udržení zdravé hmotnosti
- Nekouřit
- Zůstat v bezpečí pod sluneční paprsky [70]
Jako příklad lze uvést další formy preventivních opatření Dědičná rakovina prsu a vaječníků by bylo podstoupit operaci: A hysterektomie je odstranění všech nebo některých z děloha, zatímco a amputace prsu odstraňuje prsa (dvojitá mastektomie což znamená, že jsou odstraněna obě prsa), což jim může často přidat roky délka života.[71] Další preventivní opatření je pravidelné screening rakoviny a kontroly. Pokud osoba má Lynchův syndrom pak by měli mít pravidelný kolonoskopie ke zkoumání, zda nedochází ke změnám v buňkách lemujících střevní stěnu, bylo prokázáno, že pravidelné kontroly zvyšují průměrnou délku života osoby trpící Lynchovým syndromem v průměru o 7 let, protože včasná detekce znamená správné preventivní opatření a operaci lze vzít rychleji.[72] Pravidelné vyšetření prsů se také doporučuje ženám s diagnostikovanou BRCA mutace, a také to, že nedávné studie ukazují, že muži se zvýšeným rizikem rozvoje rakovina prostaty v důsledku BRCA mutací může snížit jejich riziko tím, že aspirin.[73] Aspirin je nesmírně přínosný při snižování prevalence rakoviny; musí však být užíván pravidelně po dobu nejméně pěti let, aby měl jakýkoli účinek.[74]
Prevalence genetických mutací u různých etnických skupin
Genetické mutace jsou často častější u určitých etnických skupin, je to proto, že rasa může sledovat jejich předky zpět do jednoho geografického umístění, mutované geny jsou poté předávány od předků dolů po generace, a proto jsou některá etnika náchylnější k mutacím, což zvyšuje jejich šance na rozvoj rakoviny [61]. Jak již bylo zmíněno výše, může to být užitečné, protože to může zdravotníkům pomoci posoudit riziko pacienta s mutací dříve, než podstoupí testování.[65] Wernerův syndrom má prevalenci 1 z 200 000 živě narozených v USA, ale postihuje jedince v Japonsku u 1 z 20 000 - 40 000 případů.[75]1 ze 40 Ashkenazi Židé mají mutaci BRCA, jedná se o obrovský kontrast oproti běžné populaci ve Spojených státech, kde je postižen 1 ze 400 lidí. Aškenázští Židé jsou vystaveni vysokému riziku vzniku dědičného karcinomu prsu a vaječníků a doporučuje se podstoupit jak genetické testování, aby se zjistilo, zda mají mutaci, a pravidelný screening na rakovinu.[76]
Reference
- ^ Allgayer, Heike; Redher, Helga; Fulda, Simone (2009). Dědičné nádory: Od genů ke klinickým důsledkům. Weinheim: Wiley-VCH. ISBN 9783527320288.
- ^ A b Hodgson S (leden 2008). „Mechanismy zděděné náchylnosti k rakovině“. J Zhejiang Univ Sci B. 9 (1): 1–4. doi:10.1631 / jzus.B073001. PMC 2170461. PMID 18196605.
- ^ Clark AS, Domchek SM (Duben 2011). "Klinická léčba dědičných syndromů rakoviny prsu". J. Neoplasie mléčné žlázy Biol. 16 (1): 17–25. doi:10.1007 / s10911-011-9200-x. PMID 21360002.
- ^ A b Lynch HT, Lynch PM, Lanspa SJ, Snyder CL, Lynch JF, Boland CR (červenec 2009). „Přehled Lynchova syndromu: historie, molekulární genetika, screening, diferenciální diagnostika a lékařsko-právní důsledky“. Clin. Genet. 76 (1): 1–18. doi:10.1111 / j.1399-0004.2009.01230.x. PMC 2846640. PMID 19659756.
- ^ "Genetika". Národní onkologický institut. 2015-04-22. Citováno 2018-02-20.
- ^ A b C Banky, KC; Moline, JJ; Marvin, ML; Newlin, AC; Vogel, KJ (březen 2013). „10 vzácných nádorů, které vyžadují doporučení genetiky“. Rodinná rakovina. 12 (1): 1–18. doi:10.1007 / s10689-012-9584-9. PMID 23377869.
- ^ Korde, Larissa A .; Gadalla, Shahinaz M. (02.05.2017). „Hodnocení rizika rakoviny u lékaře primární péče“. Primární péče. 36 (3): 471–488. doi:10.1016 / j.pop.2009.04.006. PMC 2713871. PMID 19616151.
- ^ A b Anderson, Cindy Lou; Carie A Braun (2007). Patofyziologie: funkční změny v lidském zdraví. Hagerstwon, MD: Lippincott Williams & Wilkins. ISBN 978-0-7817-6250-2.
- ^ A b Lindor NM, Greene MH (červenec 1998). „Stručná příručka rodinných syndromů proti rakovině. Program Mayo Familial Cancer Program“. Journal of the National Cancer Institute. 90 (14): 1039–71. doi:10.1093 / jnci / 90.14.1039. PMID 9672254.
- ^ Moldovan GL, D'Andrea AD (2009). „Jak dráha anémie fanconi chrání genom“. Annu. Genet. 43: 223–49. doi:10.1146 / annurev-genet-102108-134222. PMC 2830711. PMID 19686080.
- ^ Tischkowitz MD, Hodgson SV (leden 2003). "Fanconiho anémie". Journal of Medical Genetics. 40 (1): 1–10. doi:10,1136 / jmg.40.1.1. PMC 1735271. PMID 12525534.
- ^ Kee Y, D'Andrea AD (listopad 2012). "Molekulární patogeneze a klinické zvládnutí Fanconiho anémie". Journal of Clinical Investigation. 122 (11): 3799–806. doi:10.1172 / JCI58321. PMC 3484428. PMID 23114602.
- ^ Kottemann MC, Smogorzewska A (leden 2013). „Fanconiho anémie a oprava síťovacích vazeb DNA Watsona a Cricka“. Příroda. 493 (7432): 356–63. Bibcode:2013Natur.493..356K. doi:10.1038 / příroda11863. PMC 3700363. PMID 23325218.
- ^ Su X, Huang J (září 2011). „Cesta anémie Fanconi a oprava křížového propojení DNA mezi řetězci“. Proteinová buňka. 2 (9): 704–11. doi:10.1007 / s13238-011-1098-r. PMC 4875268. PMID 21948210.
- ^ A b Polovina E, Bercovich D, Rozen P (2009). „Familiární adenomatózní polypóza“. Orphanet J Rare Dis. 4: 22. doi:10.1186/1750-1172-4-22. PMC 2772987. PMID 19822006.
- ^ Galiatsatos P, Foulkes WD (únor 2006). "Familiární adenomatózní polypóza". American Journal of Gastroenterology. 101 (2): 385–98. PMID 16454848.
- ^ Macrae F, du Sart D, Nasioulas S (2009). "Familiární adenomatózní polypóza". Best Pract Res Clin Gastroenterol. 23 (2): 197–207. doi:10.1016 / j.bpg.2009.02.010. PMID 19414146.
- ^ Petrucelli N, Daly MB, Feldman GL (květen 2010). „Dědičná rakovina prsu a vaječníků způsobená mutacemi v BRCA1 a BRCA2“. Genet. Med. 12 (5): 245–59. doi:10.1097 / GIM.0b013e3181d38f2f. PMID 20216074.
- ^ Smith EC (2012). "Přehled syndromu dědičné rakoviny prsu a vaječníků". J Zdraví dámských porodních asistentek. 57 (6): 577–84. doi:10.1111 / j.1542-2011.2012.00199.x. PMID 23050669.
- ^ Drescher KM, Sharma P, Lynch HT (2010). „Současné hypotézy o tom, jak nestabilita mikrosatelitů vede k lepšímu přežití pacientů s Lynchovým syndromem“. Clin. Dev. Immunol. 2010: 1–13. doi:10.1155/2010/170432. PMC 2901607. PMID 20631828.
- ^ Kunkel TA, Erie DA (2005). "Oprava nesouladu DNA". Annu. Biochem. 74: 681–710. doi:10,1146 / annurev.biochem.74.082803.133243. PMID 15952900.
- ^ Kastrinos F, Syngal S (2011). „Zděděné syndromy kolorektálního karcinomu“. Cancer Journal. 17 (6): 405–15. doi:10.1097 / PPO.0b013e318237e408. PMC 3240819. PMID 22157284.
- ^ Neumann HP, Pawlu C, Peczkowska M, Bausch B, McWhinney SR, Muresan M, Buchta M, Franke G, Klisch J, Bley TA, Hoegerle S, Boedeker CC, Opocher G, Schipper J, Januszewicz A, Eng C (2004) . „Výrazné klinické rysy paragangliomových syndromů spojených s mutacemi genu SDHB a SDHD“. JAMA. 292 (8): 943–51. doi:10.1001 / jama.292.8.943. PMID 15328326.
- ^ Malkin D (duben 2011). "Li-fraumeni syndrom". Geny pro rakovinu. 2 (4): 475–84. doi:10.1177/1947601911413466. PMC 3135649. PMID 21779515.
- ^ Bakry, D (2013). P53 na klinice: Mutace zárodků TP53: Genetika Li-Fraumeniho syndromu. New York: Springer. 167–188. ISBN 978-1-4614-3676-8.
- ^ Birch JM (červenec 1994). "Familiární rakovinové syndromy a shluky". Britský lékařský bulletin. 50 (3): 624–39. doi:10.1093 / oxfordjournals.bmb.a072913. PMID 7987644.
- ^ Quesnel S, Malkin D (srpen 1997). "Genetická predispozice k rakovině a syndromům familiární rakoviny". Pediatr. Clin. North Am. 44 (4): 791–808. doi:10.1016 / s0031-3955 (05) 70530-7. PMID 9286285.
- ^ Sampson JR, Jones N (2009). "Polypóza spojená s MUTYH". Best Pract Res Clin Gastroenterol. 23 (2): 209–18. doi:10.1016 / j.bpg.2009.03.006. PMID 19414147.
- ^ Manfredi M, Vescovi P, Bonanini M, Porter S (březen 2004). „Nevoidní syndrom bazocelulárního karcinomu: přehled literatury“. International Journal of Oral and Maxillofacial Surgery. 33 (2): 117–24. doi:10.1054 / ijom.2003.0435. PMID 15050066.
- ^ Lo Muzio L (2008). „Nevoidní syndrom bazocelulárního karcinomu (Gorlinův syndrom)“. Orphanet Journal of Rare Diseases. 3: 32. doi:10.1186/1750-1172-3-32. PMC 2607262. PMID 19032739.
- ^ Richard, S; Gardie, B; Couvé, S; Gad, S (30. května 2012). „Von Hippel-Lindau: Jak vzácné onemocnění osvětluje biologii rakoviny“. Semináře z biologie rakoviny. 23 (1): 26–37. doi:10.1016 / j.semcancer.2012.05.005. PMID 22659535.
- ^ Henry, Todd; Campell, James; Hawley, Arthur (1969). Todd-Sanfordova klinická diagnóza laboratorními metodami, editoval Israel Davidsohn [a] John Bernard Henry (14. vydání). Philadelphia: Saunders. p. 555. ISBN 978-0-7216-2921-6.
- ^ Wong WT, nE, Agró Coleman HR a kol. (Únor 2007). „Korelace genotyp – fenotyp u von Hippel – Lindauovy choroby s angiomatózou sítnice“. Archiv oftalmologie. 125 (2): 239–45. doi:10.1001 / archopht.125.2.239. PMC 3019103. PMID 17296901. Archivovány od originál dne 12. 12. 2008. Citováno 2008-10-22.
- ^ Lehmann AR, McGibbon D, Stefanini M (2011). „Xeroderma pigmentosum“. Orphanet Journal of Rare Diseases. 6: 70. doi:10.1186/1750-1172-6-70. PMC 3221642. PMID 22044607.
- ^ Niedernhofer LJ, Bohr VA, Sander M, Kraemer KH (2011). „Xeroderma pigmentosum a další nemoci předčasného stárnutí a opravy DNA: molekuly pro pacienty“. Mech. Aging Dev. 132 (6–7): 340–7. doi:10.1016 / j.mad.2011.06.004. PMC 3474983. PMID 21708183.
- ^ A b Keimling M, Volcic M, Csernok A, Wieland B, Dörk T, Wiesmüller L (2011). „Funkční charakterizace spojuje mutace jednotlivých pacientů u mutované ataxie telangiektázie (ATM) s dysfunkcí specifických signálních drah dvojřetězcové opravy zlomení DNA“. FASEB Journal. 25 (11): 3849–60. doi:10.1096 / fj.11-185546. PMID 21778326.
- ^ Thompson LH, Schild D (2002). „Rekombinační oprava DNA a lidská nemoc“. Mutat. Res. 509 (1–2): 49–78. doi:10.1016 / s0027-5107 (02) 00224-5. PMID 12427531.
- ^ Nimonkar AV, Ozsoy AZ, Genschel J, Modrich P, Kowalczykowski SC (2008). „Lidská exonukleáza 1 a BLM helikáza interagují za účelem resekce DNA a zahájení opravy DNA“. Proc. Natl. Acad. Sci. USA. 105 (44): 16906–11. Bibcode:2008PNAS..10516906N. doi:10.1073 / pnas.0809380105. PMC 2579351. PMID 18971343.
- ^ Němec J (1969). "Bloomův syndrom. I. Genetická a klinická pozorování u prvních dvaceti sedmi pacientů". American Journal of Human Genetics. 21 (2): 196–227. PMC 1706430. PMID 5770175.
- ^ Nagaraju G, Scully R (2007). „Mind the gap: the underground functions of BRCA1 and BRCA2 at stagled replication forks“. Oprava DNA (Amst.). 6 (7): 1018–31. doi:10.1016 / j.dnarep.2007.02.020. PMC 2989184. PMID 17379580.
- ^ Lancaster JM, Powell CB, Chen LM, Richardson DL (2015). „Prohlášení společnosti gynekologické onkologie o hodnocení rizik zděděných předpokladů pro zděděnou gynekologickou rakovinu“. Gynecol. Oncol. 136 (1): 3–7. doi:10.1016 / j.ygyno.2014.09.009. PMID 25238946.
- ^ Thompson LH, Hinz JM (2009). „Buněčné a molekulární důsledky defektních proteinů anémie Fanconi při opravě replikace DNA: mechanistické poznatky“. Mutat. Res. 668 (1–2): 54–72. doi:10.1016 / j.mrfmmm.2009.02.003. PMC 2714807. PMID 19622404.
- ^ Změnit BP (2003). „Cancer in Fanconi anemia, 1927-2001“. Rakovina. 97 (2): 425–40. doi:10.1002 / cncr.11046. PMID 12518367.
- ^ Meyer LA, Broaddus RR, Lu KH (2009). „Rakovina endometria a Lynchův syndrom: klinické a patologické aspekty“. Kontrola rakoviny. 16 (1): 14–22. doi:10.1177/107327480901600103. PMC 3693757. PMID 19078925.
- ^ Carethers JM, Stoffel EM (2015). „Lynchův syndrom a napodobeniny Lynchova syndromu: Rostoucí složitá krajina dědičné rakoviny tlustého střeva“. World Journal of Gastroenterology. 21 (31): 9253–61. doi:10,3748 / wjg.v21.i31.9253. PMC 4541378. PMID 26309352.
- ^ Kastan MB (2008). „Odpovědi na poškození DNA: mechanismy a role v lidských onemocněních: přednáška G.H.A. Clowes Memorial Award 2007“. Mol. Cancer Res. 6 (4): 517–24. doi:10.1158 / 1541-7786.MCR-08-0020. PMID 18403632.
- ^ Viktorsson K, De Petris L, Lewensohn R (2005). „Role p53 při léčebných reakcích na rakovinu plic“. Biochem. Biophys. Res. Commun. 331 (3): 868–80. doi:10.1016 / j.bbrc.2005.03.192. PMID 15865943.
- ^ Testa JR, Malkin D, Schiffman JD (2013). „Propojení molekulárních drah se syndromy dědičného rizika rakoviny“. Vzdělávací kniha Americké společnosti pro klinickou onkologii. 33: 81–90. doi:10.1200 / EdBook_AM.2013.33.81. PMC 5889618. PMID 23714463.
- ^ Rapp A, Greulich KO (2004). „Po indukci dvouvláknového zlomu pomocí UV-A spolupracují homologní rekombinace a nehomologní koncové spoje na stejném DSB, pokud jsou k dispozici oba systémy.“. Journal of Cell Science. 117 (Pt 21): 4935–45. doi:10.1242 / jcs.01355. PMID 15367581.
- ^ Bartkova J, Tommiska J, Oplustilova L, Aaltonen K, Tamminen A, Heikkinen T, Mistrik M, Aittomäki K, Blomqvist C, Heikkilä P, Lukas J, Nevanlinna H, Bartek J (2008). „Aberace komplexu senzoru poškození DNA MRE11-RAD50-NBS1 u lidské rakoviny prsu: MRE11 jako kandidátský familiární gen predisponující k rakovině“. Mol Oncol. 2 (4): 296–316. doi:10.1016 / j.molonc.2008.09.007. PMC 5527773. PMID 19383352.
- ^ Markkanen E, Dorn J, Hübscher U (2013). „MUTYH DNA glykosyláza: důvody pro odstranění nepoškozených bází z DNA“. Přední Genet. 4: 18. doi:10,3389 / fgene.2013.00018. PMC 3584444. PMID 23450852.
- ^ Patel SG, Ahnen DJ (2012). „Familiární syndromy rakoviny tlustého střeva: aktualizace rychle se rozvíjejícího oboru“. Curr Gastroenterol Rep. 14 (5): 428–38. doi:10.1007 / s11894-012-0280-6. PMC 3448005. PMID 22864806.
- ^ A b Chrzanowska KH, Gregorek H, Dembowska-Bagińska B, Kalina MA, Digweed M (2012). „Nijmegen breakkage syndrom (NBS)“. Orphanet Journal of Rare Diseases. 7: 13. doi:10.1186/1750-1172-7-13. PMC 3314554. PMID 22373003.
- ^ Krokan HE, Bjørås M (2013). "Oprava základní excize". Cold Spring Harb Perspect Biol. 5 (4): a012583. doi:10.1101 / cshperspect.a012583. PMC 3683898. PMID 23545420.
- ^ Kuiper RP, Hoogerbrugge N (2015). „NTHL1 definuje syndrom nové rakoviny“. Cílový cíl. 6 (33): 34069–70. doi:10,18632 / oncotarget.5864. PMC 4741436. PMID 26431160.
- ^ Singh DK, Ahn B, Bohr VA (2009). "Role RECQ helikáz v rekombinaci na základě opravy DNA, genomické stability a stárnutí". Biogerontologie. 10 (3): 235–52. doi:10.1007 / s10522-008-9205-z. PMC 2713741. PMID 19083132.
- ^ Anbari KK, Ierardi-Curto LA, Silber JS, Asada N, Spinner N, Zackai EH, Belasco J, Morrissette JD, Dormans JP (2000). "Dva primární osteosarkomy u pacienta s Rothmund-Thomsonovým syndromem". Clin. Orthop. Relat. Res. 378 (378): 213–23. doi:10.1097/00003086-200009000-00032. PMID 10986997.
- ^ Bohr VA (2005). „Deficient DNA repair in the human progeroid disorder, Werner syndrom“. Mutat. Res. 577 (1–2): 252–9. doi:10.1016 / j.mrfmmm.2005.03.021. PMID 15916783.
- ^ Monnat RJ (2010). "Lidské RECQ helikázy: role v metabolismu DNA, mutagenezi a biologii rakoviny". Semin. Cancer Biol. 20 (5): 329–39. doi:10.1016 / j.semcancer.2010.10.002. PMC 3040982. PMID 20934517.
- ^ A b Menck CF, Munford V (2014). „Nemoci na opravu DNA: Co nám říkají o rakovině a stárnutí?“. Genet. Mol. Biol. 37 (1 příplatek): 220–33. doi:10,1590 / s1415-47572014000200008. PMC 3983582. PMID 24764756.
- ^ A b Lehmann AR, McGibbon D, Stefanini M (2011). „Xeroderma pigmentosum“. Orphanet Journal of Rare Diseases. 6: 70. doi:10.1186/1750-1172-6-70. PMC 3221642. PMID 22044607.
- ^ A b Oh KS, Imoto K, Emmert S, Tamura D, DiGiovanna JJ, Kraemer KH (2011). „Nukleotidové excizní opravné proteiny se rychle hromadí, ale nedokáží přetrvávat v lidských buňkách XP-E (mutant DDB2)“. Photochem. Fotobiol. 87 (3): 729–33. doi:10.1111 / j.1751-1097.2011.00909.x. PMC 3082610. PMID 21388382.
- ^ A b Opletalova K, Bourillon A, Yang W, Pouvelle C, Armier J, Despras E, Ludovic M, Mateus C, Robert C, Kannouche P, Soufir N, Sarasin A (2014). „Korelace fenotypu / genotypu v kohortě 23 pacientů s variantou xeroderma pigmentosum odhalila 12 nových mutací POLH způsobujících onemocnění“. Hučení. Mutat. 35 (1): 117–28. doi:10,1002 / humu.22462. PMID 24130121.
- ^ A b „Genetické testování syndromů dědičné rakoviny“. Národní onkologický institut. 2013-04-22. Citováno 2018-02-19.
- ^ A b Foulkes, William D .; Knoppers, Bartha Maria; Turnbull, Clare (leden 2016). „Populační genetické testování náchylnosti k rakovině: zakladatelské mutace genomů“. Recenze přírody. Klinická onkologie. 13 (1): 41–54. doi:10.1038 / nrclinonc.2015.173. ISSN 1759-4782. PMID 26483301.
- ^ Reference, Genetics Home. „Co je to genetické testování?“. Genetická domácí reference. Citováno 2018-02-20.
- ^ Myers, Melanie F .; Bernhardt, Barbara A. (červen 2012). „Přímé spotřebitelské genetické testování: úvod do zvláštního vydání“. Journal of Genetic Counselling. 21 (3): 357–360. doi:10.1007 / s10897-012-9500-3. ISSN 1573-3599. PMID 22441809.
- ^ Reference, Genetics Home. „Jaké jsou náklady na genetické testování a jak dlouho trvá získání výsledků?“. Genetická domácí reference. Citováno 2018-02-20.
- ^ Robson, Mark E .; Bradbury, Angela R .; Arun, Banu; Domchek, Susan M .; Ford, James M .; Hampel, Heather L .; Lipkin, Stephen M .; Syngal, Sapna; Wollins, Dana S. (01.11.2015). „Aktualizace prohlášení americké společnosti pro klinickou onkologii: Genetické a genomické testování na náchylnost k rakovině“. Journal of Clinical Oncology. 33 (31): 3660–3667. doi:10.1200 / JCO.2015.63.0996. ISSN 1527-7755. PMID 26324357.
- ^ „Genetické testování rizika rakoviny“. Cancer Research UK. 2015-06-02. Citováno 2018-02-20.
- ^ Schrag, D .; Kuntz, K. M .; Garber, J. E.; Weeks, J. C. (1997-05-15). „Analýza rozhodnutí - účinky profylaktické mastektomie a ooforektomie na očekávanou délku života u žen s mutacemi BRCA1 nebo BRCA2“. The New England Journal of Medicine. 336 (20): 1465–1471. doi:10.1056 / NEJM199705153362022. ISSN 0028-4793. PMID 9148160.
- ^ Newton, K .; Green, K .; Lalloo, F .; Evans, D. G .; Hill, J. (leden 2015). „Kolonoskopie prověřuje shodu a výsledky u pacientů s Lynchovým syndromem“. Kolorektální nemoc. 17 (1): 38–46. doi:10.1111 / codi.12778. ISSN 1463-1318. PMID 25213040.
- ^ Cossack, Matthew; Ghaffary, Cameron; Watson, Patrice; Snyder, Carrie; Lynch, Henry (duben 2014). „Užívání aspirinu je spojeno s nižším rizikem rakoviny prostaty u mužských nositelů mutací BRCA“. Journal of Genetic Counselling. 23 (2): 187–191. doi:10.1007 / s10897-013-9629-8. ISSN 1573-3599. PMID 23881471.
- ^ Thorat, Mangesh A .; Cuzick, Jack (prosinec 2013). „Role aspirinu v prevenci rakoviny“. Aktuální onkologické zprávy. 15 (6): 533–540. doi:10.1007 / s11912-013-0351-3. ISSN 1534-6269. PMID 24114189.
- ^ Reference, Genetics Home. "Wernerův syndrom". Genetická domácí reference. Citováno 2018-02-20.
- ^ „Genetické riziko, rasa a etnická příslušnost | Časopis Cancer Fighters Thrive Magazine“. CancerCenter.com. Archivovány od originál dne 2018-02-21. Citováno 2018-02-20.
