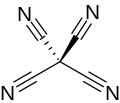
Tetracyanomethan - Tetracyanomethane
 | |
| Jména | |
|---|---|
| Název IUPAC Methanetetrakarbonitril | |
| Ostatní jména tetracyanid uhličitý; 2,2-dikyanomalononitril | |
| Identifikátory | |
3D model (JSmol ) | |
| ChemSpider | |
PubChem CID | |
Řídicí panel CompTox (EPA) | |
| |
| |
| Vlastnosti | |
| C5N4 | |
| Molární hmotnost | 116.083 g · mol−1 |
| Struktura | |
| trigonální | |
| R3C | |
A = 9.062, C = 11.625 | |
Objem mřížky (PROTI) | 137,8 Å3 |
Jednotky vzorce (Z) | 6 |
| čtyřstěn | |
| Termochemie[1] | |
Std entalpie of formace (ΔFH⦵298) | -146,2 kcal / mol |
| -616,4 kcal / mol | |
Pokud není uvedeno jinak, jsou uvedeny údaje o materiálech v nich standardní stav (při 25 ° C [77 ° F], 100 kPa). | |
| Reference Infoboxu | |
Tetracyanomethan nebo tetracyanid uhličitý je percyanoalkan molekulární nitrid uhlíku se vzorcem C (CN)4. Strukturu lze považovat za metan se všemi atomy vodíku nahrazeny kyanid skupiny. Poprvé to vytvořil Erwin Mayer v roce 1969.[2][3]
Vlastnosti
Tetracyanomethan je pevná látka při teplotě místnosti. Rozkládá se při teplotě 160 ° C bez roztavení a přestože může být ve zředěné páře, není známa žádná kapalná forma.[2]Molekuly tetracyanomethanu mají a čtyřboká symetrie (43m nebo Td). Molekula má C-C vzdálenost 1,484 Á a C-N vzdálenost 1,161 Á v plynné formě. V pevné látce se vazba C≡N zkracuje na 1,147 Å.[3] Vazba CC má silovou konstantu 4,86 × 105 dyn / cm, což je o něco větší než vazba C-Cl v chlorid uhličitý, ale o dost slabší než v EU trikyanomethanide ion.[4] Při tlaku nad 7 GPa začne tetracyanomethan polymerovat za vzniku neorganizované kovalentní síťové pevné látky. Při vyšším tlaku barva žlutá a ztmavne na černou. Polymerace přes 20 GPa je celková.[5]
Sypký modul K0 = 4,4 a jeho derivace K0' = 18.[5]
Výroba
Tetracyanomethan lze připravit reakcí chlorkyan s trikyanomethanidem stříbrným.[4]
- ClCN + AgC (CN)3 → C (CN)4 + AgCl
Reakce
V kyselém roztoku ve vodě se tetracyanomethan hydrolyzuje za získání trikyanomethanide a amonné ionty spolu s oxidem uhličitým. V alkalických roztocích trikyanomethanid a kyanát ionty se vyrábějí.[4]
Viz také
- Tricyanomethane (kyanoforma)
Reference
- ^ Barnes, D.S .; Mortimer, C.T .; Mayer, E. (červenec 1973). "Entalpie tvorby tetracyanomethanu". Žurnál chemické termodynamiky. 5 (4): 481–483. doi:10.1016 / S0021-9614 (73) 80095-3.
- ^ A b Mayer, Erwin (1969). „Darstellung und Eigenschaften von Tetracyanmethan“. Monatshefte für Chemie. 100 (2): 462–468. doi:10.1007 / BF00904089. S2CID 92450428.
- ^ A b Britton, D. (1. července 1974). „Krystalová struktura tetracyanomethanu, C (CN)4". Acta Crystallographica oddíl B. 30 (7): 1818–1821. doi:10.1107 / S0567740874005863.
- ^ A b C Hester, Ronald E .; Lee, Kenneth Michael; Mayer, Erwin (září 1970). "Tetracyanomethan jako pseudo- (tetrahalogenid uhlíku)". The Journal of Physical Chemistry. 74 (18): 3373–3376. doi:10.1021 / j100712a011.
- ^ A b Keefer, Derek W .; Gou, Huiyang; Wang, Qianqian; Purdy, Andrew; Epshteyn, Albert; Juhl, Stephen J .; Cody, George D .; Badding, John; Strobel, Timothy A. (12. února 2018). „Tetracyanomethan under Pressure: Extended CN Polymers from Precurors with Built-in sp3 Centers“. The Journal of Physical Chemistry A. 122 (11): 2858–2863. Bibcode:2018JPCA..122.2858K. doi:10.1021 / acs.jpca.7b10729. OSTI 1430339. PMID 29432685.
