IUPAC nomenklatura anorganické chemie 2005 - IUPAC nomenclature of inorganic chemistry 2005 - Wikipedia
Nomenklatura anorganické chemie, doporučení IUPAC 2005 je verze 2005 z Nomenklatura anorganické chemie (kterému se neformálně říká červená kniha). Jedná se o soubor pravidel pro pojmenování anorganických sloučenin, jak doporučuje Mezinárodní unie pro čistou a aplikovanou chemii (IUPAC).
souhrn
Vydání z roku 2005 nahrazuje jejich předchozí doporučení Nomenklatura Červená kniha anorganické chemie, doporučení IUPAC z roku 1990 (Červená kniha I)a „případně“ (sic) Nomenklatura anorganické chemie II, doporučení IUPAC 2000 (Červená kniha II).
Doporučení zabírají více než 300 stránek[1] a celý text lze stáhnout z IUPAC.[2] Byly vydány opravy.[3]
Kromě reorganizace obsahu existuje nová část o organometalice a formální seznam prvků, které mají být použity místo elektronegativita seznamy v sekvenčních prvcích ve vzorcích a názvech. Koncept preferovaného názvu IUPAC (PIN), který je součástí revidované modré knihy pro pojmenování organických sloučenin, dosud nebyl přijat pro anorganické sloučeniny. Existují však pokyny, která metoda pojmenování by měla být přijata.
Metody pojmenování
Doporučení popisují řadu různých způsobů, kterými lze sloučeniny pojmenovat. Tyto jsou:
- složení složení (např. chlorid sodný)
- substituční pojmenování na základě původních hydridů (GeCl2Mě2 dichlorodimethylgerman)
- aditivní pojmenování ([MnFO3] fluoridotrioxidomangan))
Kromě toho existují doporučení pro následující:
- pojmenování shlukových sloučenin
- povolené názvy pro anorganické kyseliny a deriváty
- pojmenování pevných fází, např. nestechiometrické fáze
Pro jednoduchou sloučeninu, jako je AlCl3 různé konvence pojmenování poskytují následující:
- kompoziční: chlorid hlinitý (stechiometricky ) nebo chlorid dialuminium (dimer )
- substituční: trichloraluman
- přísada: trichloridoaluminium; hexachloridodialuminium (dimer bez strukturní informace); di-μ-chlorido-tetrachlorido-1κ2Cl, 2κ2Cl-dialuminium (dimer se strukturální informací)
Sekvenční prvky - seznam „elektronegativity“
V rámci doporučení bylo použití elektronegativity prvků pro sekvenování nahrazeno formálním seznamem, který je volně založený na elektronegativitě. Doporučení stále používají termíny elektropozitivní a elektronegativní k označení relativní polohy prvku v tomto seznamu.
Jednoduché pravidlo ignorování lanthanoidů a aktinidů je:
- pro dva prvky v různých skupinách - pak prvek ve skupině s vyšším číslem má vyšší „elektronegativitu“
- pro dva prvky ve stejné skupině má prvek s nižším atomovým číslem vyšší „elektronegativitu“
- Vodík je zabudován tak, aby byl méně elektronegativní než jakýkoli chalkogen a více elektronegativní než jakýkoli pnictogen. Proto lze vzorce vody a amoniaku psát H2O a NH3 resp.
Úplný seznam od nejvyšší po nejnižší „elektronegativitu“ (s přidáním prvků 112 až 118, které ještě nebyly v roce 2005 pojmenovány, do jejich příslušných skupin):
- Skupina 17 v pořadí atomových čísel, tj. F – Ts následován
- Skupina 16 v pořadí atomových čísel, tj. O – Lv následován
- H, vodík, následován
- Skupina 15 v pořadí atomových čísel, tj. N – Mc následován
- Skupina 14 v pořadí atomových čísel, tj. C – Fl následován
- Skupina 13 v pořadí atomových čísel, tj. B – Nh následován
- Skupina 12 v pořadí atomových čísel, tj. Zn – Cn následován
- Skupina 11 v pořadí atomových čísel, tj. Cu – Rg následován
- Skupina 10 v pořadí atomových čísel, tj. Ni – Ds následován
- Skupina 9 v pořadí atomových čísel, tj. Co – Mt následován
- Skupina 8 v pořadí atomových čísel, tj. Fe – Hs následován
- Skupina 7 v pořadí atomových čísel, tj. Mn – Bh následován
- Skupina 6 v pořadí atomových čísel, tj. Cr – Sg následován
- Skupina 5 v pořadí atomových čísel, tj. V – Db následován
- Skupina 4 v pořadí atomových čísel, tj. Ti – Rf následován
- Skupina 3 v pořadí atomových čísel, tj. Sc – Y následován
- the lanthanoidy v pořadí atomových čísel, tj. La – Lu následován
- the aktinoidy v pořadí atomových čísel, tj. Ac – Lr následován
- Skupina 2 v pořadí atomových čísel, tj. Be – Ra následován
- Skupina 1 (kromě H) v pořadí atomových čísel, tj. Li – Fr následován
- Skupina 18 v pořadí atomových čísel, tj. He – Og
Stanovení nomenklatury, která se má použít
| Akce | Přidání sloučenina? | Určitý stechiometrie? | mono-atomový ? | molekulární ? | kov současnost, dárek? | Bond to uhlík ? | přechodový kov skupina 3–12? | hlavní skupina metal skupiny 1, 2, 3–6? |
|---|---|---|---|---|---|---|---|---|
| S každou komponentou zacházejte zvlášť použití kompoziční | Ano | |||||||
| Použití pevné látky pojmenování | Ne | Ne | ||||||
| Pojmenování prvku nebo monatomického kationtu / aniontu / radikálu | Ne | Ano | Ano | |||||
| Rozdělte komponenty na „elektropozitivní“ / „elektronegativní“ S každou komponentou zacházejte zvlášť Použití zobecněná stechiometrická pojmenování | Ne | Ano | Ne | Ne | ||||
| Použití Modrá kniha (Organická sloučenina ) | Ne | Ano | Ne | Ano | Ne | Ano | ||
| Použití přísada pojmenování pro skupina 3-12 organometallics | Ne | Ano | Ne | Ano | Ano | Ano | Ano | |
| Použití substituční pojmenování pro skupina 3–6 organokovů Použití kompoziční pro skupiny 1–2 organokovové | Ne | Ano | Ne | Ano | Ano | Ano | Ne | Ano |
| Použití přísada pojmenování pro koordinační komplexy | Ne | Ano | Ne | Ano | Ano | Ne | Ano | |
| Vyberte jednu z možností substituční nebo přísada | Ne | Ano | Ne | Ano | Ne | Ne |
Poznámka: „zacházet samostatně“ znamená použít rozhodovací tabulku pro každou komponentu
Názvy prvků
Ukázka neurčité struktury
Neurčitý vzorek jednoduše vezme název prvku. Například vzorek uhlíku (kterým může být diamant, grafit atd. Nebo směs) by byl pojmenován uhlík.
Specifický allotrope
Molekulární
- Ó2 dioxygen (přijatelné jméno kyslík)
- Ó3 trioxygen (přijatelný název ozon)
- P4 tetraphosphorus (přijatelné jméno bílý fosfor)
- S6 hexasulfur (přijatelný název ε-síra)
- S8 cyklo-oktasulfur (přijatelné názvy pro polymorfní formy jsou α-síra, β-síra, γ-síra)
Krystalická forma
To je určeno symbolem prvku následovaným znakem Pearsonův symbol pro krystalickou formu. (Všimněte si, že doporučení konkrétně kurzívu druhý znak.)
- Cn uhlík (cF8) (přijatelné jméno diamant)
- Snn nádechJá4) (přijatelné jméno β- nebo bílý cín)
- Mnn mangan (cJá58) (přijatelný název α-mangan)
Amorfní rozpoznané alotropy
Mezi příklady patří P.n, červený fosfor; Tak jakonamorfní arsen.
Sloučeniny
Názvy kompozic dodávají málo strukturálních informací a jsou doporučeny pro použití, pokud strukturální informace nejsou k dispozici nebo je není nutné sdělit. Stechiometrické názvy jsou nejjednodušší a odrážejí buď empirický vzorec, nebo molekulární vzorec. Uspořádání prvků se řídí formálním seznamem elektronegativity pro binární sloučeniny a seznamem elektronegativity pro seskupení prvků do dvou tříd, které jsou poté seřazeny podle abecedy. Proporce jsou specifikovány di-, tri- atd. (Viz Číselný multiplikátor IUPAC.) Pokud je známo, že existují složité kationty nebo anionty, jsou tyto pojmenovány samy o sobě a poté jsou tyto názvy použity jako součást složeného názvu.
Binární sloučeniny
V binárních sloučeninách je elektropozitivní prvek ve vzorci umístěn na prvním místě. Používá se formální seznam. Název nejvíce elektronegativního prvku je upraven tak, aby skončil na straně a název elektropozitivnějších prvků zůstává beze změny.
Vezmeme-li binární sloučeninu sodíku a chloru: chlor se v seznamu nachází jako první, proto je v názvu poslední. Další příklady jsou
- PCl5 chlorid fosforečný
- Ca.2P3 trifosfid vápenatý
- Stanid niklu NiSn
- Cr23C6 trikosachromium hexakarbid
Ternární sloučeniny a další
Níže jsou uvedeny principy.
Kvartérní sloučenina 1: 1: 1: 1 mezi bromem, chlorem, jodem a fosforem:
- PBrClI chlorid jodid fosforečný (fosfor je nejvíce elektropozitivní, ostatní jsou označeny jako elektronegativní a jsou seřazeny v abecedním pořadí)
Ternární sloučeninu antimonu, mědi a draslíku v poměru 2: 1: 5 lze pojmenovat dvěma způsoby v závislosti na tom, které prvky jsou označeny jako elektronegativní.
- CuK5Sb2 měď-pentapraselný diantimonid (jak měď, tak draslík jsou označeny jako elektropozitivní a jsou seřazeny v abecedním pořadí)
- K.5CuSb2 pentapotras diantimonide cupride (pouze draslík je označen jako elektropozitivní a dva elektronegativní prvky jsou seřazeny v abecedním pořadí) (Poznámka: červená kniha ukazuje tento příklad nesprávně)
Pojmenování iontů a radikálů
Kationy
Monatomické kationty jsou pojmenovány převzetím názvu prvku a jeho následováním s nábojem v závorkách, např
- Na+
sodík (1+) - Cr3+
chrom (3+)
Někdy je třeba použít zkrácenou formu názvu prvku, např. germid pro germanium, jak germanide označuje GeH−
3.
Polyatomické kationty stejného prvku jsou pojmenovány jako název prvku, kterému předchází di-, tri- atd., např .:
- Hg2+
2 dimercury (2+)
Polyatomické kationty složené z různých prvků jsou pojmenovány buď substitučně, nebo aditivně, např .:
- PH+
4 fosfanium - SbF+
4 tetrafluorostibanium (substituční) nebo tetrafluoridoantimon (1+) - Všimněte si, že amonium a oxonium jsou přijatelné názvy pro NH+
4 a H
3Ó+
resp. (Hydronium není přijatelné jméno pro H
3Ó+
[Citace je zapotřebí ])
Anionty
Monatomické anionty jsou pojmenovány jako prvek upravený s koncovkou -ide. Náboj následuje v závorkách (volitelně pro 1−), např .:
- Cl− chlorid (1-) nebo chlorid
- S2− sulfid (2−)
Některé prvky mají svůj latinský název jako kořen, např
- stříbro, Ag, argentid
- měď, měď, měď
- železo, Fe, ferid
- cín, Sn, stannid
Polyatomické anionty stejného prvku jsou pojmenovány jako název prvku, kterému předchází di-, tri- atd., např .:
- Ó22− oxid (2−) (nebo peroxid jako přijatelný název)
- C22− dikarbid (2−) (nebo acetylid jako přijatelný název)
- S22− disulfid (2−)
nebo někdy jako alternativa odvozená od substitučního názvu, např.
- S22− disulfandiid
Polyatomické anionty složené z různých prvků jsou pojmenovány buď substitučně, nebo aditivně, koncovky jmen jsou -ide a -ate, např. :
- GeH3− germanid (substituční) nebo trihydridogermanát (1 -) (přísada)
- TeH3− substituce tellanuidem, kde -uide specifikuje anion složený z dalšího hydridu připojeného k původnímu hydridu
- [PF6]− hexafluoro-λ5-fosfanuid (substituční) nebo hexafluoridofosfát (1 -) (přísada)
- TAK32− trioxidosulfát (2−) (přísada) nebo siřičitan (přijatelný nesystematický název)
Úplný seznam alternativních přijatelných nesystematických názvů pro kationty a anionty je uveden v doporučeních. Mnoho aniontů má názvy odvozené od anorganických kyselin, jimž se budeme věnovat později.
Radikály
Přítomnost nepárových elektronů lze označit „·". Například:
- On·+ hélium(·+)
- N2(2·)2+ dinitrogen (2·2+)
Pojmenování hydrátů a podobných mřížkových sloučenin
Použití termínu hydrát je stále přijatelné, např. Na2TAK4· 10 hodin2O, dekahydrát síranu sodného. Doporučenou metodou by bylo pojmenovat to síran sodný — voda (1/10). Podobně další příklady mřížkových sloučenin jsou:
- CaCl2· 8NH3, chlorid vápenatý - amoniak (1/8)
- 2Na2CO3· 3H2Ó2, uhličitan sodný - peroxid vodíku (2/3)
- AlCl3· 4EtOH, chlorid hlinitý - ethanol (1/4)
Určení proporcí pomocí náboje nebo oxidačního stavu
Jako alternativu k di-, tri- předponám lze použít buď náboj, nebo oxidační stav. Poplatek se doporučuje, protože oxidační stav může být nejednoznačný a diskutabilní.
Substituční nomenklatura
Tato metoda pojmenování se obecně řídí zavedenou organickou nomenklaturou IUPAC. Jsou uvedeny hydridy hlavních prvků skupiny (skupiny 13–17) -ane základní názvy, např. borane, BH3. Přijatelné alternativní názvy pro některé z výchozích hydridů jsou voda spíše než oxidan a amoniak spíše než azan. V těchto případech se má pro substituované deriváty použít základní název.
Tato část doporučení se týká pojmenování sloučenin obsahujících kroužky a řetězy.
Základní hydridy
| BH3 | borane | CH4 | metan | NH3 | azan (amoniak ) | H2Ó | oxidan (voda ) | HF | fluoran (fluorovodík ) |
| AlH3 | hliník | SiH4 | silan | PH3 | fosfan (fosfin ) | H2S | sulfan (sirovodík nebo dihydrogensulfid) | HCl | chloran (chlorovodík ) |
| GaH3 | gallane | GeH4 | germane | Popel3 | arsane (arsine ) | H2Se | selane (selenid vodíku nebo dihydrogenselenid) | HBr | brom (bromovodík ) |
| InH3 | indigane | SnH4 | stannane | SbH3 | stibane (stibine ) | H2Te | tellane (telurid vodíku nebo dihydrogen tellurid) | AHOJ | jod (jodovodík ) |
| TlH3 | thallane | PbH4 | plumbane | BiH3 | vizmutan (vizmutin ) | H2Po | polane (polonid vodíku nebo dihydrogen polonid) | Čepice | astatan (astatid vodíku ) |
Hydridy s nestandardní vazbou - lambda konvence
Pokud má sloučenina nestandardní vazbu ve srovnání s původním hydridem, například PCI5 používá se lambda konvence. Například:
- PCl5 pentachlor-λ5-fosfan
- SF6 hexafluoro-λ6-sulfan
Polynukleární hydridy
Předpona di-, tri- atd. se přidá k názvu nadřazeného hydridu. Příklady:
- HOOH, dioxidan (peroxid vodíku je přijatelný název)
- H2PPH2, difosfan
- H3SiSiH2SiH2SiH3, tetrasilan
Prsteny a řetězy
Doporučení popisují tři způsoby přiřazování „původních“ jmen homonukleárním monocyklickým hydridům (tj. Jednotlivé kruhy skládající se z jednoho prvku):
- the Hantzsch – Widmanova nomenklatura (metoda preferovaná pro prsteny o velikosti 3–10)
- „nomenklatura náhrady skeletu“ - specifikující nahrazení atomů uhlíku v odpovídající sloučenině uhlíku atomy jiného prvku (např. křemík se stává sila, germanium, germa) a multiplikativní předpona tri, tetra, penta atd.) (metoda preferovaná pro kruhy větší než 10)
- přidáním předpony cyklo na název příslušného nerozvětveného, nesubstituovaného řetězce
Hydridy boru
Za stechiometrickým názvem následuje počet atomů vodíku v závorkách. Například B2H6, diboran (6). Více strukturálních informací lze sdělit přidáním „strukturálního deskriptoru“ closo-, nido-, arachno-, hypho-, klado- předpony.
Existuje plně systematická metoda číslování atomů v klastrech hydridu boritého a metoda popisu polohy přemostění atomů vodíku pomocí symbolu μ.
Hlavní skupina organokovových sloučenin
Použití substituční nomenklatury se doporučuje pro skupinu 13–16 hlavních skupin organokovových sloučenin. Příklady:
- AlH2Jmenoval jsem se methylaluman
- BiI2Ph pojmenovaný diiodo (fenyl) bismuthan
Pro organokovové sloučeniny skupin 1–2 lze použít aditivní (označující molekulární agregát) nebo složení. Příklady:
- [BeEtH] pojmenovaný ethylhydridoberyllium nebo ethanidohydridoberyllium
- [Mg (η5-C5H5)2] pojmenovaný bis (η5-cyklopentadienyl) hořčík nebo bis (n5-cyklopentadienido) hořčík
- Na (CHCH2) ethenid sodný (název složení)
Doporučení však konstatuje, že tyto sloučeniny budou řešit budoucí projekty nomenklatury.
Doplňková nomenklatura
Toto pojmenování bylo vyvinuto hlavně pro koordinační sloučeniny, i když může být široce používáno. Příklady:
- Si (OH)4 tetrahydroxidosilicon (přísada) nebo silanetetrol (substituční) (poznámka kyselina křemičitá je přijatelný název - orthosilicic byl vynechán).
- [CoCl (NH3)5] Cl2 pentaamminechloridokobalt (2+) chlorid
Doporučený postup pro pojmenování mononukleárních sloučenin
Doporučení zahrnují vývojový diagram, který lze velmi stručně shrnout:
- identifikovat centrální atom,
- identifikovat a pojmenovat ligandy,
- specifikovat koordinační režim ligandů, tj. pomocí konvencí kappa a / nebo eta
- sekvenujte ligandy
- specifikovat koordinační geometrii, tj. mnohostěnný symbol, konfigurační index (pomocí Pravidla CIP a absolutní konfigurace pro opticky aktivní sloučeniny.
Názvy ligandů
Aniontové ligandy
Pokud název anionu končí na -ide, změní se jeho název na ligand na -o. Například chloridový anion, Cl− se stává chloridem. To je rozdíl od pojmenování organických sloučenin a substitučního pojmenování, kdy se s chlorem zachází jako s neutrálním a stává se z něj chlor, jako v PCl3, které lze pojmenovat buď substitučně, nebo aditivně jako trichlorfosfan, respektive trichloridofosfor.
Podobně, pokud aniontová jména končí na -ite, -ate, pak jsou názvy ligandů -ito, -ato.
Neutrální ligandy
Neutrální ligandy nemění název, s výjimkou následujících:
- Voda, „aqua“
- Amoniak, „amin“
- Oxid uhelnatý vázaný přes uhlík, „karbonyl“
- Oxid dusnatý vázaný přes dusík, „nitrosyl“
Příklady názvů ligandů
| Vzorec | název |
|---|---|
| Cl− | chlorido |
| CN− | kyanido |
| H− | hydrido |
| D−nebo 2H− | deuterido nebo [2H] hydrido |
| PhCH2CH2Se− | 2-fenylethan-1-selenolato |
| MeCOO− | acetato nebo ethanoato |
| Mě2Tak jako− | dimethylarsanido |
| MePH− | methylfosfanido |
| MeCONH2 | acetamid (ne acetamido) |
| MeCONH− | acetylazanido nebo acetylamido (ne acetamido) |
| MeNH2 | methanamin |
| MeNH− | methylazanido nebo methylamido nebo methanaminido |
| MePH2 | methylfosfan |
| CO | karbonyl |
Posloupnost a poloha ligandů a centrálních atomů
Ligandy jsou seřazeny abecedně podle názvu a před názvem centrálního atomu. Počet koordinujících ligandů je indikován předponami di-, tri-, tetra-penta- atd. pro jednoduché ligandy nebo bis-, tris-, tetrakis- atd. pro komplexní ligandy. Například:
- [CoCl (NH3)5] Cl2 pentaamminechloridokobalt (3+) chlorid, kde amin (NH3) předchází chlorid. Názvy centrálních atomů pocházejí z ligandů. Pokud existuje více než jeden centrální atom, předchází mu di-, tri-, tetra- atd.
- Os3(CO)12, dodekakarbonyltriosmium
Pokud existují různé centrální atomy, jsou sekvenovány pomocí seznamu elektronegativity.
- [ReCo (CO)9] nonacarbonylrheniumcobalt
Překlenovací ligandy - použití symbolu μ
Ligandy mohou překlenout dvě nebo více center. Předpona μ se používá k určení přemosťujícího ligandu ve vzorci i v názvu. Například dimerní forma chlorid hlinitý:

- Al2Cl4(μ-Cl)2
- di-μ-chlorido-tetrachlorido-1κ2Cl, 2κ2Cl- hliník
Tento příklad ilustruje uspořádání přemosťujících a nepřemosťujících ligandů stejného typu. Ve vzorci následují přemosťující ligandy přemostění, zatímco ve jménu přemosťující ligandy předcházejí přemostění. Všimněte si použití konvence kappa k určení, že na každém hliníku jsou dva koncové chloridy.
Překlenovací index
Tam, kde jsou přemostěny více než dvě centra, je index přemostění přidán jako dolní index. Například v základní octan berylnatý které lze vizualizovat jako čtyřboké uspořádání atomů Be spojených 6 acetátovými ionty tvořící klec s centrálním oxidovým aniontem, vzorec a název jsou následující:
- [Být4(μ4-O) (μ-O2CMe)6]
- hexakis (μ-acetato-κÓ: κÓ′) -Μ4-oxido-čtyřstěn-tetraberyllium
Μ4 popisuje přemostění iontu centrálního oxidu. (Všimněte si použití konvence kappa k popisu přemostění acetátového iontu, kde jsou zahrnuty oba atomy kyslíku.) V názvu, kde je ligand zapojen do různých způsobů přemostění, je vícenásobné přemostění uvedeno v sestupném pořadí podle složitosti, např. μ3 přemostění před μ2 přemostění.
Kappa, κ, konvence
Konvence kappa se používá k určení, které atomy ligandu se vážou k centrálnímu atomu, a v polynukleárních druzích, které atomy, přemostěné i nepřemostěné, se ke kterému připojují. U monodentátních ligandů neexistuje dvojznačnost, který atom tvoří vazbu k centrálnímu atomu. Avšak pokud má ligand více než jeden atom, který se může spojit s centrálním atomem, použije se konvence kappa k určení, které atomy v ligandu tvoří vazbu. Atomový symbol prvku je kurzívou a před ním je kappa, κ. Tyto symboly jsou umístěny za částí názvu ligandu, která představuje kruh, řetězec atd., Kde je ligand umístěn. Například:
- pentaamminenitrito-κÓ-cobalt (III) specifikuje, že nitritový ligand se váže přes atom kyslíku
Tam, kde existuje více než jedna vazba vytvořená z ligandu určitým prvkem, dává počet numerický horní index. Například:
- aqua [(ethan-1,2-diyldinitrilo-κ2N,N„) Tris (acetato-κÓ) acetato] kobalát (1-), anion kobaltu vytvořený s vodou a pentadentátem edta, který spojuje prostřednictvím dvou atomů dusíku a tří atomů kyslíku. Existují dvě vazby z atomů dusíku v edta, která je specifikována pomocí -κ2N,N“. Tři vazby z kyslíku jsou specifikovány tris (acetato-κÓ), kde je jedna ligace na octan.
V polynukleárních komplexech je použití symbolu kappa rozšířeno dvěma souvisejícími způsoby. Za prvé k určení, které ligující atomy se vážou ke kterému centrálnímu atomu, a za druhé k určení přemosťujícího ligandu, o které centrální atomy jde. Centrální atomy musí být identifikovány, tj. Přiřazením čísel k nim. (Tím se formálně zabývají doporučení). Chcete-li určit, které ligující atomy v vazbě ligandu ke kterému centrálnímu atomu, čísla centrálních atomů předcházejí symbolu kappa a číselný horní index určuje počet ligací a za ním následuje atomový symbol. Více výskytů je odděleno čárkami.
Příklady:
- di-μ-chlorido-tetrachlorido-1κ2Cl, 2κ2Cl-dialuminium, (chlorid hlinitý ).
- tetrachlorido-1κ2Cl, 2κ2Cl specifikuje, že na každém atomu hliníku jsou dva chloridové ligandy.
- dekarbonyl-1κ3C, 2κ3C, 3κ4C-di-μ-hydrido-1: 2κ2H; 1: 2κ2H-triangulo-(3 Os—Os), (Decacarbonyldihydridotriosmium ).
- dekarbonyl-1κ3C, 2κ3C, 3κ4C ukazuje, že na dvou atomech osmiu jsou tři karbonylové skupiny a na třetím čtyři.
- di-μ-hydrido-1: 2κ2H; 1: 2κ2H specifikuje, že dva hydridové můstky mezi atomem osmium 1 a atomem osmium 2.
Eta, η, konvence
Systematické je použití η k označení haptičnosti. Použití η1 se nedoporučuje. Pokud je specifikace zúčastněných atomů nejednoznačná, musí být uvedena poloha atomů. To dokládají příklady:
- Cr (η6-C6H6)2, pojmenovaný jako bis (η6-benzen) chrom, protože jsou zahrnuty všechny (sousedící) atomy v benzenových ligandech, jejich poloha nemusí být uvedena
- [(1,2,5,6-n) -cyklookta-1,3,5,7-tetraen] (n5-cyklopentadienyl) kobalt v této pouze dvě (v polohách 1 a 5) ze čtyř dvojných vazeb jsou spojeny s centrálním atomem.
Koordinační geometrie
U libovolného koordinačního čísla nad 2 je možná více než jedna koordinační geometrie. Například čtyři souřadnicové koordinační sloučeniny mohou mít čtyřboký, čtvercový rovinný, čtvercový pyramidový nebo houpací tvar. The mnohostěnný symbol se používá k popisu geometrie. A konfigurační index se stanoví z poloh ligandů a společně s mnohostěnný symbol je umístěn na začátku jména. Například v komplexu (SP-4-3) - (acetonitril) dichlorido (pyridin) platina (II) (SP-4-3) na začátku názvu popisuje čtvercovou rovinnou geometrii, 4 souřadnice s konfiguračním indexem 3 označujícím polohu ligandů kolem centrálního atomu. Více podrobností viz mnohostěnný symbol.
Organokovové skupiny 3–12
Doplňková nomenklatura se obecně doporučuje pro organokovové sloučeniny skupin 3-12 (přechodné kovy a zinek, kadmium a rtuť).
Metaloceny
V návaznosti na ferrocen —Prvá sendvičová sloučenina s centrálním atomem Fe koordinovaným na dva paralelní cyklopentadienylové kruhy - názvy sloučenin s podobnými strukturami, jako je osmocen a vanadocen, jsou běžně používány. Doporučení je, že název končí ocenit by měly být omezeny na sloučeniny, kde existují diskrétní molekuly bis (η5-cyklopentadienyl) kov (a kruhem substituované analogy), kde cyklopentadienylové kruhy jsou v podstatě rovnoběžné, a kov je v d-bloku. Terminologie neplatí pro sloučeniny prvků s- nebo p-bloku, jako je Ba (C.5H5)2 nebo Sn (C.5H5)2.
Příklady sloučenin, které splňují kritéria, jsou:
- vanadocen, [V (η5-C5H5)2]
- chromocen, [Cr (η5-C5H5)2]
- kobalcen, [Co (η5-C5H5)2]
- rhodocen, [Rh (η5-C5H5)2]
- nikelocen, [Ni (η5-C5H5)2]
- ruthenocene, [Ru (η5-C5H5)2]
- osmocen, [Os (η5-C5H5)2]
- manganocen, [Mn (η5-C5H5)2]
- rhenocen, [Re (η5-C5H5)2].
Příklady sloučenin, které by neměly být pojmenovány jako metaloceny, jsou:
- C10H10Ti
- [Ti (η5-C5H5)2Cl2] má správný název dichloridobis (η5-cyklopentadienyl) titan NE chlorid titanocenový
Polynukleární shlukové sloučeniny
Vazby kov-kov
V polynukleárních sloučeninách s vazbami kov-kov jsou tyto uvedeny za názvem prvku následovně: (3 Os—Os) v Decacarbonyldihydridotriosmium. Dvojice závorek obsahuje počet vytvořených vazeb (je-li větší než 1), za nimiž následují atomové symboly s kurzívou, oddělené „pomlčkou“.
Polynukleární geometrie klastru
Geometrie polynukleárních shluků může mít složitost. Deskriptor např. čtyřstěn nebo deskriptor CEP, např. Td- (13) -Δ4-closo] může být použito. to je určeno složitostí klastru. Některé příklady deskriptorů a ekvivalentů CEP jsou uvedeny níže. (Deskriptory CEP jsou pojmenovány pro Caseyho, Evanse a Powella, kteří popsali systém.[4]
| počet atomů | deskriptor | Deskriptor CEP |
|---|---|---|
| 3 | triangulo | |
| 4 | quadro | |
| 4 | čtyřstěn | [Td- (13) -Δ4-closo] |
| 5 | [D3h- (131) -Δ6-closo] | |
| 6 | oktaedro | [Óh- (141) -Δ8-closo] |
| 6 | triprismo | |
| 8 | antiprismo | |
| 8 | dodecahedro | [D2d- (2222) -Δ6-closo] |
| 12 | icosahedro | [Jáh- (1551) -Δ20-closo] |
Příklady:
dekarbonyldimangan 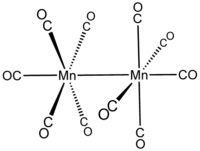 bis (pentakarbonylmangan)) (Mn—Mn)
bis (pentakarbonylmangan)) (Mn—Mn)
dodekakarbonyltetrarhodium 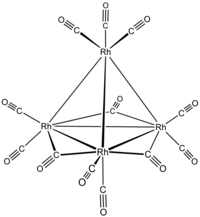 tri-μ-karbonyl-1: 2κ2C; 1: 3κ2C; 2: 3κ2C-na-karbonyl-1K2C, 2κ2C, 3κ2C, 4κ3C-[Td- (13) -Δ4-closo] -tetrarhodium (6 Rh—Rh)
tri-μ-karbonyl-1: 2κ2C; 1: 3κ2C; 2: 3κ2C-na-karbonyl-1K2C, 2κ2C, 3κ2C, 4κ3C-[Td- (13) -Δ4-closo] -tetrarhodium (6 Rh—Rh)
nebo tri-μ-karbonyl-1: 2κ2C; 1: 3κ2C; 2: 3κ2C-na-karbonyl-1K2C, 2κ2C, 3κ2C, 4κ3C-tetrahedro-tetrarhodium (6 Rh—Rh)
Anorganické kyseliny
Názvy vodíku
Doporučení zahrnují popis vodíkových názvů kyselin. Následující příklady ilustrují metodu:
- HNO3 vodík (dusičnan)
- H2TAK4 dihydrogen (síran)
- HSO4− vodík (síran) (2−)
- H2S dihydrogen (sulfid)
Všimněte si, že rozdíl od metody kompozičního pojmenování (sirovodík), jako je tomu u pojmenování vodíku, mezi elektropozitivními a elektronegativními složkami neexistuje ŽÁDNÝ prostor.
Tato metoda neposkytuje žádné strukturální informace týkající se polohy hydronů (atomů vodíku). Pokud mají být tyto informace poskytnuty, měl by být použit název přísady (příklady viz níže uvedený seznam).
Seznam přijatelných jmen
Doporučení poskytují úplný seznam přijatelných názvů běžných kyselin a souvisejících aniontů. Níže je uveden výběr z tohoto seznamu.
| kyselé přijatelné jméno | související anionty - přijatelné názvy a názvy přísad | ||
|---|---|---|---|
| kyselina boritá, [B (OH)3] | dihydrogenborát, [BO (OH)2]− dihydroxidooxidoborát (1—) | hydrogenboritan, [BO2(ACH)]2− hydroxidodioxidoborát (2—) | boritan, [BO3]3− trioxidoborát (3—) |
| kyselina uhličitá, [CO (OH)2] | hydrogenuhličitan, [CO2(ACH)]− hydroxidodioxidokarbonát (1−) | uhličitan, [CO3]2− trioxidocarbonate (2−) | |
| kyselina chlorovodíková, [ClO2(ACH)] hydroxidodioxidochlor | chlorečnan, [ClO3]− trioxidochlorát (1−) | ||
| kyselina chloritá, [ClO (OH)] hydroxidooxidochlor | chloritan, [ClO2]− dioxidochlorát (1−) | ||
| kyselina dusičná, [NE2(ACH)] hydroxidodioxidonitrogen | dusičnan, [č3−] trioxidonitrát (1−) | ||
| kyselina dusitá, [NO (OH)] hydroxidoxidonitrogen | dusitany, [č2]− dioxidonitrát (1−) | ||
| kyselina chloristá, [ClO3(ACH)] hydroxidotrioxidochlorin | chloristan, [ClO4]− tetraoxidochlorát (1−) | ||
| kyselina fosforečná, [PO (OH)3] trihydroxidooxidofosfor | dihydrogenfosfát, [PO2(ACH)2]− dihydroxidodioxidofosfát (1−) | hydrogenfosforečnan, [PO3(ACH)]2− hydroxidotrioxidofosfát (2−) | fosfát, [PO4]3− tetraoxidofosfát (3—) |
| kyselina fosfonová, [PHO (OH)2] hydridodihydroxidooxidofosfor | hydrogenfosfonát, [PHO2(ACH)]− hydridohydroxidodioxidofosfát (1−) | fosfonát, [PHO3]2− hydridotrioxidofosfát (2−) | |
| kyselina fosforitá, H3PO3 trihydroxidofosfor | dihydrogenfosforitan [PO (OH)2]− dihydroxidooxidofosfát (1−)) | hydrogenfosforitan, [PO2(ACH)]2− hydroxidodioxidofosfát (2−) | fosfit, [PO3]3− trioxidofosfát (3−) |
| kyselina sírová, [SO2(ACH)2] dihydroxidodioxidosulfur | hydrogensulfát, [SO3(ACH)]− hydroxidotrioxidosulfát (1−) | síran, [SO4]2− tetraoxidosulfát (2−) | |
Pevné látky
Stechiometrické fáze jsou pojmenovány kompozičně. Nestechiometrické fáze jsou obtížnější. Pokud je to možné, měly by se použít vzorce, ale je-li to nutné, lze použít následující názvy:
- sulfid železitý (nedostatek železa)
- dikarid molybdenu (nadbytek uhlíku)
Názvy minerálů
Obecně by se pro upřesnění chemického složení neměly používat názvy minerálů. Název minerálu však lze použít k určení typu struktury ve vzorci, např.
- BaTiO3 (perovskitový typ)
Přibližné vzorce a proměnlivé složení
Může být použita jednoduchá notace, pokud je k dispozici málo informací o mechanismu variability nebo není nutné ji sdělit:
- ~ FeS (přibližně nebo přibližně)
Pokud existuje souvislý rozsah složení, lze to napsat např. K (Br, Cl) pro směs KBr a KCl a (Li2, Mg) Cl2 pro směs LiCl a MgCl2Doporučení je použít následující obecnou metodu, např.
- CuXNi1 − x pro (Cu, Ni)
- KBrXCl1 − x pro K (Br, Cl)
Upozorňujeme, že volná místa kationů v CoO by mohla popsat CoO1 − x
Bodové vady (Kröger – Vink) notace
Bodové vady, symetrii místa a obsazenost místa lze popsat pomocí Kröger – Vinkova notace, upozorňujeme, že preferencí IUPAC je upřesnění volných pracovních míst PROTI spíše než V (prvek vanad).
Fázová nomenklatura
Chcete-li určit krystalickou formu sloučeniny nebo prvku, zadejte Pearsonův symbol může být použit. Použití Strukturbericht (např. A1 atd.) nebo řecká písmena jsou nepřijatelné. Za Pearsonovým symbolem může následovat vesmírná skupina a prototypový vzorec. Příklady:
- uhlík (cF 8), diamant
- RuAl (C.P22, Pm3m) (CsCl typ)
Polymorfismus
Doporučuje se identifikovat polymorfy (např. Pro ZnS, kde tyto dvě formy tvoří zinekblende (kubický) a wurtzit (šestihranný)) jako ZnS (C) a ZnS (h).
Poznámky a odkazy
- ^ Názvosloví anorganické chemie Doporučení IUPAC 2005 vyd. N. G. Connelly a kol. Publikování RSC http://www.chem.qmul.ac.uk/iupac/bioinorg/
- ^ Názvosloví anorganické chemie Doporučení IUPAC 2005 - Celý text (PDF)
- ^ Opravy názvosloví anorganické chemie: Doporučení IUPAC 2005
- ^ "Systém deskriptorů a principy číslování uzavřených bórových mnohostěnů s alespoň jednou osou symetrie otáčení a jednou rovinou symetrie". Casey J.B., Evans W.J., Powell W.H. Inorg. Chem., 20, 5,(1981), 1333–1341 doi:10.1021 / ic50219a001
