Mikrobiální symbióza a imunita - Microbial symbiosis and immunity
tento článek vyžaduje pozornost odborníka na toto téma. Specifický problém je: obsah nesoustředěný, špatná struktura, hromadně napsaný nezkušeným editorem studentů. (Února 2017) |

Dlouhodobé uzavřené interakce mezi symbiotickými mikroby a jejich hostitelem mohou změnit reakce imunitního systému hostitele na jiné mikroorganismy, včetně patogeny, a jsou povinni udržovat správné homeostáza.[1] The imunitní systém je obranný systém hostitele skládající se z anatomických fyzických bariér a fyziologických a buněčných odpovědí, které chrání hostitel proti škodlivým mikroorganismům a zároveň omezuje reakce hostitele na neškodné symbionty. Lidé jsou domovem 1013 do 1014 bakterie, zhruba ekvivalentní počtu lidských buněk,[2] a zatímco tyto bakterie mohou být pro svého hostitele patogenní, většina z nich je Vzájemně prospěšné hostiteli i bakteriím.
Lidský imunitní systém se skládá ze dvou hlavních typů imunity: vrozené a adaptivní. The vrozený imunitní systém je vyroben z nespecifických obranných mechanismů proti cizím buňkám uvnitř hostitele, včetně kůže jako fyzické bariéry vstupu, aktivace doplňujte kaskádu - identifikovat cizí bakterie a aktivovat nezbytné buněčné reakce a - bílé krvinky které odstraňují cizí látky. The adaptivní imunitní systém nebo získaný imunitní systém je imunitní odpověď specifická pro patogen, kterou provádí lymfocyty přes prezentace antigenu na Molekuly MHC rozlišovat mezi já a ne-já antigeny.
Mikroby mohou podporovat vývoj imunitního systému hostitele ve střevech a kůži a mohou pomáhat při prevenci patogeny před invazí. Některé uvolňují protizánětlivé produkty chránící před parazitickými střevními mikroby. Commensals podporovat rozvoj B buňky které produkují ochrannou protilátku, Imunoglobulin A (IgA). To může neutralizovat patogeny a exotoxiny a podporují vývoj imunitních buněk a slizniční imunitní odpověď. Mikroby se však podílejí na lidských onemocněních včetně zánětlivé onemocnění střev, obezita a rakovina.
Obecné zásady
Tato sekce potřebuje expanzi. Můžete pomoci přidávat k tomu. (Březen 2017) |
Mikrobiální symbióza spoléhá na mezidruhová komunikace.[3]mezi hostitelem a mikrobiálními symbionty. Imunita byla historicky charakterizována v mnohobuněčné organismy jako pod kontrolou imunitního systému hostitele, kde vnímaná cizí látka nebo buňka stimuluje imunitní odpověď. Konečný výsledek této reakce se může lišit od odstranění škodlivého patogenu po toleranci prospěšného mikrobu k autoimunitní odpověď který škodí samotnému hostiteli.
Symbiotické mikroorganismy se v poslední době také podílejí na této imunitní odpovědi, což naznačuje, že imunitní odpověď není izolována pouze na hostitelské buňky. Tyto prospěšné mikroorganismy se mimo jiné podílejí na inhibici růstu patogenů ve střevě a na protirakovinovou imunitu.
Gastrointestinální trakt
Člověk gastrointestinální trakt (GI trakt) se skládá z ústa, hltan, jícen, žaludek, tenké střevo, a tlusté střevo, a je to 9 metrů dlouhá souvislá trubice; největší povrch těla vystavený vnějšímu prostředí. Střevo poskytuje mikrobům živiny a ochranu, což jim umožňuje prospívat s intestinální mikrobiální komunitou 1014 prospěšné a patogenní bakterie, archaea, viry, a eukaryoty. Na oplátku mnoho z těchto mikrobů dokončí důležité funkce pro hostitele, včetně rozpadu vlákniny[4] a výroba vitamíny[5] kde střevní mikroby mají alespoň roli při produkci vitamínů, jako je A, B2, B3, B5, B12, C, D a K..
V lidském střevě imunitní systém přichází do styku s velkým množstvím cizích mikrobů, jak prospěšných, tak patogenních. Imunitní systém je schopen chránit hostitele před těmito patogenními mikroby, aniž by zahájil zbytečné a škodlivé imunitní reakce na podněty. Gastrointestinální mikrobiota má přímý účinek na imunitní reakce lidského těla. což znamená, že pro zdravý imunitní systém hostitele je nezbytná pravidelná mikroflóra, protože tělo je náchylnější k infekčním a neinfekčním látkám nemoci.
Regulace imunitních odpovědí
Komensální bakterie v GI traktu přežívají navzdory hojnosti místních imunitních buněk.[6] Homeostáza ve střevě vyžaduje stimulaci mýtné receptory komenzálními mikroby.[6] Když jsou myši chovány v podmínkách bez zárodků, chybí jim cirkulující protilátky a nemohou produkovat hlen, antimikrobiální proteiny nebo slizniční T-buňky.[6] Navíc chybí myši chované v podmínkách bez zárodků tolerance a často trpí hypersenzitivní reakce.[6] Zrání GI traktu je zprostředkováno receptory rozpoznávání vzoru (PRR), které rozpoznávají sebe sama s patogeny spojené molekulární vzorce (PAMP) včetně komponent bakteriálních buněčných stěn a nukleových kyselin.[7] Tato data naznačují, že komenzální mikroby pomáhají při střevní homeostáze a vývoji imunitního systému.[6]
Aby se zabránilo neustálé aktivaci imunitních buněk a výslednému zánětu, vyvinuli se hostitelé a bakterie, které udržují střevní homeostázu a vývoj imunitního systému.[8] Například lidský symbiont Bacteroides fragilis produkuje polysacharid A (PSA), na který se váže mýtný receptor 2 (TLR-2) zapnuto CD4+ T buňky.[9] Zatímco signalizace TLR2 může aktivovat clearance peptidů, PSA indukuje protizánětlivou reakci, když se váže na TLR2 na CD4+ T buňky.[9] Prostřednictvím vazby TLR2 potlačuje PSA prozánětlivé reakce TH17 a podporuje je tolerance a zavedení komenzální střevní kolonizace.[9]
Komenzální střevní mikroby vytvářejí různé metabolity, které se vážou aryl uhlovodíkové receptory (AHR). AHR je ligandem indukovatelný transkripční faktor nacházející se v imunitních a epiteliálních buňkách a vazba AHR je nutná pro normální imunitní aktivaci, protože bylo prokázáno, že nedostatek vazby AHR způsobuje nadměrnou aktivaci imunitních buněk.[1] Tyto mikrobiální metabolity jsou zásadní pro ochranu hostitele před zbytečným zánětem ve střevě.
Vývoj izolovaných lymfoidních tkání
Mikroby vyvolávají vývoj izolovaných lymfoidní folikuly v tenkém střevě lidí a myší, což jsou místa slizniční imunitní odpovědi. Izolované lymfoidní folikuly (ILF) shromažďují antigeny M buňky, rozvíjet zárodečná centra a obsahují mnoho B buněk.[10] Gramnegativní komenzální bakterie uvolněním vyvolávají vývoj indukovatelných lymfoidních folikulů peptidogylkany obsahující kyselina diaminopimelová během buněčného dělení.[10] Peptidoglykany se vážou na NOD1 receptor zapnutý střevní epiteliální buňky.[10] Výsledkem je exprese intestinálních epiteliálních buněk chemokinový ligand 20 (CCL20) a Beta defensin 3.[10] CCL20 a Beta-defensin 3 aktivovat buňky, které zprostředkovávají vývoj izolovaných lymfoidních tkání, včetně buněk indukujících lymfoidní tkáň a buněk organizátorů lymfoidní tkáně.[10]
Kromě toho existují další mechanismy, kterými komenzály podporují zrání izolovaných lymfoidních folikulů. Například se vážou komenzální bakteriální produkty TLR2 a TLR4, jehož výsledkem je NF-kB zprostředkovaný přepis TNF, který je nutný pro zrání zralých izolovaných lymfoidních folikulů.[11]
Ochrana proti patogenům
Mikroby mohou zabránit růstu škodlivých patogenů změnou pH, spotřebovávání živin potřebných pro přežití patogenů a vylučováním toxinů a protilátek, které inhibují růst patogenů.[12]
Imunoglobulin A
IgA zabraňuje vstupu a kolonizaci patogenních bakterií ve střevě. Lze jej nalézt jako monomer, dimer nebo tetramer, což mu umožňuje vázat více antigenů současně.[13] IgA pokrývá patogenní bakteriální a virové povrchy (imunitní vyloučení), brání kolonizaci blokováním jejich připojení k buňkám sliznice a může také neutralizovat PAMP.[8][14] IgA podporuje rozvoj TH17 a FOXP3 + regulační T buňky.[15][16] Vzhledem k jeho kritické funkci v GI traktu je počet plazmatických buněk vylučujících IgA v jejunum je větší než celková populace plazmatických buněk kostní dřeň, lymfy, a slezina kombinovaný.[13]
Signály odvozené z mikrobioty přijímají plazmatické buňky vylučující IgA do slizničních míst.[8] Například bakterie na apikálních površích epiteliálních buněk jsou fagocytovány dendritické buňky umístěné pod peyerovy záplaty a v lamina propria, což nakonec vede k diferenciaci B buněk na plazmatické buňky, které vylučují IgA specifické pro střevní bakterie.[17] Úloha signálů odvozených z mikrobioty při náboru plazmatických buněk vylučujících IgA byla potvrzena v experimentech s prostými a specifickými patogeny ošetřenými antibiotiky a MyD88 KO myši, které mají omezené komenzály a sníženou schopnost reagovat na komenzály. Počet střevních CD11b+ IgA+ plazmatické buňky u těchto myší byla snížena, což naznačuje roli komenzálu při náboru plazmatických buněk vylučujících IgA.[18] Na základě těchto důkazů mohou komenzální mikroby chránit hostitele před škodlivými patogeny stimulací produkce IgA.
Antimikrobiální peptidy

Členové mikrobioty jsou schopni produkovat antimikrobiální peptidy, chrání člověka před nadměrným střevním zánětem a mikrobiálními chorobami. Různé provize (především Grampozitivní bakterie ), vylučovat bakteriociny, tvořící se peptidy, které se vážou na receptory na úzce souvisejících cílových buňkách iontově propustné kanály a póry v buněčné stěně.[19] Výsledný odtok metabolitů a obsahu buněk a rozptýlení iontové přechody způsobuje smrt bakteriálních buněk.[19] Bakteriociny však mohou také vyvolat smrt translokací do periplazmatického prostoru a nespecifickým štěpením DNA (kolicin E2), čímž deaktivují ribozom (kolicin E3), inhibující syntézu peptidoglykan, hlavní složka bakterie buněčná stěna (kolicin M).[19]
Bakteriociny mají obrovský potenciál k léčbě lidských onemocnění. Například průjem u lidí může být způsoben řadou faktorů, ale je často způsoben bakteriemi, jako je Clostridium difficile.[19] Microbispora kmen ATCC PTA-5024 vylučuje bakteriocinový mikrobisporicin, který zabíjí Clostridia cílením prostaglandin syntéza.[20] Kromě toho jsou bakteriociny obzvláště slibné kvůli rozdílům v mechanismech antibiotika což znamená mnoho bakterie rezistentní na antibiotika nejsou rezistentní na tyto bakteriociny. Například, in vitro růst rezistentní na meticilin S. aureus (MRSA) byl inhibován bakteriocinem nisin A, produkoval Lactococcus lactis.[19][21] Nisin A inhibuje rezistenci na methicilin S. aureus vazbou na prekurzor syntézy bakteriální buněčné stěny, lipid II. To brání schopnosti syntetizovat buněčnou stěnu, což vede ke zvýšené permeabilitě membrány, narušení elektrochemických gradientů a možné smrti.[22]
Opevnění fukózy
Střevní epitel u lidí je posílen sacharidy jako fukóza vyjádřeno na apikální povrch epiteliálních buněk.[23] Bacteroides thetaiotaomicron, bakteriální druh v ileum a dvojtečka, stimuluje gen kódování fukóza Fut2 ve střevních epiteliálních buňkách.[23] V této vzájemné interakci je intestinální epiteliální bariéra posílena a lidé jsou chráněni před invazí ničivých mikrobů, zatímco B. thetaiotaomicron výhody, protože může využívat fukózu k výrobě energie a její roli v regulaci bakteriálních genů.[23]
Kůže

The kožní mikrobiota je zásadní jako linie obrany proti infekci, fyzická bariéra mezi prostředím a vnitřkem hostitele. Komenzální mikroby, které žijí na kůži, jako např Staphylococcus epidermidis, vyrobit antimikrobiální peptidy (AMP), které podporují imunitní systém hostitele.[24] Tyto AMP signalizují imunitní odpovědi a udržují zánětlivé účinky homeostáza modulací vydání cytokiny.[24] S. epidermidis vylučuje malou molekulu AMP, což vede ke zvýšené expresi lidských β-defensinů.[24] S. epidermidis také stimuluje produkci T buněk IL-17A + CD8 +, což zvyšuje imunitu hostitele.[25]
Expozice těmto komenzálním bakteriím na počátku vývoje je zásadní pro toleranci těchto mikrobů vůči hostiteli, protože setkání T-buněk umožňují, aby během prezentace byla běžná prezentace komenzálního antigenu.[26] S. epidermidis a další důležité mikroflóry fungují podobně jako podpora homeostáza a obecné zdraví v oblastech celého lidského těla, jako je ústní dutina, pochva, gastrointestinální trakt, a orofaryngu.[24]
Role v nemoci
Rovnováhasymbionty a pathobionty jsou zásadní pro boj proti vnějším patogenům a pro zabránění mnoha škodlivým poruchám. Dysbióza nebo nerovnováha v bakteriálním složení střeva se podílí na zánětlivých onemocněních střev, obezitě a alergických onemocněních u lidí a jiných zvířat.[27]
Rakovina

V tom mohou hrát roli střevní mikroby rakovina rozvoj prostřednictvím různých mechanismů. Bakterie redukující síran produkují sirovodík, což má za následek genomický Poškození DNA.[28] Vyšší výskyt rakoviny tlustého střeva je spojen s vyšším množstvím bakterií snižujících obsah síranů ve střevě.[28] Dodatečně, anaerobní bakterie v transformaci tlustého střeva primární žlučové kyseliny na sekundární žlučovou kyselinu, která se podílí na kolorektální karcinogenezi.[28] Střevní bakterie metabolity jako mastné kyseliny s krátkým řetězcem (SCFA), Vitamíny skupiny B. a N1, N12-diacetylspermin se také podílí na potlačení kolorektálního karcinomu.[1] Gramnegativní bakterie vyrobit lipopolysacharid (LPS), na které se váže TLR-4 a skrz TGF-p signalizace vede k expresi růstových faktorů a zánětlivých mediátorů, které podporují neoplazie.[28]
Ukázalo se, že členů zdravého střevního mikrobiomu přibývá interferon-y -produkce CD8 T-buňky a infiltrující nádory dendritické buňky (TIL) ve střevě.[29] Tyto CD8 T-buňky nejen zvyšují odolnost proti intracelulární patogeny jako Listeria monocytogenes ale také se ukázalo, že jsou důležité v protirakovinové imunitě, konkrétně proti MC38 adenokarcinom kde spolu s TIL rostou MHC I. výraz.[29]
Alergické a imunitní poruchy
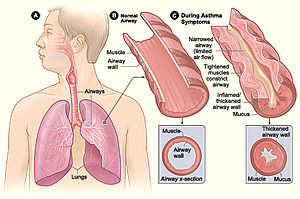
Lidský mikrobiom pozitivně moduluje imunitu hostitele, aby se pomohl bránit před potenciálními patogeny, ale může také vést k nadměrné imunitní reakci na cizí látky, dokonce někdy napadající samotného hostitele. Zánětlivé onemocnění střev (IBD) a astma jsou dvě poruchy, u nichž bylo zjištěno, že jsou ovlivňovány metabolity mikrobioty způsobujícími imunitní reakce. Mastné kyseliny s krátkým řetězcem (SCFA) byly spojeny se snížením alergického zánětu u astmatu[30] zatímco se ukázalo, že jak SCFA, tak vitamíny B snižují zánět IBD.[31]
SCFA (acetát, butyrát a propionát ) jsou metabolity vytvořené bakteriemi ve střevě, tyto molekuly pak inhibují histonové deacetylázy (HDAC) a také Receptory spojené s G proteinem, jednat jako signální molekuly.[1] Inhibice HDAC snižuje regulaci jaderný faktor-κB (NF-κB) a prozánětlivé faktor nekrózy nádorů (TNF) stejně jako mají protizánětlivé účinky na makrofágy a dendritické buňky.[1]
Aktivace slizniční imunity a střevní mikroflóry může přispět k zánětlivému onemocnění střev. Mnoho bakterií způsobuje zánět ve střevech včetně Escherichia coli, které se replikují v makrofágy a vylučuje cytokin faktor nekrózy nádorů.[32] Některé bakterie, včetně lidského symbiontu B. fragilis, může zabránit kolitida produkcí polysacharid A (PSA).[33] PSA indukuje produkci IL-10, imunosupresivní cytokin, který potlačuje zánět.[34] Léčba dendritických buněk odvozených z kostní dřeně a naivního CD4+ T buňky s purifikovaným PSA vedly ke zvýšené produkci IL-10.[34]
K napodobení kolitidy a aktivaci zánětlivých T buněk za experimentálních podmínek byly myši divokého typu ošetřeny kyselinou trinitrobenzensulfonovou (TNBS).[34] Poté byly těmto myším perorálně podány PSA. Prozánětlivá exprese cytokinů (IL-17a a TNFa ) v CD4+ buňky byly měřeny pomocí ELISA. Vědci zjistili, že ve srovnání s CD4+ buňky kontrolních myší, CD4+ buňky u myší ošetřených PSA produkovaly snížené hladiny prozánětlivých cytokinů IL-17a a TNFa.[34] Dále po střevní kolonizaci s B. fragilis, IL-23 vyjádření splenocyty byl výrazně snížen.[34] Tyto údaje naznačují, že PSA vylučuje B. fragilis potlačuje zánětlivý proces během kolitidy tím, že vede ke zvýšené produkci IL-10 a snížené produkci IL-17, TNFa a IL-23.[34]
Komensální bakterie mohou také regulovat imunitní odpovědi, které způsobují alergie. Například stimulují komenzální bakterie TLR4, které mohou inhibovat alergické reakce na potraviny.[35]
Metabolické poruchy
Bylo zjištěno, že hlavní metabolická onemocnění jsou ovlivňována metabolity střevní mikroflóry, včetně srdeční choroba, nemoc ledvin, cukrovka typu 2 a obezita.[1] Členění L-karnitin z červeného masa střevními mikroby do trimethylamin-N-oxid (TMAO) byl spojen s ateroskleróza, což může vést k obezitě, srdečním onemocněním a cukrovce 2. typu[36] zatímco srdeční i ledvinové onemocnění lze předpovědět podle vysokého zdarma p-kresol úrovně.[37] SCFA modulují sekreci reninu vazbou Olfr78, snižují krevní tlak a snižují riziko onemocnění ledvin.[38]
Studie na myších bez zárodků naznačují, že absence střevních mikrobů chrání před obezitou.[39] Zatímco přesný mechanismus, kterým mikroby hrají roli v obezitě, ještě nebyl objasněn, předpokládá se, že střevní mikrobiota se podílí na přeměně potravy na využitelnou energii a ukládání tuku.[39]
Neurologické poruchy
Střevní mikrobiota ovlivňuje mnoho aspektů lidského zdraví, dokonce i neurologické poruchy, které mohou být způsobeny nerovnováhou molekul nebo hormonů. Porucha autistického spektra (ASD),[1] dysfunkce centrálního nervového systému[1] a Deprese[40] bylo zjištěno, že je mikrobiota ovlivněna.

Zatímco ASD je pravidelně popisována rozdíly v chování, může se také projevovat gastrointestinálními příznaky.[41] U některých jedinců s ASD byla zaznamenána dysbióza GI traktu, což vedlo ke zvýšené střevní propustnosti.[41] U myšího modelu byla u myší s dysbiózou ASD a GI traktu (imunitní aktivace matky) zjištěna zvýšená střevní propustnost, jak byla korigována zavedením lidského bakteriálního symbiontu do střev B. fragilis.[41]
Vývoj mikroglií hraje klíčovou roli v dysfunkci centrálního nervového systému, reguluje bakteriální metabolit SCFA mikroglie homeostáza, která je zásadní pro pravidelný vývoj CNS.[42] Pro vývoj mozku je také klíčové vytváření těsných spojů v hematoencefalická bariéra za účelem kontroly průchodu mezi krví a mozkem. Myši bez zárodků mají zvýšenou propustnost hematoencefalické bariéry v důsledku snížené exprese proteinů s těsným spojením okluzin a claudin-5 ve srovnání s normálními myšími střevními mikrobioty.[43]
Butyrát -produkující bakterie a dopamin metabolit Kyselina 3,4-dihydroxyfenyloctová byly spojeny s vyššími ukazateli kvality života, zatímco kyselina y-aminomáselná souvisí s vyšší úrovní deprese.[40]
Reference
- ^ A b C d E F G h Rooks, Michelle G .; Garrett, Wendy S. (2016-05-27). "Střevní mikrobiota, metabolity a imunita hostitele". Recenze přírody Imunologie. 16 (6): 341–352. doi:10.1038 / nri.2016.42. ISSN 1474-1733. PMC 5541232. PMID 27231050.
- ^ Mazmanian, Sarkis (2006). „Vztah lásky a nenávisti mezi bakteriálními polysacharidy a imunitním systémem hostitele“. Recenze přírody Imunologie. 849–858 (11): 849–858. doi:10.1038 / nri1956. PMID 17024229. S2CID 20380038.
- ^ McKenney David; Brown Kathryn; Allison David (1995). „Vliv Pseudomonas aeruginosa Exoproducts na produkci faktoru virulence v Burkholderia cepacia: Důkazy mezidruhové komunikace“. Journal of Bacteriology. 177 (23): 6989–6991. doi:10.1128 / jb.177.23.6989-6992.1995. PMC 177571. PMID 7592496.
- ^ Holscher, Hannah D. (03.03.2017). "Dietní vláknina a prebiotika a gastrointestinální mikrobiota". Střevní mikroby. 8 (2): 172–184. doi:10.1080/19490976.2017.1290756. ISSN 1949-0984. PMC 5390821. PMID 28165863.
- ^ LeBlanc, Jean Guy; Milani, Christian; de Giori, Graciela Savoyová; Sesma, Fernando; van Sinderen, Douwe; Ventura, Marco (duben 2013). „Bakterie jako dodavatelé vitamínů pro svého hostitele: perspektiva střevní mikrobioty“. Aktuální názor na biotechnologie. 24 (2): 160–168. doi:10.1016 / j.copbio.2012.08.005. ISSN 1879-0429. PMID 22940212.
- ^ A b C d E Brown, E.M. (2013). „Nový pohled na hygienickou hypotézu: Jak intestinální mikrobiální expozice ovlivňuje imunitní efektorové reakce u atopického onemocnění“. Semináře z imunologie. 25 (5): 378–387. doi:10.1016 / j.smim.2013.09.003. PMID 24209708.
- ^ Palm, Noah W .; de Zoete, Marcel R .; Flavell, Richard A. (srpen 2015). „Interakce imunomikrobiota ve zdraví a nemoci“. Klinická imunologie. 159 (2): 122–127. doi:10.1016 / j.clim.2015.05.014. ISSN 1521-6616. PMC 4943041. PMID 26141651.
- ^ A b C Cerf-Bensussan, Nadine; Gaboriau-Routhiau, Valérie (01.10.2010). „Imunitní systém a střevní mikrobiota: přátelé nebo nepřátelé?“. Recenze přírody Imunologie. 10 (10): 735–744. doi:10.1038 / nri2850. PMID 20865020. S2CID 13257259.
- ^ A b C Kolo, červen L .; Lee, S. Melanie; Li, Jennifer; Tran, Gloria; Jabri, Bana; Chatila, Talal A .; Mazmanian, Sarkis K. (2011-05-20). „Toll-like receptorová dráha zavádí komenzální střevní kolonizaci“. Věda. 332 (6032): 974–977. doi:10.1126 / science.1206095. PMC 3164325. PMID 21512004.
- ^ A b C d E Eberl, G .; Lochner, M. (09.09.2009). „Vývoj střevních lymfoidních tkání na rozhraní sebe a mikrobioty“. Slizniční imunologie. 2 (6): 478–485. doi:10.1038 / mi.2009.114. PMID 19741595.
- ^ Bouskra, Djahida; Brézillon, Christophe; Bérard, Marion; Werts, Catherine; Varona, Rosa; Boneca, Ivo Gomperts; Eberl, Gérard (2008-11-27). „Geneze lymfoidní tkáně indukovaná komenzály prostřednictvím NOD1 reguluje střevní homeostázu“. Příroda. 456 (7221): 507–510. Bibcode:2008Natur.456..507B. doi:10.1038 / nature07450. PMID 18987631. S2CID 205215248.
- ^ Kamada, N (2013). "Kontrola patogenů a patobiontů střevní mikroflórou". Přírodní imunologie. 14 (7): 685–690. doi:10.1038 / ni.2608. PMC 4083503. PMID 23778796.
- ^ A b Kuby Imunology. str. 90–92. ISBN 9781429203944.
- ^ Mantis, N.J .; Rol, N .; Corthésy, B. (01.11.2011). „Komplexní role sekrečních IgA v imunitě a homeostáze sliznice ve střevě“. Slizniční imunologie. 4 (6): 603–611. doi:10.1038 / mi.2011.41. PMC 3774538. PMID 21975936.
- ^ Macpherson, AJ (2008). „Imunitní geografie indukce a funkce IgA“. Slizniční imunologie. 1 (1): 11–22. doi:10.1038 / mi.2007.6. PMID 19079156.
- ^ Kamada, N (2013). "Role střevní mikroflóry v imunitě a zánětlivých onemocněních". Recenze přírody Imunologie. 13 (5): 321–335. doi:10.1038 / nri3430. PMID 23618829. S2CID 205491968.
- ^ Hooper Lora V., Bry Lynn, Falk Per G., Gordon Jeffrey I. (1998). „Host – mikrobiální symbióza ve střevě savce: zkoumání vnitřního ekosystému“. BioEssays. 20 (4): 336–343. doi:10.1002 / (sici) 1521-1878 (199804) 20: 4 <336 :: aid-bies10> 3.3.co; 2-j. PMID 9619105.CS1 maint: více jmen: seznam autorů (odkaz)
- ^ Kunisawa, červen; Gohda, Masashi; Hashimoto, Eri; Ishikawa, Izumi; Higuchi, Morio; Suzuki, Yuji; Goto, Yoshiyuki; Panea, Casandra; Ivanov, Ivaylo I. (2013-04-23). „Mikrobiálně závislé plazmatické buňky CD11b + IgA + zprostředkovávají robustní počáteční intestinální IgA odpovědi u myší“. Příroda komunikace. 4: 1772. Bibcode:2013NatCo ... 4,1772 tis. doi:10.1038 / ncomms2718. PMC 3644083. PMID 23612313.
- ^ A b C d E Hammami, Riadh; Fernandez, Benoit; Lacroix, Christophe; Fliss, Ismail (2012-10-30). "Antiinfekční vlastnosti bakteriocinů: aktualizace". Buněčné a molekulární biologické vědy. 70 (16): 2947–2967. doi:10.1007 / s00018-012-1202-3. PMID 23109101. S2CID 16228657.
- ^ Castiglione, Franca; Lazzarini, Ameriga; Carrano, Lucia; Corti, Emiliana; Ciciliato, Ismaela; Gastaldo, Luciano; Candiani, Paolo; Losi, Daniele; Marinelli, Flavia (2008-01-25). „Stanovení struktury a způsobu působení mikrobisporicinu, silného lantibiotika aktivního proti multirezistentním patogenům“. Chemie a biologie. 15 (1): 22–31. doi:10.1016 / j.chembiol.2007.11.009. PMID 18215770.
- ^ Piper, C .; Draper, L. A .; Cotter, P. D .; Ross, R. P .; Hill, C. (2009-09-01). „Srovnání aktivit lacticinu 3147 a nisinu proti lékům odolným druhům Staphylococcus aureus a Enterococcus“. Journal of Antimicrobial Chemotherapy. 64 (3): 546–551. doi:10.1093 / jac / dkp221. PMID 19561147.
- ^ Hsu, Shang-Te D .; Breukink, Eefjan; Tischenko, Eugene; Lutters, Mandy A. G .; de Kruijff, Ben; Kaptein, Robert; Bonvin, Alexandre M. J. J .; van Nuland, Nico A. J. (01.10.2004). „Komplex nisin-lipid II odhaluje pyrofosfátovou klec, která poskytuje plán pro nová antibiotika“. Přírodní strukturní a molekulární biologie. 11 (10): 963–967. doi:10.1038 / nsmb830. hdl:1874/385449. PMID 15361862. S2CID 13181577.
- ^ A b C Goto, Yoshiyuki; Kiyono, Hiroshi (2012). "Epiteliální bariéra: rozhraní pro vzájemnou komunikaci mezi střevní flórou a imunitním systémem". Imunologické recenze. 245 (1): 147–163. doi:10.1111 / j.1600-065X.2011.01078.x. PMID 22168418.
- ^ A b C d Gallo Richard L., Nakatsuji Teruaki (2011). „Mikrobiální symbióza s vrozeným imunitním obranným systémem kůže“. Journal of Investigative Dermatology. 131 (10): 1974–1980. doi:10.1038 / jid.2011.182. PMC 3174284. PMID 21697881.
- ^ Naik, Shruti; Bouladoux, Nicolas; Linehan, Jonathan L .; Han, Seong-Ji; Harrison, Oliver J .; Wilhelm, Christoph; Conlan, Sean; Himmelfarb, Sarah; Byrd, Allyson L .; Deming, Clayton; Quinones, Mariam (02.04.2015). „Interakce Commensal – dendritické buňky specifikuje jedinečný ochranný imunitní podpis pokožky“. Příroda. 520 (7545): 104–108. Bibcode:2015Natur.520..104N. doi:10.1038 / příroda14052. ISSN 0028-0836. PMC 4667810. PMID 25539086.
- ^ Scharschmidt, Tiffany C. (leden 2017). „Stanovení tolerance vůči komenzálním bakteriím kůže: načasování je všechno“. Dermatologické kliniky. 35 (1): 1–9. doi:10.1016 / j.det.2016.07.007. ISSN 0733-8635. PMC 5130113. PMID 27890233.
- ^ DeGruttola, Arianna K .; Low, Daren; Mizoguchi, Atsushi; Mizoguchi, Emiko (2017-02-25). „Současné chápání dysbiózy u nemocí u lidských a zvířecích modelů“. Zánětlivá onemocnění střev. 22 (5): 1137–1150. doi:10.1097 / MIB.0000000000000750. PMC 4838534. PMID 27070911.
- ^ A b C d Hullar, Meredith A. J .; Burnett-Hartman, Andrea N .; Lampe, Johanna W. (01.01.2014). Střevní mikroby, strava a rakovina. Léčba rakoviny a výzkum. 159. 377–399. doi:10.1007/978-3-642-38007-5_22. ISBN 978-3-642-38006-8. ISSN 0927-3042. PMC 4121395. PMID 24114492.
- ^ A b Tanoue, Takeshi; Morita, Satoru; Plichta, Damian R .; Skelly, Ashwin N .; Suda, Wataru; Sugiura, Yuki; Narushima, Seiko; Vlamakis, Hera; Motoo, Iori; Sugita, Kayoko; Shiota, Atsushi (leden 2019). "Definované komenzální konsorcium vyvolává CD8 T buňky a protirakovinnou imunitu". Příroda. 565 (7741): 600–605. Bibcode:2019Natur.565..600T. doi:10.1038 / s41586-019-0878-z. ISSN 1476-4687. PMID 30675064. S2CID 59159425.
- ^ Min, Booki (2014-02-18). „Fakulta hodnocení 1000 pro metabolismus střevní mikroflóry ve vláknině ovlivňuje alergické onemocnění dýchacích cest a krvetvorbu“. doi:10,3410 / f. 718228193,793491060. Citovat deník vyžaduje
| deník =(Pomoc) - ^ Singh, Nagendra; Gurav, Ashish; Sivaprakasam, Sathish; Brady, Evan; Padia, Ravi; Shi, Huidong; Thangaraju, Muthusamy; Prasad, Puttur D .; Manicassamy, Santhakumar; Munn, David H .; Lee, Jeffrey R. (leden 2014). „Aktivace Gpr109a, receptoru pro niacin a komensální metabolit butyrát, potlačuje zánět tlustého střeva a karcinogenezi“. Imunita. 40 (1): 128–139. doi:10.1016 / j.immuni.2013.12.007. ISSN 1074-7613. PMC 4305274. PMID 24412617.
- ^ Sartor, R. Balfour; Mazmanian, Sarkis K. (01.07.2012). "Střevní mikroby u zánětlivých onemocnění střev". The American Journal of Gastroenterology Supplement. 1 (1): 15–21. doi:10.1038 / ajgsup.2012.4.
- ^ Kolo, červen L .; Mazmanian, Sarkis K. (2017-02-16). „Střevní mikrobiom utváří střevní imunitní odpovědi během zdraví a nemoci“. Recenze přírody Imunologie. 9 (5): 313–323. doi:10.1038 / nri2515. PMC 4095778. PMID 19343057.
- ^ A b C d E F Mazmanian, Sarkis K .; Kolo, červen L .; Kasper, Dennis L. (2008). „Faktor mikrobiální symbiózy předchází zánětlivému onemocnění střev“. Příroda. 453 (7195): 620–625. Bibcode:2008 Natur.453..620M. doi:10.1038 / nature07008. PMID 18509436. S2CID 205213521.
- ^ Bashir, Mohamed Elfatih H .; Louie, Steve; Shi, Hai Ning; Nagler-Anderson, Cathryn (01.06.2004). „Signalizace mýtného receptoru 4 střevními mikroby ovlivňuje náchylnost k potravinové alergii“. Journal of Immunology. 172 (11): 6978–6987. doi:10,4049 / jimmunol.172.11.6978. PMID 15153518.
- ^ Terry, Paul; Chen, Jiangang (11.04.2013). „Fakulta hodnocení 1000 pro metabolismus l-karnitinu ve střevní mikroflóře, živiny v červeném mase, podporuje aterosklerózu“. doi:10,3410 / f. 717998892,793474469. Citovat deník vyžaduje
| deník =(Pomoc) - ^ Meijers, Björn K.I .; Claes, Kathleen; Bammens, Bert; de Loor, Henriette; Viaene, Liesbeth; Verbeke, Kristin; Kuypers, Dirk; Vanrenterghem, Yves; Evenepoel, Pieter (červenec 2010). „p-kresol a kardiovaskulární riziko u mírných až středně závažných onemocnění ledvin“. Klinický časopis Americké nefrologické společnosti. 5 (7): 1182–1189. doi:10,2215 / CJN.07971109. ISSN 1555-9041. PMC 2893077. PMID 20430946.
- ^ Persson, A Erik G; Carlström, Mattias (21.05.2013). „Fakulta hodnocení 1000 pro čichový receptor reagující na signály odvozené ze střevní mikrobioty hraje roli v sekreci reninu a regulaci krevního tlaku“. doi:10,3410 / f. 717978217,793476920. Citovat deník vyžaduje
| deník =(Pomoc) - ^ A b Mykání, Simon; Verbeke, Kristin; Vipond, Daniel T .; Corfe, Bernard M .; Owen, Lauren J. (02.02.2015). "Dysbióza střevní mikrobioty v nemoci". Mikrobiální ekologie ve zdraví a nemocech. 26: 26191. doi:10,3402 / mehd.v26.26191. ISSN 0891-060X. PMC 4315779. PMID 25651997.
- ^ A b Valles-Colomer, Mireia; Falony, Gwen; Darzi, Youssef; Tigchelaar, Ettje F .; Wang, červen; Tito, Raul Y .; Schiweck, Carmen; Kurilshikov, Alexander; Joossens, Marie; Wijmenga, Cisca; Claes, Stephan (duben 2019). „Neuroaktivní potenciál lidské střevní mikrobioty v kvalitě života a depresi“. Přírodní mikrobiologie. 4 (4): 623–632. doi:10.1038 / s41564-018-0337-x. ISSN 2058-5276. PMID 30718848. S2CID 59603019.
- ^ A b C Hsiao, Elaine Y .; McBride, Sara W .; Hsien, Sophia; Sharon, Gil; Hyde, Embriette R .; McCue, Tyler; Codelli, Julian A .; Chow, Janet; Reisman, Sarah E .; Petrosino, Joseph F .; Patterson, Paul H. (2013-12-19). „Mikrobiota moduluje fyziologii střev a abnormality chování spojené s autismem“. Buňka. 155 (7): 1451–1463. doi:10.1016 / j.cell.2013.11.024. ISSN 0092-8674. PMC 3897394. PMID 24315484.
- ^ Davidovic, Laetitia (2015-06-22). „Fakulta hodnocení 1000 pro hostitelské mikrobioty neustále kontroluje zrání a funkci mikroglií v CNS“. doi:10,3410 / f.725528105,793507643. Citovat deník vyžaduje
| deník =(Pomoc) - ^ Braniste, Viorica; Al-Asmakh, Maha; Kowal, Czeslawa; Anuar, Farhana; Abbaspour, Afrouz; Tóth, Miklós; Korecka, Agata; Bakocevic, Nadja; Ng, Lai Guan; Kundu, Parag; Gulyás, Balázs (2014-11-19). „Střevní mikrobiota ovlivňuje propustnost hematoencefalické bariéry u myší“. Science Translational Medicine. 6 (263): 263ra158. doi:10.1126 / scitranslmed.3009759. ISSN 1946-6234. PMC 4396848. PMID 25411471.
