Intestinální epitel - Intestinal epithelium
| Intestinální epitel | |
|---|---|
 Jednoduché sloupcovité epiteliální buňky | |
| Anatomická terminologie |
| Tento článek je součástí série o |
| Epitel |
|---|
| Dlaždicová epiteliální buňka |
| Sloupcová epiteliální buňka |
| Kuboidní epiteliální buňka |
| Specializovaný epitel |
| jiný |
 |
| Tento článek je jedním ze seriálů o |
| Gastrointestinální stěna |
|---|
Obecná struktura |
Charakteristický |
The intestinální epitel je vrstva jedné buňky, která tvoří luminální povrch (podšívka) obou malý a tlusté střevo (tlustého střeva) gastrointestinální trakt. Složen z jednoduché sloupcovité epiteliální buňky, slouží dvěma hlavním funkcím: vstřebávání užitečných látek do těla a omezení vstupu škodlivých látek. Jako součást své ochranné role tvoří intestinální epitel důležitou složku střevní slizniční bariéra. Některá onemocnění a stavy jsou způsobeny funkčními defekty ve střevním epitelu. Na druhou stranu mohou různé nemoci a stavy vést k jeho dysfunkci, která zase může vést k dalším komplikacím.
Struktura
Střevní epitel je součástí střevní sliznice vrstva. Epitel se skládá z jedné vrstvy buněk. Další dvě vrstvy sliznice, lamina propria a muscularis sliznice, podporovat a artikulovat epiteliální vrstvu. Bezpečně obsahovat obsah střeva lumen, jsou buňky epiteliální vrstvy spojeny dohromady pomocí těsné spojení čímž se vytvoří souvislá a relativně nepropustná membrána.
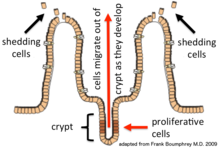

Epiteliální buňky se nepřetržitě obnovují každých 4–5 dní procesem dělení, zrání a migrace buněk. Obnova závisí na proliferativních buňkách (kmenové buňky ), které sídlí v krypta (základna) střevní žlázy (epiteliální invaginace do podkladové pojivové tkáně).[1] Poté, co se vytvořily na základně, nové buňky migrují nahoru a ven z krypty a cestou dozrávají. Nakonec podstoupí apoptóza a jsou vylučovány do lumen střeva.[2] Tímto způsobem se střevní výstelka neustále obnovuje, zatímco počet buněk tvořících epiteliální vrstvu zůstává konstantní.[3]
V tenkém střevě je slizniční vrstva speciálně upravena tak, aby poskytovala velkou plochu, aby se maximalizovala absorpce živin. Expanze absorpčního povrchu, 600krát větší než u jednoduché válcové trubice, je dosažena třemi anatomickými rysy:[4]
- Kruhové záhyby jsou příčné záhyby, které zpomalují průchod luminálního obsahu a slouží k trojnásobnému rozšíření celkové povrchové plochy.
- Klky a střevní žlázy slouží k desetinásobnému zvětšení povrchu sliznice. (Střevní klků)
- Microvilli pokrytí apikálního povrchu enterocytů zvyšuje absorpční povrch dvacetinásobně. Tyto četné mikroskopické (průměr 100 nanometrů) prstovité projekce tvoří zvlněné okraj kartáče.
Kartáčový okraj na apikálním povrchu epiteliálních buněk je pokryt glykokalyx, který se skládá z oligosacharidy připojený k membránové glykoproteiny a glykolipidy.[5]

Typy buněk
Sedm různých typů buněk je produkováno kmenovými buňkami, které se nacházejí na základně krypt.[6] Každý typ dozrává podle svých specifik diferenciační program jak migruje nahoru a ven z krypty. Bylo identifikováno a charakterizováno mnoho genů nezbytných pro diferenciaci na různé typy epiteliálních buněk (viz stůl ). Vyráběné typy buněk jsou: enterocyty, Pohárové buňky, enteroendokrinní buňky, Panethovy buňky, mikrofold buňky, pohárové buňky a chomáčové buňky. Jejich funkce jsou uvedeny zde:[7]
- Enterocyty jsou nejpočetnější a fungují primárně pro vstřebávání živin. Enterocyty exprimují mnoho katabolický enzymy na svém vnějším luminálním povrchu rozkládají molekuly na velikosti vhodné pro absorpci do buňky. Příklady molekul absorbovaných enterocyty jsou: ionty voda jednoduché cukry, vitamíny, lipidy, peptidy a aminokyseliny.
- Pohárové buňky vylučovat sliz vrstva, která chrání epitel před lumenálním obsahem.
- Enteroendokrinní buňky vylučují různé gastrointestinální hormony počítaje v to sekretin, pankreozymin, enteroglukagon mezi ostatními. Podmnožiny senzorických intestinálních epiteliálních buněk synapse s nervy,[8] a jsou známé jako neuropodové buňky.[9]
- Panethovy buňky vyrobit antimikrobiální peptidy jako je lidský beta-defensin.[10][11]
- Mikroskopické buňky (běžně označované jako M buňky) odebírají antigeny z lumenu a dodávají je do lymfatická tkáň spojená se sliznicí (SLAD). V tenkém střevě jsou spojeny M buňky Peyerovy náplasti.
- Kelímkové buňky jsou odlišný typ buňky, ale bez známé funkce.
- Chomáčové buňky hrají roli v imunitní odpovědi.[12]
Distribuce různých typů epiteliálních buněk v celém zažívacím traktu se liší podle funkce dané oblasti.[3]
Strukturní komponenty buněčných spojů

Důležité pro bariérovou funkci intstinálního epitelu jsou jeho buňky bezpečně spojeny dohromady čtyřmi typy spojení (buněčné spoje ),[13] které lze identifikovat na ultrastrukturální úroveň:[14]
Mezery na křižovatce
Mezery spojují sousední buňky ve vzdálenosti 2 nanometrů od sebe. Jsou tvořeny několika homologními proteiny kódovanými konexin genová rodina se spojila a vytvořila a multiproteinový komplex. Molekulární struktura tohoto komplexu je ve formě a hexamer. Komplex, který je zabudován do buněčných stěn dvou spojených buněk, vytváří mezeru nebo kanál uprostřed šesti proteinů. Tento kanál umožňuje různé molekuly, ionty a elektrické impulsy, které procházejí mezi dvěma buňkami.[15]
Desmosomy
Tyto komplexy, skládající se z transmembránový adhezní proteiny kadherin rodina, propojte sousední buňky dohromady prostřednictvím jejich cytoskeletony.[16] Desmosomy nechávají mezi buňkami mezeru 30 nanometrů.[15]
Adherens křižovatky
Spoje adherenů, nazývané také zonula adherens, jsou multiproteinové komplexy tvořené bílkovinami katenin a kadherinové rodiny. Jsou umístěny v membráně v kontaktních bodech mezi buňkami. Jsou tvořeny interakcemi mezi intracelulární adaptorové proteiny, transmembránové proteiny a aktinové cytoskelety buněk. Kromě své role při spojování sousedních buněk jsou tyto komplexy důležité pro regulaci migrace epitelu, polarita buněk a tvorba dalších komplexů buněčných spojů.[14]
Těsná spojení
Těsná spojení, nazývaná také zonula occludens, jsou nejdůležitější složkou intestinálního epitelu pro jeho bariérovou funkci.[17] Tyto komplexy, složené převážně z členů claudin a okluzin rodiny, skládající se z asi 35 různých proteinů,[13] tvoří prstencový spojitý pás kolem buněk a jsou umístěny v blízkosti hranic boční a apikální membrány.[14]
Extracelulární domény transmembránových proteinů v sousedních buňkách se vzájemně propojují a vytvářejí těsné spojení. Mezi tyto interakce patří interakce mezi proteiny ve stejné membráně („cis“) a proteiny v sousedních buňkách („trans“). Kromě toho mohou být interakce homofilní (mezi identickými proteiny) nebo heterofilní (mezi různými proteiny).[14]
Podobně jako u adherenských spojení, intracelulární domény těsných spojení interagují s různými proteiny lešení, adaptační proteiny a signální komplexy k regulaci cytoskeletálního propojení, buněčné polarity, buněčné signalizace a vezikálního obchodování.[14]
Těsná spojení poskytují úzké, ale modifikovatelné utěsnění mezi sousedními buňkami v epiteliální vrstvě, a tím zajišťují selektivitu paracelulární transport rozpuštěných látek.[14] I když se dříve myslelo, že jde o statické struktury, je dnes známo, že těsné spoje jsou dynamické a mohou měnit velikost otvoru mezi buňkami, a tím se přizpůsobovat různým stavům vývoje, fyziologii a patologiím.[17] Fungují jako selektivní a semipermeabilní paracelulární bariéra mezi apikálními a bazolaterálními oddíly epiteliální vrstvy. Fungují tak, že usnadňují průchod malých iontů a ve vodě rozpustných rozpuštěných látek paracelulárním prostorem a zároveň zabraňují průchodu luminálních antigenů, mikroorganismů a jejich toxinů.[14]
Fyziologie
Střevní epitel má složitou anatomickou strukturu, která usnadňuje pohyblivost a koordinované trávicí, absorpční, imunologické a neuroendokrinní funkce.[18]
The sliz vylučovaný pohárkovými buňkami působí jako lubrikant a chrání vrstvu epiteliálních buněk před podrážděním z obsahu sliznice.[19]
Tradičně byly kryptické buňky považovány primárně za sekreční buňky, zatímco enterocyty jsou považovány hlavně za absorpční. Nedávné studie však zpochybnily toto klasické funkční rozdělení a ukázaly, že jak povrchové, tak kryptické buňky mohou vykonávat jak sekreční, tak absorpční funkce a že ve skutečnosti se tyto funkce mohou vyskytovat současně.[20][21]
Příjem živin
Překrytí okraje štětce apikálního povrchu enterocytů je glykokalyx, což je volná síť složená z oligosacharidových postranních řetězců integrálních membránových hydroláz a dalších enzymů nezbytných pro trávení bílkovin a sacharidů. Tyto glykoproteiny, glykolipidy, a enzymy katalyzovat konečné zažívací fáze luminálních sacharidů a bílkovin. The monosacharidy a aminokyseliny takto vyrobené jsou následně transportovány přes střevní epitel a nakonec do krevního řečiště.[5]
Absorpce elektrolytů a vody je jednou z nejdůležitějších funkcí trávicího traktu. Absorpce vody je pasivní a izotonický - v závislosti na rychlosti a směru proudění rozpuštěné látky. Dalšími faktory ovlivňujícími absorpci tekutin jsou osmolarita a specifická oblast střeva.[18] Regulovaná selektivní permeabilita se provádí dvěma hlavními cestami: transcelulární (transepitheliální) cestou a paracelulární cestou.[14]
Transcelulární propustnost

Skládá se ze specifické přepravy rozpuštěné látky přes epitelové buňky. Je převážně regulován aktivitami specializovaných transportérů, které translokují specifické elektrolyty, aminokyseliny, cukry, mastné kyseliny s krátkým řetězcem a další molekuly do nebo z buňky.[14]
Paracelulární propustnost
Paracelulární permeabilita závisí na transportu mezerami, které existují mezi epiteliálními buňkami. Je regulován buněčnými spoji, které jsou lokalizovány v laminálních membránách buněk.[14] Toto je hlavní cesta pasivního toku vody a rozpuštěných látek přes střevní epitel. Regulace závisí na mezibuněčných těsných spojích, které mají největší vliv na paracelulární transport.[22] Studie využívající elektronový mikroskop ukázaly, že elektrický odpor epiteliálních vrstev závisí na složitosti a počtu vláken v komplexech transmembránových proteinů s těsným spojením.[18] Také plazmatická membrána rezistence a variabilní transmembránová vodivost epiteliálních buněk mohou také modulovat funkci paracelulárních drah.[18]
Funkce
Bariéra tvořená intestinálním epitelem odděluje vnější prostředí (obsah střeva lumen ) z těla[14] a je nejrozsáhlejší a nejdůležitější slizniční povrch těla.[17]
Střevní epitel plní několik zásadních funkcí, přičemž vykazuje vrozené i adaptivní imunitní vlastnosti. Důkladně sleduje své intracelulární a extracelulární prostředí, komunikuje zprávy sousedním buňkám a v případě potřeby rychle iniciuje aktivní obranná a opravná opatření.[23] Na jedné straně působí jako bariéra, která brání vstupu škodlivých látek, jako jsou cizí látky antigeny, toxiny a mikroorganismy.[13][14] Na druhou stranu působí jako selektivní filtr, který usnadňuje příjem stravy živiny, elektrolyty, voda a různé další prospěšné látky z lumen střeva.[14]
Při ztrátě integrity bariéry střevní propustnost může dojít ke zvýšení a nekontrolovanému průchodu škodlivých látek. To může vést, v závislosti na genetické predispozici jedince, k rozvoji zánět, infekce, alergie, autoimunitní onemocnění nebo rakovina - uvnitř samotného střeva nebo jiných orgánů.[18]
Ačkoli primárně fungují jako součást zažívací ústrojí, enterocyty exprimují také střevní epitel mýtné receptory a nukleotidová oligomerizační doména bílkoviny, které rozpoznávají různé typy mikrobů a přispívají k nim imunitní systém funkce.[24][25] Tudíž střevní epitel slouží nejen jako fyzická bariéra oddělující lumen střeva od vlastního těla, ale také plní funkce rozpoznávání patogenů jako součást vnitřní imunitní systém.
Důležitost pro lidské zdraví
Klíčem je ztráta integrity střevního epitelu patogenní role v zánětlivé onemocnění střev (IBD).[26] Změny ve složení střevní mikrobiota jsou důležitým faktorem prostředí při vývoji IBD. Škodlivé změny ve střevní mikroflóře vyvolávají nevhodnou (nekontrolovanou) imunitní odpověď což má za následek poškození střevního epitelu. Porušení této kritické bariéry (střevní epitel) umožňuje další infiltraci mikrobioty, která zase vyvolává další imunitní odpovědi. IBD je multifaktoriální onemocnění, které je nicméně částečně poháněno přehnanou imunitní reakcí na střevní mikroflóru, která způsobuje poruchy funkce epiteliální bariéry.[27]
Viz také
Reference
- ^ Clevers H (2013). „Střevní krypta, prototyp kompartmentu kmenových buněk“. Buňka. 154 (2): 274–84. doi:10.1016 / j.cell.2013.07.004. PMID 23870119.
- ^ van der Flier, Laurens G .; Clevers, Hans (1. ledna 2009). "Kmenové buňky, samoobnovení a diferenciace ve střevním epitelu". Roční přehled fyziologie. 71: 241–260. doi:10.1146 / annurev.physiol.010908.163145. ISSN 1545-1585. PMID 18808327.
- ^ A b Lodish, Harvey; Berk, Arnold; Zipursky, S. Lawrence; Matsudaira, Paul; Baltimore, David; Darnell, James (1. ledna 2000). "Střevní architektura a vývoj". Molekulární buněčná biologie (4. vydání). W. H. Freeman. ISBN 978-0716731368.
- ^ Khurana (1. ledna 2005). Učebnice lékařské fyziologie. Elsevier Indie. str. 641. ISBN 9788181478504.
- ^ A b Lodish, Harvey; Berk, Arnold; Zipursky, S. Lawrence; Matsudaira, Paul; Baltimore, David; Darnell, James (1. ledna 2000). „Transport napříč Epitelem“. Citovat deník vyžaduje
| deník =(Pomoc) - ^ Laurens G. van der Flier; Hans Clevers (2009). "Kmenové buňky, sebeobnovení a diferenciace ve střevním epitelu". Roční přehled fyziologie. 71 (1): 241–260. doi:10.1146 / annurev.physiol.010908.163145. PMID 18808327.
- ^ Sarmento, Bruno (30. září 2015). Koncepty a modely pro studie propustnosti léčiv: Buňky a tkáně založené na modelech kultivace in vitro. Woodhead Publishing. str. 57–58. ISBN 9780081001141.
- ^ Bohórquez, Diego; Liddle, Rodger (2015). "Neuroepiteliální okruh vytvořený inervací senzorických enteroendokrinních buněk". Journal of Clinical Investigation. 125 (2): 782–786. doi:10,1172 / JCI78361. PMC 4319442. PMID 25555217.
- ^ Kaelberer, M. Maya; Bohórquez, Diego (2018). „Nervový obvod střeva a mozku pro senzorickou transdukci živin“. Věda. 361 (6408): eaat5236. doi:10.1126 / science.aat5236. PMC 6417812. PMID 30237325.
- ^ van Es, Johan H .; Clevers, Hans (16. června 2014). "Panethovy buňky". Aktuální biologie. 24 (12): R547–548. doi:10.1016 / j.cub.2014.04.049. ISSN 1879-0445. PMID 24937274.
- ^ Santaolalla R, Abreu MT (2012). „Vrozená imunita v tenkém střevě“. Curr Opin Gastroenterol. 28 (2): 124–9. doi:10.1097 / MOG.0b013e3283506559. PMC 3502878. PMID 22241076.
- ^ Gerbe, F; Legraverend, C; Jay, P (září 2012). "Buňky chomáčku střevního epitelu: specifikace a funkce". Buněčné a molekulární biologické vědy. 69 (17): 2907–17. doi:10.1007 / s00018-012-0984-7. PMC 3417095. PMID 22527717.
- ^ A b C Khan, Niamat; Asif, Abdul R. (1. ledna 2015). „Regulátory transkripce klaudinů v těsných spojích epitelu“. Zprostředkovatelé zánětu. 2015: 219843. doi:10.1155/2015/219843. ISSN 0962-9351. PMC 4407569. PMID 25948882.
- ^ A b C d E F G h i j k l m Groschwitz, Katherine R .; Hogan, Simon P. (1. července 2009). "Funkce střevní bariéry: molekulární regulace a patogeneze onemocnění". The Journal of Allergy and Clinical Immunology. 124 (1): 3–22. doi:10.1016 / j.jaci.2009.05.038. ISSN 0091-6749. PMC 4266989. PMID 19560575.
- ^ A b Bennett, M. V .; Barrio, L. C .; Bargiello, T. A .; Spray, D. C .; Hertzberg, E .; Sáez, J. C. (1. března 1991). "Mezery mezi spoji: nové nástroje, nové odpovědi, nové otázky". Neuron. 6 (3): 305–320. doi:10.1016 / 0896-6273 (91) 90241-q. ISSN 0896-6273. PMID 1848077.
- ^ Nekrasova, Oxana; Green, Kathleen J. (1. listopadu 2013). „Desmosome shromáždění a dynamika“. Trendy v buněčné biologii. 23 (11): 537–546. doi:10.1016 / j.tcb.2013.06.004. ISSN 0962-8924. PMC 3913269. PMID 23891292.
- ^ A b C Rao, Jaladanki N .; Wang, Jian-Ying (1. ledna 2010). "Střevní architektura a vývoj". Morgan & Claypool Life Sciences. Citovat deník vyžaduje
| deník =(Pomoc) - ^ A b C d E Fasano, Alessio (1. ledna 2011). „Zonulin a jeho regulace funkce střevní bariéry: biologická brána zánětu, autoimunitě a rakovině“. Fyziologické recenze. 91 (1): 151–175. doi:10.1152 / physrev.00003.2008. ISSN 0031-9333. PMID 21248165.
- ^ Allen, Adrian; Flemström, Gunnar (1. ledna 2005). „Bariéra hydrogenuhličitanu hlenu gastroduodenálního: ochrana proti kyselinám a pepsinu“. American Journal of Physiology. Fyziologie buněk. 288 (1): C1–19. doi:10.1152 / ajpcell.00102.2004. ISSN 0363-6143. PMID 15591243.
- ^ Geibel, John P. (1. ledna 2005). "Sekrece a vstřebávání kryptami tlustého střeva". Roční přehled fyziologie. 67: 471–490. doi:10,1146 / annurev.physiol.67.031103.153530. ISSN 0066-4278. PMID 15709966.
- ^ Binder, Henry J .; Rajendran, Vazhaikkurichi; Sadasivan, Vidyasagar; Geibel, John P. (1. dubna 2005). "Sekrece bikarbonátu: opomíjený aspekt transportu iontů tlustého střeva". Journal of Clinical Gastroenterology. 39 (4 Suppl 2): S53–58. doi:10.1097 / 01.mcg.0000155521.81382.3a. ISSN 0192-0790. PMID 15758660.
- ^ Näslund, Erik; Hellström, Per M. (10. září 2007). "Signalizace chuti k jídlu: od střevních peptidů a enterických nervů po mozek". Fyziologie a chování. 92 (1–2): 256–262. doi:10.1016 / j.physbeh.2007.05.017. ISSN 0031-9384. PMID 17582445.
- ^ Cario, E (2010). „Hlavu vzhůru! Jak intestinální epitel chrání imunitu bariéry sliznice skrz inflammasom i mimo něj“. Aktuální názor v gastroenterologii. 26 (6): 583–590. doi:10.1097 / MOG.0b013e32833d4b88. PMID 20664345.
- ^ Cario, E (2005). "Bakteriální interakce s buňkami střevní sliznice: Toll-like receptory a NOD2". Střevo. 54 (8): 1182–93. doi:10.1136 / gut.2004.062794. PMC 1774880. PMID 15840688.
- ^ Abreu, Maria T .; Fukata, Masayuki; Arditi, Moshe (15. dubna 2005). "Signalizace TLR ve střevě ve zdraví a nemoci". Journal of Immunology. 174 (8): 4453–4460. doi:10,4049 / jimmunol.174.8.4453. ISSN 0022-1767. PMID 15814663.
- ^ Maloy, Kevin J .; Powrie, Fiona (16. června 2011). "Střevní homeostáza a její rozpad při zánětlivém onemocnění střev". Příroda. 474 (7351): 298–306. doi:10.1038 / příroda10208. ISSN 1476-4687. PMID 21677746.
- ^ Coskun, Mehmet (25. srpna 2014). "Střevní epitel u zánětlivých onemocnění střev". Hranice v medicíně. 1: 24. doi:10.3389 / fmed.2014.00024. ISSN 2296-858X. PMC 4292184. PMID 25593900.
