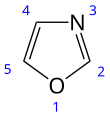
Oxazol - Oxazole
| |||
| |||
| Jména | |||
|---|---|---|---|
| Název IUPAC 1,3-oxazol | |||
| Identifikátory | |||
3D model (JSmol ) | |||
| ChEBI | |||
| ChemSpider | |||
| Informační karta ECHA | 100.005.474 | ||
| Číslo ES |
| ||
| Pletivo | D010080 | ||
PubChem CID | |||
| UNII | |||
Řídicí panel CompTox (EPA) | |||
| |||
| |||
| Vlastnosti | |||
| C3H3NÓ | |||
| Molární hmotnost | 69,06 g / mol | ||
| Hustota | 1,050 g / cm3 | ||
| Bod varu | 69 až 70 ° C (156 až 158 ° F; 342 až 343 K) | ||
| Kyselost (strK.A) | 0,8 (konjugované kyseliny) [1] | ||
| Stránka s doplňkovými údaji | |||
| Index lomu (n), Dielektrická konstanta (εr), atd. | |||
Termodynamické data | Fázové chování pevná látka - kapalina - plyn | ||
| UV, IR, NMR, SLEČNA | |||
Pokud není uvedeno jinak, jsou uvedeny údaje o materiálech v nich standardní stav (při 25 ° C [77 ° F], 100 kPa). | |||
| Reference Infoboxu | |||
Oxazol je mateřskou sloučeninou pro obrovskou třídu heterocyklický aromatický organické sloučeniny. Tyto jsou azoly s kyslíkem a dusíkem oddělené jedním uhlíkem.[2] Oxazoly jsou aromatické sloučeniny ale méně než thiazoly. Oxazol je slabá báze; své konjugovaná kyselina má strK.A 0,8 ve srovnání s 7 pro imidazol.
Příprava
Klasické oxazolové syntetické metody v organická chemie jsou
- the Syntéza Robinson – Gabriel dehydratací 2-acylaminoketonů
- the Fischerova syntéza oxazolu z kyanohydrinů a aldehydů
- the Bredereckova reakce s α-haloketony a formamid
- the Van Leusenova reakce s aldehydy a TosMIC
Další metody:
- Oxazoliny lze také získat z cykloizomerace určitých látek propargyl amidy. V jedné studii[3] oxazoly byly připraveny pomocí a syntéza v jedné nádobě skládající se z kondenzace propargyl amin a benzoylchlorid do amide, následovaný a Sonogashira spojka terminálu alkyn konec s dalším ekvivalentem benzoylchloridu a závěr s str-toluensulfonová kyselina katalyzovaný cykloisomerizace:
- V jedné hlášené syntéze oxazolu jsou reaktanty a nitro - substituovaný benzoylchlorid a isonitril:[4][5]
Biosyntéza
v biomolekuly, oxazoly jsou výsledkem cyklizace a oxidace serin nebo threonin nonribozomální peptidy:
 Kde X = H, CH
Kde X = H, CH
3 pro serin, respektive threonin, B = báze.
(1) Enzymatická cyklizace. (2) Vyloučení. (3) [O] = enzymatická oxidace.
Oxazoly nejsou tak hojné biomolekuly jako související thiazoly s kyslíkem nahrazeným atomem síry.
Reakce
- Deprotonace oxazolů na C2 je často doprovázeno otevřením kruhu k isonitrilu.
- Elektrofilní aromatická substituce probíhá na C5 vyžadující aktivační skupiny.
- Nukleofilní aromatická substituce probíhá s opouštějícími skupinami na C2.
- Diels – Alderovy reakce s oxazoly dieny může následovat ztráta kyslíku za vzniku pyridiny.
- The Cornforth přesmyk 4-acyloxazolů je termální přesmyková reakce s organickým acylovým zbytkem a pozicemi pro změnu substituentu C5.
- Rozličný oxidace reakce. Jedna studie[6] uvádí oxidaci 4,5-difenyloxazolu 3 ekvivalenty UMĚT na odpovídající imide a kyselina benzoová:
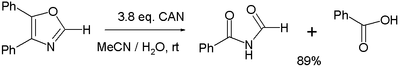
- Ve vyváženém stavu poloviční reakce tři ekvivalenty vody se spotřebují na každý ekvivalent oxazolinu, čímž se vytvoří 4 protony a 4 elektrony (druhý odvozený z CeIV).

Viz také
- Isoxazol, analog s dusík atom v poloze 2.
- Imidazol, analog s kyslík nahrazen dusíkem.
- Thiazol, analog s kyslíkem nahrazeným sírou.
- Benzoxazol kde je oxazol kondenzován s jiným aromatickým kruhem.
- Pyrrol, analog bez atomu kyslíku.
- Furan, analog bez atomu dusíku.
- Oxazolin, který má jednu dvojnou vazbu redukovanou.
- Oxazolidin, který má obě dvojné vazby snížené.
- Oxadiazoly se dvěma dusíky místo jednoho (např. furazan ).
- Oxazolon, analog s karbonylovou skupinou
Reference
- ^ Zoltewicz, J. A. & Deady, L. W. Kvaternizace heteroaromatických sloučenin. Kvantitativní aspekty. Adv. Heterocykl. Chem. 22, 71-121 (1978).
- ^ Heterocyclic Chemistry TL Gilchrist, The Bath press 1985 ISBN 0-582-01421-2
- ^ Nová po sobě jdoucí třísložková syntéza oxazolu sekvencí amidace - kopulace - cykloisomerizace (ACCI) Eugen Merkul a Thomas J. J. Müller Chem. Commun., 2006, 4817 - 4819, doi:10.1039 / b610839c
- ^ Plně automatizovaná syntéza kontinuálního toku 4,5-disubstituovaných oxazolů Marcus Baumann, Ian R. Baxendale, Steven V. Ley Christoper D. Smith a Geoffrey K. Tranmer Org. Lett.; 2006; 8 (23), str. 5231 - 5234; (Dopis) doi:10.1021 / ol061975c
- ^ Společně reagují v první fázi v reaktoru s kontinuálním tokem na meziprodukt enol a pak ve druhé fázi v a fosfazenová báze (PS-BEMP) indukovanou cyklizaci pomocí syntéza na pevné fázi.
- ^ "Ceric Ammonium Nitrate Promited Oxidation of Oxazoles", David A. Evans, Pavel Nagorny a Risheng Xu. Org. Lett.; 2006; 8 (24), str. 5669 - 5671; (Dopis) doi:10.1021 / ol0624530
- ^ Gérard Moine, Hans-Peter Hohmann, Roland Kurth, Joachim Paust, Wolfgang Hähnlein, Horst Pauling, Bernd – Jürgen Weimann, Bruno Kaesler (2011). „Vitamíny, 6. B vitamíny“. Ullmann's Encyclopedia of Industrial Chemistry. Weinheim: Wiley-VCH. doi:10.1002 / 14356007.o27_o09.CS1 maint: používá parametr autoři (odkaz)