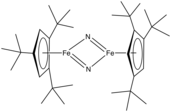
Kovový nitridový komplex - Metal nitrido complex
Kovové nitridové komplexy jsou koordinační sloučeniny a kovové shluky které obsahují atom dusíku vázaný pouze na přechodné kovy. Tyto sloučeniny jsou molekulární, tj. diskrétní na rozdíl od polymerních, hustých nitrid materiály, které jsou užitečné v věda o materiálech.[1] Rozdíl mezi molekulárními polymery a polymery v pevné fázi není vždy zcela jasný, jak dokládají materiály Li6MoN4 a kondenzovanější deriváty, jako je Na3MoN3. Komplexy nitrido přechodných kovů přitahovaly zájem částečně proto, že se to předpokládá fixace dusíkem probíhá prostřednictvím nitrido meziproduktů. Nitrido komplexy jsou již dlouho známy, prvním příkladem jsou soli [OsO3N]−, popsané v 19. století.[2]
Strukturální trendy
Mononukleární komplexy mají terminální nitridové ligandy, typicky s malými vzdálenostmi M-N shodnými s kovový ligand vícenásobné vazby. Například v aniontu v PPh4 [MoNCl4], vzdálenost Mo-N je 163,7 hodin. Výskyt terminálních nitridových ligandů se řídí vzory pozorovanými u oxo komplexů: jsou častější u časných a těžších kovů. Je známo mnoho dvoj- a vícejaderných komplexů s přemosťujícími nitridovými ligandy.[3] Možné jsou také exotičtější komplexy nitrido s kovem, například nedávno zveřejněná sloučenina obsahující koncovou vazbu nitridu uranu (-U≡N).[4]
- Příklad kovových nitridových komplexů

[OsNO3]−, který je izoelektronický s oxid osmičelý.

[MoNCl4]−, čtvercový pyramidový Mo (VI) komplex.

[Ž2(μ-N) Cl10]−, obsahující dvě W (VI) centra přemostěná nitridovým ligandem.

[Ir3N (SO4)6(H2Ó)3]4−, strukturálně související s základní octan železitý.

Komplex nitridu uranu.
Přípravné cesty
Nitridy kovů se vyrábějí pomocí různých zdrojů dusíku. První příklad byl připraven z amide (NH2−) jako N3− zdroj:
- OsO4 + KNH2 → KOsO3N + H2Ó
Nejčastěji však nitrido komplexy se vyrábějí z azido komplexů ..[5] Hnací silou těchto reakcí je velká stabilita N2. Chlorid dusitý je účinným činidlem poskytujícím komplexy chlornitrido. V některých případech dokonce N2 a nitrily mohou sloužit jako zdroje nitridových ligandů.
Reakce nitridových ligandů
Nitridový ligand může být elektrofilní i nukleofilní.[6][7] Koncové nitridy raných kovů bývají zásadité a oxidovatelné, zatímco nitridy pozdějších kovů bývají oxidační a elektrofilní. První chování je ilustrováno jejich N-protonace a N-alkylace. Ru a Os nitrido komplexy často přidávají organofosfiny za vzniku iminofosfinových derivátů obsahujících R3PN− ligand.
Intersticiální nitridy
Díky schopnosti nitridových ligandů sloužit jako a přemosťující ligand Je známo několik kovových shluků, které obsahují nitridové ligandy ve svém středu. Takové nitrido ligandy se nazývají vsunutá reklama. V některých případech je nitrid zcela uzavřen ve středu šesti nebo více kovů a nemůže podléhat reakcím, i když přispívá k intermetalické vazbě.[8]

Obecné odkazy
- ^ Greenwood, Norman N.; Earnshaw, Alan (1997). Chemie prvků (2. vyd.). Butterworth-Heinemann. ISBN 978-0-08-037941-8.
- ^ Fritzsche, J .; Struve, H. (1847). „Ueber die Osman-Osmiumsäure“. Journal für Praktische Chemie. 41 (1): 97–113. doi:10.1002 / prac.18470410113.
- ^ Dehnicke, Kurt; Strähle, Joachim (1992). "Nitridové komplexy přechodných kovů". Angewandte Chemie International Edition v angličtině. 31 (8): 955–978. doi:10.1002 / anie.199209551.
- ^ King, David M .; Tuňák, Floriana; McInnes, Eric J. L .; McMaster, Jonathan; Lewis, William; Blake, Alexander J .; Liddle, Stephen T. (2012). "Syntéza a struktura terminálního komplexu nitridu uranu". Věda. 337 (6095): 717–720. Bibcode:2012Sci ... 337..717K. doi:10.1126 / science.1223488. PMID 22745250.
- ^ Reiners, Matthias; Maekawa, Miyuki; Daniliuc, Constantin G .; Freytag, Matthias; Jones, Peter G .; White, Peter S .; Hohenberger, Johannes; Sutter, Jörg; Meyer, Karsten; Maron, Laurent; Walter, Marc D. (2017). „Studie reaktivity na [Cp′Fe (μ-I)] 2: Nitrido-, sulfido- a diselenidové komplexy železa odvozené od aktivace pseudohalidem“. Chemická věda. 8 (5): 4108–4122. doi:10.1039 / C7SC00570A. PMC 6099922. PMID 30155215.
- ^ Dehnicke, Kurt; Weller, Frank; Strähle, Joachim (2001). "Nitrido mosty mezi přechodnými kovy a prvky hlavní skupiny ilustrované řadou [M] NNa až [M] NCl". Chem. Soc. Rev. 30 (2): 125–135. doi:10.1039 / a802635a.
- ^ Smith, Jeremy M. (2014). Komplexy reaktivních přechodných nitridů kovů. Pokrok v anorganické chemii. 58. 417–470. doi:10.1002 / 9781118792797.ch06. ISBN 9781118792797.
- ^ Gladfelter, Wayne L. (1985). Klastry organokovových kovů obsahující nitrosyl a nitrido ligandy. Pokroky v organokovové chemii. 24. 41–86. doi:10.1016 / S0065-3055 (08) 60413-X. ISBN 9780120311248.