Vysoce valentní železo - High-valent iron

Vysoce valentní železo běžně označuje sloučeniny a meziprodukty, ve kterých žehlička se nachází ve formálním oxidační stav > 3, které ukazují a počet dluhopisů > 6 s a koordinační číslo ≤ 6. Tento termín je u sloučenin železa s hepta souřadnicí poměrně neobvyklý.[1] Je třeba jej odlišit od pojmů hypervalentní a hyperkoordinovaný, protože vysoce valentní sloučeniny železa nemusí nutně porušovat 18-elektronové pravidlo ani nemusí nutně ukazovat koordinační čísla> 6. The ferát (VI) iont [FeO4]2− byla první syntetizovaná struktura v této třídě. Syntetické sloučeniny popsané níže obsahují vysoce oxidované železo obecně, protože pojmy spolu úzce souvisejí.
Sloučeniny oxoironu[2]
Jako meziprodukty se běžně navrhují oxoferrylové druhy katalytické cykly, zejména biologické systémy, ve kterých O2 je vyžadována aktivace. Diatomický kyslík má vysoký redukční potenciál (E.0 = 1,23 V), ale prvním krokem potřebným k využití tohoto potenciálu je termodynamicky nepříznivá redukce elektronu E0 = -0,16 V. K této redukci dochází v přírodě vytvořením a superoxid komplex, ve kterém je redukovaný kov oxidován O2. Produktem této reakce je peroxidový radikál, který je snadněji reaktivní. Množství těchto druhů v přírodě a chemie, která je jim k dispozici, jsou důvody, proč je studium těchto sloučenin důležité.[Citace je zapotřebí ] Široce použitelnou metodou pro generování vysoce valentních oxoferrylových druhů je oxidace jodosobenzen:
- symbolická oxidace sloučeniny železa pomocí jodosobenzen; L označuje podpůrný ligand
Fe (IV) O.

Bylo popsáno několik syntéz druhů oxoironu (IV).[3] Tyto sloučeniny modelují biologické komplexy jako např cytochrom P450, ŽÁDNÁ syntáza a isopenicilin N syntáza. Dvě takové uváděné sloučeniny jsou oxoiron (IV) ligovaný thiolátem a oxoiron (IV) cyklam-acetát. Oxoiron (IV) ligovaný thiolátem je tvořen oxidací prekurzoru [FeII(TMCS)] (PF6) (TMCS = 1-merkaptoethyl-4,8,11-trimethyl-1,4,8,11-tetraza cyklotetradekan) a 3 až 5 ekvivalentů H2Ó2 při -60 ° C methanolu. Sloučenina železa (IV) má tmavě modrou barvu a vykazuje intenzivní absorpční vlastnosti při 460 nm, 570 nm, 850 nm a 1050 nm. Tento druh FeIV(= O) (TMCS) + je stabilní při -60 ° C, ale při zvýšení teploty se uvádí rozklad. Sloučenina 2 byla identifikována pomocí Mössbauerova spektroskopie, vysoké rozlišení ionizace elektrosprejem hmotnostní spektrometrie (ESI-MS), Rentgenová absorpční spektroskopie, prodloužená absorpce rentgenové jemné struktury (EXAFS), ultrafialová viditelná spektroskopie (UV-vis), Infračervená spektroskopie s Fourierovou transformací (FT-IR) a výsledky byly porovnány s hustota funkční teorie (DFT) výpočty.[4]
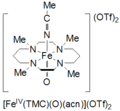
Tetramethylcyklam oxoiron (IV) vzniká reakcí FeII(TMC) (OTf)2, TMC = 1,4,8,11-tetramethyl-1,4,8,11-tetraazacyklotetradekan; OTf = CF3TAK3, s jodosylbenzenem (PhIO) v CH3CN při -40 ° C. Druhá metoda pro tvorbu cyklam oxoironu (IV) se uvádí jako reakce FeII(TMC) (OTf)2 se 3 ekvivalenty H2Ó2 po dobu 3 hodin. Tento druh je světle zelené barvy a má absorpční maximum při 820 nm. Uvádí se, že je stabilní po dobu alespoň 1 měsíce při -40 ° C. Bylo charakterizováno Mössbauerovou spektroskopií, ESI-MS, EXAFS, UV-vis, Ramanova spektroskopie a FT-IR.[5]
Vysoce valentní železo bispidin komplexy mohou oxidovat cyklohexan na cyklohexanol a cyklohexanon v 35% výtěžku s poměrem alkoholu ke ketonu až 4.[6]
Fe (V) O
FePROTITAML (= O), TAML = tetra-amido makrocyklický ligand, vzniká reakcí [FeIII(TAML) (H2O)] (PPh4) s 2 až 5 ekvivalenty kyseliny meta-chlorperbenzoové při teplotě -60 ° C v n-butyronitrilu. Tato tmavě zelená sloučenina (dvě λmax při 445 respektive 630 nm) je stabilní při 77 K. Stabilizace Fe (V) je přičítána silné kapacitě π – donoru deprotonovaných amidových dusíků.[7]
Fe (VI) O
Ferrát (VI) je anorganické anion z chemický vzorec [FeO4]2−. to je fotocitlivý a přispívá k bledě fialové barvě svých sloučenin a roztoků. Je to jedna z nejsilnějších stabilních ve vodě oxidující druhy známý. Ačkoli je klasifikován jako slabá základna, koncentrované roztoky ferátu (VI) jsou stabilní pouze při vysoké teplotě pH.
Elektronická struktura
Byla přezkoumána elektronová struktura sloučenin oxafonu porfyrinu.[8]
Sloučeniny nitridoironu a imidoironu

Nitridoiron[9] a imidoiron[10] sloučeniny úzce souvisí s chemie železa a dinitrogenu.[11] Biologický význam nitridoironu (V) porfyriny byl zkontrolován.[12][13] Široce použitelnou metodou pro generování vysoce valentních druhů nitridoironu je tepelná nebo fotochemická oxidační eliminace molekulárního dusíku azid komplex.
- symbolickou oxidační eliminací dusíku se získá nitridoironový komplex; L označuje podpůrný ligand.
Fe (IV) N
Existuje několik strukturně charakterizovaných nitridoironových (IV) sloučenin.[14][15][16]
Fe (V) N
První nitridoiron (V) sloučenina byla syntetizována a charakterizována Wagnerem a Nakamotem (1988, 1989) s použitím fotolýza a Ramanova spektroskopie při nízkých teplotách.[17][18]
Fe (VI) N
Druhý FeVI druhy kromě ferát (VI) ion, [(mě3cy-ac) FeN] (PF6)2, byl nahlášen. Tento druh je tvořen oxidací následovanou fotolýza za vzniku druhu Fe (VI). Charakterizace komplexu Fe (VI) byla provedena výpočty Mossbauer, EXAFS, IR a DFT. Na rozdíl od ferátu (VI) je sloučenina 5 diamagnetický.[19]
μ-Nitrido sloučeniny a oxidační katalýza[20]
Přemostěný μ-nitrido di-železo ftalokyanin sloučeniny katalyzují oxidaci metan na methanolu, formaldehyd, a kyselina mravenčí použitím peroxid vodíku jako obětní oxidant.[21]
Elektronická struktura
Druhy nitridoiron (IV) a nitridoiron (V) byly poprvé teoreticky prozkoumány v roce 2002.[22]
Reference
- ^ Craig a kol. Dalton Trans., 2010, 39, 4874-4881 doi:10.1039 / B927032A
- ^ Que a kol .; Journal of Anorganic Biochemistry, svazek 100, číslo 4, duben 2006, strany 421-433;doi:10.1016 / j.jinorgbio.2006.01.014
- ^ Yee, Gereon M .; Tolman, William B. (2015). „Kapitola 5, oddíl 2.2.4 Fe (IV) -Oxo meziprodukty". V Peter M.H. Kroneck a Martha E. Sosa Torres (ed.). Udržení života na planetě Zemi: Metalloenzymy zvládající dioxygen a další žvýkací plyny. Kovové ionty v biologických vědách. 15. Springer. str. 145–146. doi:10.1007/978-3-319-12415-5_5.
- ^ Bukowski, M. R., Koehntop, K. D., Stubna, A., Bominaar E. L., Halfen, J. A., Munck, E., Nam, W., Que, L., Science, 310, 1000-1002, 2005; doi:10.1126 / science.111909
- ^ Rohde, J.-U., In, J.-H., Lim, MH, Brennessel, WW, Bikowski, MR, Stubna, A., Munck, E., Name, W., Que, L., Science, 299, 1037-1039, 2003; doi:10.1126 / science.299.5609.1037
- ^ Comba, P. a kol .; Inorg. Chem., 2009, 48 (21), str. 10389–10396; doi:10.1021 / ic901702s
- ^ Oliveira, FT, Chanda, A., Banerjee, D., Shan, X., Mondal, S., Que, L., Bominaar, EL, Munck, E., Collins, TJ, Science, 315, 835-838, 2007; doi:10.1126 / science.1133417
- ^ Fujii, H .; Coordination Chemistry Reviews Volume 226, Issues 1-2, March 2002, strany 51-60; doi:10.1016 / S0010-8545 (01) 00441-6
- ^ Berry, J.F .; Komentáře k Anorganic Chemistry, 30: 28–66, 2009; doi:10.1080/02603590902768875
- ^ Peters, J.C., Mehn, M.P .; Journal of Anorganic Biochemistry, svazek 100, číslo 4, duben 2006, strany 634-643; doi:10.1016 / j.jinorgbio.2006.01.023
- ^ Tyler, D. R., Crossland, J. E .; Coordination Chemistry Reviews 254 (2010) 1883–1894; doi:10.1016 / j.ccr.2010.01.005
- ^ Nakamoto, K .; Coordination Chemistry Reviews Volume 226, Issues 1-2, March 2002, strany 153-165; doi:10.1016 / S0010-8545 (01) 00425-8
- ^ Nakamoto, K .; Journal of Molecular Structure Volumes 408-409, 1. června 1997, strany 11-16; doi:10.1016 / S0022-2860 (96) 09670-6
- ^ Peters, Jonas C .; Que, Lawrence, Jr. a kol .; Inorg. Chem., 2007, 46 (14), str. 5720–5726; doi:10.1021 / ic700818q
- ^ Smith a kol .; Angewandte Chemie International Edition, svazek 48, číslo 17, strany 3158–3160, 14. dubna 2009; doi:10.1002 / anie.200900381
- ^ Meyer a kol .; Angewandte Chemie International Edition, svazek 47, číslo 14, strany 2681–2684, 25. března 2008, 14. dubna 2009; doi:10.1002 / anie.200800600
- ^ Wagner, W.D .; Nakamoto, K .; J. Am. Chem. Soc., 1988, 110 (12), str. 4044–4045; doi:10.1021 / ja00220a057
- ^ Wagner, W.D .; Nakamoto, K .; J. Am. Chem. Soc., 1989, 111 (5), str. 1590–1598; doi:10.1021 / ja00187a010
- ^ Berry, J. F., Bill, E., Bothe, E., George, S. D., Miener, B., Neese, F., Wieghardt, K., Science, 312, 1937-1941, 2006; doi:10.1126 / science.1128506
- ^ Recenze: Que, L., Tolman, W.B .; Nature 455, 333-340 (18. září 2008); doi:10.1038 / nature07371
- ^ Sorokin, A.B .; Kudrik, E.V .; Bouchu, D .; Chem. Commun., 2008, 2562-2564; doi:10.1039 / B804405H
- ^ Dey, A .; Ghosh, A .; J. Am. Chem. Soc., 2002, 124 (13), str. 3206–3207; doi:10.1021 / ja012402s
Viz také
- Jacobsenův katalyzátor (vysoce valentní mangan)
Další čtení
- Solomon a kol .; Angewandte Chemie International Edition, svazek 47, číslo 47, strany 9071–9074, 10. listopadu 2008; doi:10.1002 / anie.200803740


