Vanadate - Vanadate - Wikipedia

V chemii, a zmizet je aniontový koordinační komplex z vanadium. Vanadát se často týká oxoaniontů vanadium, z nichž většina existuje ve své nejvyšší oxidační stav +5. Komplexy [V (CN)6]3- a [V2Cl9]3- jsou označovány jako hexacyanovanadate a nonachlorodivanadate.
Jednoduchý iont vanadátu je čtyřboký, orthovanadičnan, VO3−
4 anion, který je přítomen např. orthovanadičnan sodný a v řešeních PROTI2Ó5 v silné základně (pH > 13[1]). Obvykle je tento iont reprezentován jednoduchou dvojnou vazbou, nicméně toto je a rezonanční forma protože ion je pravidelný čtyřstěn se čtyřmi ekvivalentními atomy kyslíku.
Kromě toho existuje řada polyoxovanadátových iontů, které zahrnují diskrétní ionty a „nekonečné“ polymerní ionty.[2] Existují také vanadáty, jako je vanadičnan rhodnatý, RhVO4, který má statistický rutil struktura, kde Rh3+ a V5+ ionty náhodně zabírají Ti4+ polohy v rutilové mřížce,[3] které neobsahují mřížku kationtů a vyrovnávací vanadátové anionty, ale jsou směsné oxidy.
Když v chemické nomenklatuře tvoří vanadičnan část názvu, znamená to, že sloučenina obsahuje anion s centrálním atomem vanadu, např. hexafluorovanadát amonný je běžný název sloučeniny (NH4)3VF6 s Název IUPAC hexafluoridovanadátu amonného (III).
Příklady oxovanadátových iontů
Některé příklady diskrétních iontů jsou
- VO3−
4 "orthovanadate", čtyřboká.[2] - PROTI
2Ó4−
7 "pyrovanadate", VO sdílené VO4 čtyřstěn, podobný dichroman ion[2] - PROTI
3Ó3−
9, cyklický s VO sdíleným v rohu4 čtyřstěn[4] - PROTI
4Ó4−
12, cyklický s VO sdíleným v rohu4 čtyřstěn[5] - PROTI
5Ó3−
14, roh sdílený VO4 čtyřstěn[6] - PROTI
6Ó6−
18, prsten.[7] - PROTI
10Ó6−
28 „decavanadate“, VO sdílené na hraně a v rohu6 oktaedra[2] - PROTI
12Ó4−
32 - PROTI
13Ó3−
34, kondenzované VO6 oktaedra [8] - PROTI
18Ó12−
42[9]
Některé příklady polymerních „nekonečných“ iontů jsou
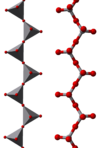 |  | 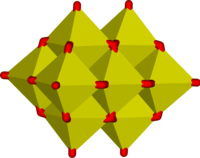 |
V těchto iontech vykazuje vanad čtyřbokou, čtvercovou pyramidální a oktaedrickou koordinaci. V tomto ohledu vykazuje vanad podobnost s wolfstate a molybdenan zatímco chrom má však omezenější rozsah iontů.
Vodní roztoky
Rozpuštěním oxidu vanadičitého v silně bazickém vodném roztoku se získá bezbarvá látka VO3−
4 ion. Po okyselení barva tohoto roztoku postupně ztmavne přes oranžovou až červenou při pH okolo 7. Hnědá hydratovaná V2Ó5 sráží kolem pH 2, znovu se rozpustí za vzniku světle žlutého roztoku obsahujícího [VO2(H2Ó)4]+ ion. Počet a identita oxyaniontů, které existují mezi pH 13 a 2, závisí na pH a také na koncentraci. Například protonace vanadátu iniciuje řadu kondenzace k výrobě polyoxovanadátových iontů:[2]
- pH 9–12; HVO2−
4, PROTI
2Ó4−
7 - pH 4–9; H
2VO−
4, PROTI
4Ó4−
12, HV
10Ó5−
28 - pH 2–4; H3VO4, H
2PROTI
10Ó4−
28
Farmakologické vlastnosti
Vanadát je silným inhibitorem určité plazmatické membrány ATPázy, jako Na+/ K.+-ATPase a Ca2+-ATPase (PMCA ). Vanadát, který působí jako analoga fosfátu v přechodovém stavu, prochází během přenosu fosforylu nukleofilním útokem vody, což v podstatě „zachycuje“ ATPázy typu P ve svém fosforylovaném stavu E2.[11][12] Neinhibuje však jiné ATPázy, jako např SERCA (sarko / endoplazmatické retikulum Ca2+-ATPáza), aktomyosinová ATPáza a mitochondriální ATPáza.[13][14][15]
Reference
- ^ Cotton, F. Albert; Wilkinson, Geoffrey; Murillo, Carlos A .; Bochmann, Manfred (1999), Pokročilá anorganická chemie (6. vydání), New York: Wiley-Interscience, ISBN 0-471-19957-5
- ^ A b C d E F Greenwood, Norman N.; Earnshaw, Alan (1997). Chemie prvků (2. vyd.). Butterworth-Heinemann. ISBN 978-0-08-037941-8.
- ^ Wells A.F. (1984) Strukturní anorganická chemie 5. vydání Oxford Science Publications ISBN 0-19-855370-6
- ^ Hamilton E. E .; Fanwick P.E .; Wilker J.J. (2002). „Nepolapitelný Vanadate (V3Ó9)3−: Izolace, krystalová struktura a chování nevodného roztoku ". J. Am. Chem. Soc. 124 (1): 78–82. doi:10.1021 / ja010820r. PMID 11772064.
- ^ G.-Y. Yang, D.-W. Gao, Y. Chen, J.-Q. Xu, Q.-X. Zeng, H.-R. Sun, Z.-W. Pei, Q. Su, Y. Xing, Y.-H. Ling a H.-Q. Jia (1998). "[Ni (C.10H8N2)3] 2 [V4Ó12] · 11H2Ó". Acta Crystallographica C. 54 (5): 616–618. doi:10.1107 / S0108270197018751.CS1 maint: více jmen: seznam autorů (odkaz)
- ^ V. W. Day; Walter G. Klemperer; O. M. Yaghi (1989). "Nový typ struktury v polyoxoanionové chemii: syntéza a struktura PROTI
5Ó3−
14 anion ". J. Am. Chem. Soc. 111 (12): 4518. doi:10.1021 / ja00194a068. - ^ Guang-Chuan Ou .; Long Jiang; Xiao-Long Feng; Tong-Bu Lu (2009). „Vanadové polyoxoanionem přemostěné makrocyklické komplexy kovů: od jednorozměrných po trojrozměrné struktury“. Daltonské transakce. 1 (1): 71–76. doi:10.1039 / B810802A. PMID 19081973.
- ^ Hou D .; Hagen K.D .; Hill C.L. (1992). „Tridecavanadate, [V13Ó34]3−, nový isopolyvanadát s vysokým potenciálem “. J. Am. Chem. Soc. 114 (14): 5864. doi:10.1021 / ja00040a061.
- ^ Müller A .; Sessoli R .; Krickemeyer E .; Bögge H .; Meyer J .; Gatteschi D .; Pardi L .; Westphal J .; Hovemeier K .; Rohlfing R .; Döring J; Hellweg F .; Beugholt C .; Schmidtmann M. (1997). „Polyoxovanadates: High-Nuclearity Spin Clusters with Interesting Host-Guest Systems and different Electron Population. Synthesis, Spin Organisation, Magnetochemistry, and Spectroscopic Studies“. Inorg. Chem. 36 (23): 5239. doi:10.1021 / ic9703641.
- ^ Jouanneau, S .; Verbaere, A .; Guyomard, D. (2003). „Na novém vanadičnanu vápenatém: syntéza, struktura a chování při vkládání Li“. Journal of Solid State Chemistry. 172 (1): 116–122. Bibcode:2003JSSCh.172..116J. doi:10.1016 / S0022-4596 (02) 00164-0.
- ^ Kühlbrandt, Werner (duben 2004). "Biologie, struktura a mechanismus P-typu ATPáz". Recenze přírody. Molekulární buněčná biologie. 5 (4): 282–295. doi:10.1038 / nrm1354. ISSN 1471-0072. PMID 15071553.
- ^ Davies, Douglas R .; Hol, Wim G.J. (2004-11-19). „Síla vanadátu v krystalografických zkouškách fosforylových přenosových enzymů“. FEBS Dopisy. 577 (3): 315–321. doi:10.1016 / j.febslet.2004.10.022. ISSN 0014-5793. PMID 15556602.
- ^ Luo D .; Nakazawa M .; Yoshida Y .; Cai J .; Imai S. (2000). "Účinky tří různých Ca2+ pumpovat inhibitory ATPázy na vyvolané kontrakce u králičí aorty a aktivity Ca2+ pumpovat ATPázy v prasečí aortě ". Obecná farmakologie: Cévní systém. 34 (3): 211–220. doi:10.1016 / S0306-3623 (00) 00064-1. PMID 11120383.
- ^ Bowman B.J .; Slayman C.W. (1979). "Účinky vanadátu na plazmatickou membránovou ATPázu Neurospora crassa". Journal of Biological Chemistry. 254 (8): 2928–2934. PMID 155060.
- ^ Aureliano, Manuel; Crans, Debbie C. (2009). „Dekanadát (PROTI
10Ó6−
28) a oxovanadáty: oxometaláty s mnoha biologickými účinky “. Journal of Anorganic Biochemistry. 103 (4): 536–546. doi:10.1016 / j.jinorgbio.2008.11.010. ISSN 0162-0134.
