Tungstate - Tungstate
4)
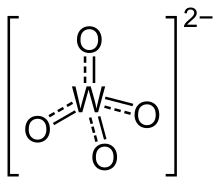
V chemii, a wolfstate je sloučenina, která obsahuje oxoanion z wolfram nebo je směsný oxid obsahující wolfram. Nejjednodušší wolfram ion je WO2−
4„orthotungstate“.[1] Mnoho dalších wolframů patří do velké skupiny polyatomových iontů, které se nazývají polyoxometaláty, („POM“), a konkrétně nazývané isopolyoxometalates, protože obsahují spolu s kyslíkem a možná vodíkem pouze jeden další prvek. Téměř všechny užitečné wolframové rudy jsou wolframové.[2]
Struktury
Orthotungstates mají čtyřboká W (VI) centra s krátkými W – O vzdálenostmi 1,79A. Strukturálně se podobají síranům. V polyoxotungstatech dominuje šestiřadý oktaedrický wolfram. V těchto sloučeninách jsou vzdálenosti W – O prodlouženy.[1]
Některé příklady iontů wolframanu:[3]
- HWO−
4 (hydrogentungstate)[3] - polymerní Ž
2Ó2−
7 ionty různých struktur v Na2Ž2Ó7, Li2Ž2Ó7 a Ag2Ž2Ó7[4] - [Ž7Ó24]6− (paratungstate A)[3]
- [Ž10Ó32]4− (wolframový Y)[5]
- [H2Ž12Ó42]10− (paratungstate B) [3]
- α- [H2Ž12Ó40]6− (metatungstate)[5]
- p- [H2Ž12Ó40]6− (tungstate X)[5]
Viz wolfstates kategorie pro seznam wolframů.
Výskyt
Wolframy se přirozeně vyskytují u molybdaty. Scheelite, minerální wolframan vápenatý, často obsahuje malé množství molybdenanu. Wolframit je mangan a železo wolframan, a to vše jsou cenné zdroje wolframu. Powellite je minerální forma molybdenanu vápenatého obsahující malé množství wolframanu.
Reakce
Řešení wolframů, jako ta z molybdaty, poskytněte intenzivně modré roztoky komplexního wolframanu (V, VI) analogického k molybden blues při redukci většinou organických materiálů.[1]
Na rozdíl od chromát, tungstate není dobrý okysličovadlo, ale stejně jako chroman, roztoky wolframanu kondenzují, aby po okyselení poskytly isopolytungstáty.
Reference
- ^ A b C Egon Wiberg, Arnold Frederick Holleman (2001). Anorganická chemie. Elsevier. ISBN 0-12-352651-5.
- ^ Lassner, Erik; Schubert, Wolf-Dieter; Lüderitz, Eberhard; Vlk ,, Hans Uwe (2005). "Wolfram, slitiny wolframu a sloučeniny wolframu". Ullmann's Encyclopedia of Industrial Chemistry. Weinheim: Wiley-VCH. doi:10.1002 / 14356007.a27_229.CS1 maint: extra interpunkce (odkaz)
- ^ A b C d Greenwood, Norman N.; Earnshaw, Alan (1997). Chemie prvků (2. vyd.). Butterworth-Heinemann. ISBN 978-0-08-037941-8.
- ^ Wells A.F. (1984) Strukturní anorganická chemie 5. vydání Oxford Science Publications ISBN 0-19-855370-6
- ^ A b C Jon A. McCleverty, N. G. Connelly, Nomenklatura anorganické chemie II: doporučení 2000, International Union of Pure and Applied Chemistry Commission on the Nomenclature of Anorganic Chemistry, Vydáno Royal Society of Chemistry, 2001, ISBN 0-85404-487-6
