Inhibitor proteázy (biologie) - Protease inhibitor (biology)
v biologie a biochemie, inhibitory proteázynebo antiproteázy,[1] jsou molekuly které potlačují funkci proteázy (enzymy tu pomoc rozklad bílkovin ). Mnoho přirozeně se vyskytujících inhibitorů proteázy je bílkoviny.
v lék, inhibitor proteázy se často používá zaměnitelně s alfa 1-antitrypsin (A1AT, což je z tohoto důvodu zkráceno PI).[2] A1AT je skutečně inhibitor proteázy, který se nejčastěji podílí na nemoci, konkrétně v nedostatek alfa-1 antitrypsinu.
Klasifikace
Inhibitory proteázy lze klasifikovat buď podle typu proteázy, kterou inhibují, nebo podle mechanismu účinku. V roce 2004 Rawlings a kolegové představili klasifikaci inhibitorů proteázy na základě podobností detekovatelných na úrovni aminokyselinové sekvence.[3] Tato klasifikace zpočátku identifikovala 48 rodin inhibitorů, které mohly být seskupeny do 26 příbuzných nadrodin (nebo klanů) podle jejich struktury. Podle Databáze MEROPS nyní existuje 81 rodin inhibitorů. Tyto rodiny jsou pojmenovány písmenem I, za kterým následuje číslo, například I14 hirudin podobné inhibitory.
Proteázou
Třídy proteázy jsou:
- Inhibitory asparagové proteázy
- Inhibitory cysteinové proteázy
- Inhibitory metaloproteáz
- Inhibitory serinové proteázy
- Inhibitory threoninové proteázy
- Inhibitory trypsinu
Mechanismem
Třídy inhibiční mechanismy účinku jsou:
- Inhibitor sebevraždy
- Inhibitor přechodového stavu
- Inhibitor proteinové proteázy (vidět serpiny )
- Chelatační činidla
Rodiny
Inhibitor I4
Toto je rodina proteáz inhibitory sebevraždy volal serpiny. Obsahuje inhibitory více rodin cysteinových a serinových proteáz. Jejich mechanismus akce závisí na tom, že podstoupí velkou konformační změna který deaktivuje jejich cíl katalytická triáda.
Inhibitor I9
| Inhibitor peptidázy I9 | |||||||||
|---|---|---|---|---|---|---|---|---|---|
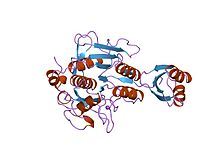 prosegment subtilisin bpn '(77 zbytků) komplexovaný s mutantním subtilisinem bpn' (266 zbytků). krystal ph 4.6. teplota krystalizace 20 ° C difrakční teplota-160 ° C | |||||||||
| Identifikátory | |||||||||
| Symbol | Inhibitor_I9 | ||||||||
| Pfam | PF05922 | ||||||||
| InterPro | IPR010259 | ||||||||
| MEROPS | I9 | ||||||||
| SCOP2 | 1gns / Rozsah / SUPFAM | ||||||||
| |||||||||
Inhibitory proteázového propeptidu (někdy označované jako aktivační peptidy) jsou odpovědné za modulaci skládací a aktivita proenzymu peptidázy nebo zymogen. Prosegment se zakotví do enzymu a stíní Podklad vazebné místo, čímž podporuje inhibici enzymu. Několik takových propeptidů sdílí podobnou topologii, přestože jsou často nízké sekvence identity.[4][5] Propeptidová oblast má otevřený sendvičový antiparallel-alfa / antiparallel-beta fold, se dvěma alfa-šroubovice a čtyři beta-prameny s topologií (beta / alfa / beta) x2. Rodina inhibitorů peptidázy I9 obsahuje propeptidovou doménu na N-konec peptidáz patřících do rodiny MEROPS S8A, subtilisiny. Propeptid se odstraní proteolytickým štěpením; odstranění aktivující enzym.
Inhibitor I10
| Inhibitory serinové endopeptidázy | |||||||||
|---|---|---|---|---|---|---|---|---|---|
 struktura roztoku marinostatinu, inhibitoru proteázy, obsahující dvě esterové vazby | |||||||||
| Identifikátory | |||||||||
| Symbol | Inhibitor_I10 | ||||||||
| Pfam | PF12559 | ||||||||
| InterPro | IPR022217 | ||||||||
| |||||||||
Tato rodina zahrnuje jak mikroviridiny, tak marinostatiny. Je pravděpodobné, že v obou případech se jedná o C-konec který se stává aktivním inhibitor po posttranslační úpravy plné délky pre-peptidu. To je ester vazby v klíčové oblasti se 12 zbytky, které cirkulují molekula což mu dává inhibici konformace.
Inhibitor I24
| Inhibitor PinA peptidázy | |||||||||
|---|---|---|---|---|---|---|---|---|---|
| Identifikátory | |||||||||
| Symbol | Inhibitor_I24 | ||||||||
| Pfam | PF10465 | ||||||||
| InterPro | IPR019506 | ||||||||
| MEROPS | I24 | ||||||||
| |||||||||
Tato rodina zahrnuje PinA, který inhibuje the endopeptidáza La. Váže se na La homotetramer ale nezasahuje do ATP vazebné místo nebo aktivní stránky La.
Inhibitor I29
| Doména inhibitoru katepsin propeptidu (I29) | |||||||||
|---|---|---|---|---|---|---|---|---|---|
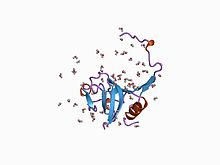 krystalová struktura proformy cysteinové proteázy | |||||||||
| Identifikátory | |||||||||
| Symbol | Inhibitor_I29 | ||||||||
| Pfam | PF08246 | ||||||||
| InterPro | IPR013201 | ||||||||
| |||||||||
Inhibitor I29 doména, který patří do rodiny inhibitorů peptidů MEROPS I29, se nachází na N-konec různých peptidáza prekurzory, které patří do MEROPS peptidázové podčeledi C1A; tyto zahrnují katepsin L, papain a prokaikin.[6] Tvoří alfa-šroubovice doména, která prochází místem vázajícím substrát a brání přístupu. Odebrání této oblasti do proteolytický štěpení vede k aktivaci enzym. Tato doména se také nachází v jedné nebo více kopiích v řadě inhibitorů cysteinové peptidázy, jako je salarin.[7]
Inhibitor I34
| Inhibitor sacharopepsinu I34 | |||||||||
|---|---|---|---|---|---|---|---|---|---|
 struktura proteinázy v komplexu s inhibitorem mutantu ia3 | |||||||||
| Identifikátory | |||||||||
| Symbol | Inhibitor_I34 | ||||||||
| Pfam | PF10466 | ||||||||
| InterPro | IPR019507 | ||||||||
| MEROPS | I34 | ||||||||
| |||||||||
Sacharopepsin inhibitor I34 je vysoce specifický pro aspartátovou peptidázu sacharopepsin. Při absenci sacharopepsinu je do značné míry nestrukturovaný,[8] ale za jeho přítomnosti inhibitor podstoupí a konformační změna tvoří téměř dokonalý alfa-šroubovice z Asn 2 až Se setkal 32 v Aktivní stránky rozštěp peptidázy.
Inhibitor I36
| Rodina inhibitorů peptidázy I36 | |||||||||
|---|---|---|---|---|---|---|---|---|---|
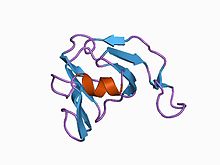 3d struktura inhibitoru streptomyces metaloproteinázy, smpi, izolovaná ze streptomyces nigrescens tk-23, nmr, minimalizovaná průměrná struktura | |||||||||
| Identifikátory | |||||||||
| Symbol | Inhibitor_I36 | ||||||||
| Pfam | PF03995 | ||||||||
| Pfam klan | CL0333 | ||||||||
| InterPro | IPR007141 | ||||||||
| MEROPS | I36 | ||||||||
| SCOP2 | 1bhu / Rozsah / SUPFAM | ||||||||
| |||||||||
Doména I36 rodiny inhibitorů peptidázy se nachází pouze u malého počtu domén bílkoviny omezeno na Streptomyces druh. Všichni mají čtyři konzervovaný cysteiny to pravděpodobně tvoří dva disulfidové vazby. Jeden z těchto bílkoviny z Streptomyces nigrescens, je dobře charakterizovaná metaloproteináza inhibitor SMPI.[9][10]
The struktura SMPI byla stanovena. Má 102 aminokyselina zbytky se dvěma disulfidovými můstky a konkrétně inhibuje metaloproteinázy jako např termolyzin, který patří společnosti MEROPS peptidáza rodina M4. SMPI se skládá ze dvou beta-listy, každý se skládá ze čtyř antiparalelní beta-prameny. Strukturu lze považovat za dva motivy řeckých klíčů s dvojnásobnou vnitřní symetrií, řecký klíč beta-barel. Jeden jedinečný strukturální rys nalezený v SMPI je v jeho rozšíření mezi prvním a druhým vláknem druhého řeckého klíčového motivu, o kterém je známo, že se podílí na inhibiční aktivitě SMPI. Při absenci podobnosti sekvence je SMPI struktura vykazuje jasnou podobnost s oběma domén oční čočky krystaliny, oba domén vápníkového senzoru proteinu-S, stejně jako single-doména droždí zabiják toxin. Struktura toxinu zabijáka kvasinek byla považována za předchůdce dvou-doménových beta gama-krystalinových proteinů, kvůli jejich strukturní podobnosti s každou doménou beta gama-krystalinů. SMPI tak poskytuje další příklad jednodoménové proteinové struktury, která odpovídá předku složit z nichž jsou dvoudoménové proteiny v beta gama-krystalinu nadčeleď věří se, že mají vyvinul.[11]
Inhibitor I42
| Inhibitor peptiduázy rodiny Chagasinů I42 | |||||||||
|---|---|---|---|---|---|---|---|---|---|
 struktura roztoku inhibitoru cypaninové proteázy trypanosoma cruzi chagasin | |||||||||
| Identifikátory | |||||||||
| Symbol | Inhibitor_I42 | ||||||||
| Pfam | PF09394 | ||||||||
| InterPro | IPR018990 | ||||||||
| MEROPS | I42 | ||||||||
| |||||||||
Rodina inhibitorů I42 zahrnuje chagasin, reverzibilní inhibitor papain -jako cysteinové proteázy.[12] Chagasin má beta-barel struktura, která je jedinečnou variantou imunoglobulin složit pomocí homologie na člověk CD8alfa.[13][14]
Inhibitor I48
| Inhibitor peptidázy klitocypin | |||||||||
|---|---|---|---|---|---|---|---|---|---|
| Identifikátory | |||||||||
| Symbol | Inhibitor_I48 | ||||||||
| Pfam | PF10467 | ||||||||
| InterPro | IPR019508 | ||||||||
| MEROPS | I48 | ||||||||
| |||||||||
Rodina inhibitorů I48 zahrnuje clitocypin, který se váže a inhibuje cysteinové proteinázy. Nemá žádnou podobnost s žádnými jinými známými inhibitory cysteinové proteinázy, ale má určitou podobnost s a lektin -jako rodina proteinů z houby.[15]
Inhibitor I53
| Inhibitor trombinu Madanin | |||||||||
|---|---|---|---|---|---|---|---|---|---|
| Identifikátory | |||||||||
| Symbol | Inhibitor_I53 | ||||||||
| Pfam | PF11714 | ||||||||
| InterPro | IPR021716 | ||||||||
| MEROPS | I53 | ||||||||
| |||||||||
Členy této rodiny jsou peptidáza inhibitor madanin bílkoviny. Tyto bílkoviny byly izolovány od klíště sliny.[16]
Inhibitor I67
| Inhibitor bromelainu VI | |||||||||
|---|---|---|---|---|---|---|---|---|---|
 NMR struktura inhibitoru bromelainu vi z ananasu | |||||||||
| Identifikátory | |||||||||
| Symbol | Inhibitor_I67 | ||||||||
| Pfam | PF11405 | ||||||||
| InterPro | IPR022713 | ||||||||
| MEROPS | I67 | ||||||||
| |||||||||
Bromelain inhibitor VI, v rodině Inhibitor I67, je dvojitý řetězec inhibitor sestávající z 11 zbytku a 41 zbytku řetěz.
Inhibitor I68
| Inhibitor karboxypeptidázy I68 | |||||||||
|---|---|---|---|---|---|---|---|---|---|
 krystalová struktura inhibitoru karboxypeptidázy klíšťat v komplexu s lidskou karboxypeptidázou b | |||||||||
| Identifikátory | |||||||||
| Symbol | Inhibitor_I68 | ||||||||
| Pfam | PF10468 | ||||||||
| InterPro | IPR019509 | ||||||||
| MEROPS | I68 | ||||||||
| |||||||||
Rodina inhibitorů karboxypeptidázy I68 představuje skupinu inhibitorů karboxypetidázy klíšťat.
Inhibitor I78
| Rodina inhibitoru peptidázy I78 | |||||||||
|---|---|---|---|---|---|---|---|---|---|
| Identifikátory | |||||||||
| Symbol | Inhibitor_I78 | ||||||||
| Pfam | PF11720 | ||||||||
| Pfam klan | CL0367 | ||||||||
| InterPro | IPR021719 | ||||||||
| MEROPS | I78 | ||||||||
| |||||||||
Rodina inhibitoru peptidázy I78 zahrnuje Aspergillus elastáza inhibitor.
Sloučeniny
- Aprotinin
- Bestatin
- Inhibitor kalpainu I a II
- Chymostatin
- E-64
- Leupeptin (N-acetyl-L-leucyl-L-leucyl-L-argininal)
- alfa-2-makroglobulin
- Pefabloc SC
- Pepstatin
- PMSF (fenylmethansulfonylfluorid)
- TLCK
- Inhibitory trypsinu
Viz také
Reference
- ^ "antiproteáza". Svobodný slovník.
- ^ OMIM - INHIBITOR PROTEASE 1; PI
- ^ Rawlings ND, Tolle DP, Barrett AJ (březen 2004). "Evoluční rodiny inhibitorů peptidázy". Biochem. J. 378 (Pt 3): 705–16. doi:10.1042 / BJ20031825. PMC 1224039. PMID 14705960.
- ^ Tangrea MA, Bryan PN, Sari N, Orban J (červenec 2002). "Struktura řešení pro-domény pro-hormonální konvertázy 1 z Mus musculus". J. Mol. Biol. 320 (4): 801–12. doi:10.1016 / S0022-2836 (02) 00543-0. PMID 12095256.
- ^ Jain SC, Shinde U, Li Y, Inouye M, Berman HM (listopad 1998). "Krystalová struktura autoprocesovaného komplexu Ser221Cys-subtilisin E-propeptidu v rozlišení 2,0 A". J. Mol. Biol. 284 (1): 137–44. doi:10.1006 / jmbi.1998.2161. PMID 9811547.
- ^ Groves MR, Taylor MA, Scott M, Cummings NJ, Pickersgill RW, Jenkins JA (říjen 1996). „Prosekvence prokarakinu tvoří alfasovitou doménu, která brání přístupu k štěrbině vázající substrát“. Struktura. 4 (10): 1193–203. doi:10.1016 / s0969-2126 (96) 00127-x. PMID 8939744.
- ^ Olonen A, Kalkkinen N, Paulin L (červenec 2003). "Nový typ inhibitoru cysteinové proteinázy - gen salarinu z lososa atlantického (Salmo salar L.) a arktického charra (Salvelinus alpinus)". Biochimie. 85 (7): 677–81. doi:10.1016 / S0300-9084 (03) 00128-7. PMID 14505823.
- ^ Green TB, Ganesh O, Perry K, Smith L, Phylip LH, Logan TM, Hagen SJ, Dunn BM, Edison AS (duben 2004). „IA3, inhibitor aspartátové proteinázy ze Saccharomyces cerevisiae, je v roztoku skutečně nestrukturovaný“. Biochemie. 43 (14): 4071–81. doi:10.1021 / bi034823n. PMID 15065849.
- ^ Tanaka K, Aoki H, Oda K, Murao S, Saito H, Takahashi H (listopad 1990). „Nukleotidová sekvence genu pro inhibitor metaloproteinázy Streptomyces nigrescens (SMPI)“. Nucleic Acids Res. 18 (21): 6433. doi:10.1093 / nar / 18.21.6433. PMC 332545. PMID 2243793.
- ^ Murai H, Hara S, Ikenaka T, Oda K, Murao S (leden 1985). „Aminokyselinová sekvence inhibitoru metaloproteinázy Streptomyces ze Streptomyces nigrescens TK-23“. J. Biochem. 97 (1): 173–80. doi:10.1093 / oxfordjournals.jbchem.a135041. PMID 3888972.
- ^ Ohno A, Tate S, Seeram SS, Hiraga K, Swindells MB, Oda K, Kainosho M (září 1998). „NMR struktura inhibitoru metaloproteinázy Streptomyces, SMPI, izolovaného ze Streptomyces nigrescens TK-23: další příklad struktury prekurzoru beta gama-krystalinu předků předků“. J. Mol. Biol. 282 (2): 421–33. doi:10.1006 / jmbi.1998.2022. PMID 9735297.
- ^ Monteiro AC, Abrahamson M, Lima AP, Vannier-Santos MA, Scharfstein J (listopad 2001). „Identifikace, charakterizace a lokalizace chagasinu, inhibitoru cysteinové proteázy s pevnou vazbou u Trypanosoma cruzi“. J. Cell Sci. 114 (Pt 21): 3933–42. PMID 11719560.
- ^ Figueiredo da Silva AA; de Carvalho Vieira L; Krieger MA; Goldenberg S; Zanchin NI; Guimarães BG (únor 2007). "Krystalová struktura chagasinu, endogenního inhibitoru cystein-proteázy z Trypanosoma cruzi". J. Struct. Biol. 157 (2): 416–23. doi:10.1016 / j.jsb.2006.07.017. PMID 17011790.
- ^ Wang SX, Pandey KC, Scharfstein J, Whisstock J, Huang RK, Jacobelli J, Fletterick RJ, Rosenthal PJ, Abrahamson M, Brinen LS, Rossi A, Sali A, McKerrow JH (květen 2007). „Struktura chagasinu v komplexu s cysteinovou proteázou objasňuje způsob vazby a vývoj rodiny inhibitorů“. Struktura. 15 (5): 535–43. doi:10.1016 / j.str.2007.03.012. PMID 17502099.
- ^ Brzin J, Rogelj B, Popovic T, Strukelj B, Ritonja A (červen 2000). „Clitocypin, nový typ inhibitoru cysteinové proteinázy z plodnic houby clitocybe nebularis“. J. Biol. Chem. 275 (26): 20104–9. doi:10,1074 / jbc.M001392200. PMID 10748021.
- ^ Iwanaga S, Okada M, Isawa H, Morita A, Yuda M, Chinzei Y (květen 2003). "Identifikace a charakterizace nových inhibitorů slinného trombinu z klíště ixodidae, Haemaphysalis longicornis". Eur. J. Biochem. 270 (9): 1926–34. doi:10.1046 / j.1432-1033.2003.03560.x. PMID 12709051.
