Inhibitor metaloproteázy - Metalloprotease inhibitor
Inhibitory metaloproteáz jsou mobilní inhibitory z Matricové metaloproteinázy (MMP).[1] MMP patří do rodiny zinek -závislý neutrál endopeptidázy.[2] Tyto enzymy mít schopnost rozebrat se pojivová tkáň. Exprese MMP se u různých zvyšuje patologické podmínky jako zánětlivé podmínky, metabolické onemocnění kostí, do rakovina invaze, metastáza a angiogeneze.Příklady nemocí jsou paradentóza, hepatitida, glomerulonefritida, ateroskleróza, emfyzém, astma, autoimunitní poruchy fotoagingu kůže a kůže, revmatoidní artritida, artróza, roztroušená skleróza, Alzheimerova choroba chronické ulcerace, involuce dělohy, defekty epitelu rohovky, kostní resorpce a progrese nádoru a metastázy.[2][3] Vzhledem k roli MMP v patologických stavech mohou mít inhibitory MMP terapeutický potenciál.[3] Několik dalších proteinů má podobné inhibiční účinky, nicméně žádný z nich není tak účinný (netriny, prokolagenový zesilovač C-terminální proteinázy (PCPE), reverzně indukující protein bohatý na cystein s kazalskými motivy (RECK) a inhibitor dráhy tkáňového faktoru (TFPI-2)). Mohli by mít další biologické aktivity, které dosud nebyly plně charakterizovány.[4]
Inhibitory MMP lze obecně rozdělit na nesyntetické (např. endogenní ) nebo syntetický.[2] Bylo identifikováno několik silných inhibitorů MMP, včetně hydroxymatů, thioly, karbamoylfosfonáty, hydroxymočoviny, hydraziny, β-laktamy, kyseliny čtvercové a dusíkaté ligandy.[5]
Existují tři třídy běžně používaných inhibitory pro metaloproteinázy.
- In vitro, EDTA, 1,10-fenanthrolin a další chelatační sloučeniny snížit koncentraci kovu do bodu, kde je kov odstraněn z enzym Aktivní stránky.
- Klasické inhibitory zámku a klíčů, jako je fosforamidon a bestatin svázat pevně přiblížením přechodový stav hydrolýzy peptidu, což mu brání v působení na jiné substráty.
- Inhibitory bílkovin, jako je α2-makroglobulin je známo, že pracují s metaloproteinázami.
Dějiny
První generace inhibitorů MMP byla založena na struktuře kolagen molekula. Tato skupina inhibitorů obsahuje a hydroxamát (-CONHOH) skupina, která váže zinek atom v aktivním místě enzymu MMP.[6] První inhibitory MMP, které byly testovány na pacientech, byly Ilomastat a Batimastat, inhibitory MMP na bázi hydroxamátu.[6][7] Nicméně ani jedno sloučenina ukázal dobrý orál biologická dostupnost.[6]
Tak daleko, Periostat (aktivní složkou je doxycyklin hyklát) je jediný inhibitor MMP, který byl schválen USA Úřad pro kontrolu potravin a léčiv (FDA). Používá se k léčbě paradentózy. Jiné inhibitory MMP se projevily vážně vedlejší efekty v době předklinické studie. Tyto nežádoucí účinky jsou způsobeny nedostatečným selektivita. Většina inhibitorů MMP není schopna cílit na specifické MMP spojené se specifickými patologickými účinky podmínky. Místo toho inhibují více MMP, z nichž některé mají ochranné funkce nebo nesouvisí s patologií.[5]
MMP byly považovány za slibné cíle pro léčbu rakoviny. Předklinické studie zkoumající účinnost potlačení MMP na modelech nádorů byly povzbudivé. Po těchto výsledcích byly provedeny klinické studie, ale ukázalo se, že jsou zklamáním. Nedávné studie ukázaly, že MMP mohou dokonce mít paradoxní role v progresi nádoru. Zdá se, že MMP mají také účinky podporující nádor nádor potlačující účinky závislé na různých kontextech.[8]
Mechanismus účinku

Většina inhibitorů MMP je chelatační činidla. Inhibitor se váže na zinek v aktivním centru enzymu, čímž blokuje jeho aktivitu. Jsou možné i jiné inhibiční mechanismy.[1]
α2-makroglobulin (α2M) je a proteáza inhibitor, který inhibuje aktivované MMP. α2M a MMP tvoří a komplex který je schopen deaktivovat MMP.[9]
MMP jsou spojeny s buňka povrch nebo vázaný na extracelulární matrix což jim brání rozptylující pryč a udržuje MMP pod kontrolou buňky. Jeden mechanismus k inhibici aktivity MMP je uvolněním enzymů z jejich receptory. Zlato soli vázat na těžký kov odlišné místo od aktivního centra obsahujícího zinek, které inhibuje jejich aktivitu. Aktivita MMP může být snížena vazbou na místo štěpení na Podklad např. katechin.[1]
Dva molekulární vlastnosti většiny inhibitorů MMP jsou odpovědné za afinita. Jedním z nich je chelatace skupina že interaguje s iontem zinku a druhým je a hydrofobní prodloužení z katalytického místa, které vyčnívá do kapsy S1 (skupina P1) metaloproteinázy. Strukturální rozdíl MMP je hlavně na straně S1 a modifikací skupiny P1 lze dosáhnout selektivity inhibitorů.[10]
Vývoj léků
V následujících částech budou vysvětleny různé potenciální inhibitory MMP, včetně informací o jejich vývoji, vztahu mezi strukturou a aktivitou a farmakokinetice.
Průkopnické hydroxamátové struktury
První generace inhibitorů MMP byla založena na struktuře molekuly kolagenu. V konstrukci těchto inhibitorů, základní protein páteř kolagenu se udržuje, ale amidová vazba je nahrazen skupinou vázající zinek.[11] Tato skupina inhibitorů obsahuje skupinu hydroxamátu (-CONHOH), která váže atom zinku v aktivním místě enzymu MMP, proto se této skupině říká „inhibitory MMP na bázi hydroxamátu“.[6] Příklad lze vidět v Marimastat, inhibitor první generace, který má podobný formát páteře a postranního řetězce jako kolagen.

Ilomastat a batimastat byli první dva inhibitory MMP, které byly testovány na pacientech. Oba jsou to inhibitory MMP na bázi hydroxamátu a mají podobné celkové struktury.

Inhibitory MMP na bázi hydroxamátu vykazují vynikající výsledky protinádorový aktivita v nádorových buňkách, ale klinické výkony těchto sloučenin byly zklamáním. Faktorem přispívajícím k tomuto zklamání bylo, že se jedná o širokospektrální inhibitory mnoha podtypů MMP, které mohou v mnoha případech také inhibovat členy rodiny proteáz ADAMs. Když byly testovány na pacientech, vyvolaly omezení dávky svalnatý a kosterní bolest u řady pacientů.[5][7] Pouze tehdy, když bylo možné upravit struktury inhibitorů MMP tak, aby dodávaly selektivitu a byly zrušeny toxicita, dosáhli by klinického dopadu při chemoterapii rakoviny.[7]
Inhibitory na bázi hydroxamátu nové generace
Za průkopnickými inhibitory na bázi hydroxamátu následovala sada molekul „nové generace“ se znaky včetně a nahrazeno aryl, a sulfonamid a a hydroxamát skupina vázající zinek.

V MMI-270 je také aminokyselina substituent typu postranního řetězce na uhlíku, který je α k hydroxamátu, spolu s postranním řetězcem na sulfonamidu (což se později ukázalo jako zbytečné). Hydroxamát N-arylsulfonyl-a-aminokyseliny MMI-270 napodobuje marimastat sukcinát motiv. Cipemastat, který byl vyvinut jako MMP-1, -3 a -9 inhibitor kolagenázy pro léčba z revmatoidní - a osteo -artritida, má také motiv sukcinátu marimastat. Jeho klinické hodnocení bylo předčasně ukončeno.
MMI-166 má N-arylsulfonyl-a-aminokarboxylátovou skupinu vázající zinek, odlišnou od skupiny vázající hydroxamát-zinek pozorovanou v MMI-270 a Cipemastatu. Má také triarylovou substituci, kterou ostatní struktury neměly. ABT-770 a Prinomastat také mají arylovou substituci. V ABT-770 jsou dva fenylové kruhy přímo spojeny, ale v Prinomastatu dva fenylové kruhy jsou spojeny pomocí kyslík atom, tvořící a difenylether. Tyto tři permutace řídí SAR od MMP-1 a směrem k „hlubokým kapesním“ MMP, jako je želatinázy. ABT-770 vykazuje protinádorovou aktivitu na zvířecích modelech, ale je snadno metabolizován na amin metabolit to způsobuje fosfolipidóza. MMI-166 prokázal protinádorovou aktivitu na mnoha zvířecích modelech, ale nejsou k dispozici žádné údaje o jeho klinickém výkonu. Prinomastat je na druhé straně jedním z nejlépe studovaných inhibitorů MMP. Ukázalo se to vynikající preklinické zvířecí protinádorové účinky účinnost, ale opakujícím se omezením těchto hydroxamátů (zejména Prinomastatu) je metabolismus léčiv včetně ztráty skupiny vázající hydroxamát zinek.

Za těmito inhibitory následovala další skupina inhibitorů na bázi hydroxamátu, která se zaměřuje na potlačení metabolismu, minimalizaci inhibiční aktivity MMP-1 a kontrolu selektivity podtypu, strukturním designem. The tetrahydropyran v RS-130830 zavádí a sterický blok, který potlačuje metabolismus, což by napravilo problém, který ukázala předchozí generace inhibitorů. Výsledek jeho klinického hodnocení dosud nebyl zveřejněn. 239796-97-5 se zlepšilo PŘIDEJ MĚ a MMP-1 selektivní vlastnosti a ukázal se jako vynikající ústní účinnost na zvířecím modelu osteoartrózy. Terapeutickým cílem těchto inhibitorů není rakovina, jako tomu bylo u většiny inhibitorů MMP.[7]
Inhibitory na bázi thiolu nové generace

Rebimastat je širokospektrální inhibitor MMP s a thiol skupina vázající zinek. Má orální biologickou dostupnost a je mimetikem nepeptidovým kolagenem. Rebimastat má určitou selektivitu, protože neinhibuje všechny operace MMP. Uvolňující se metaloproteinázy TNF-alfa, TNF-II, L-výběr, IL-1-RII a IL-6 například nejsou inhibovány přípravkem Rebimastat.
Ve fázi I dne klinické testy nebyly žádné známky závislosti na dávce kloub toxicita a stabilizace nemoci. Artralgie byl zaznamenán ve fázi II brzy rakovina prsu studie, která souvisela s toxicitou inhibitoru MMP. Rebimastat byl použit v a Paclitaxel /Karboplatina léčba ve fázi III. Výsledkem studie byl vyšší výskyt nežádoucí účinky, bez výhody přežití.

Klinické studie pro Tanomastat, alfa - ((fenylthio) methyl) karboxylát, vykázal podobné výsledky. Ukázalo dobrou stabilitu a toleranci onemocnění ve studiích solidních nádorů fáze I a dobrou toleranci u pokročilého karcinomu v kombinaci s Etoposid. Jeho účinnost se však neprokázala jako dostatečná. Tanomastat ukázal významný hepatotoxicita v léčbě rakoviny v kombinaci s Cisplatina a etoposid, i když v léčbě Doxorubicin vykazovala dobrou toleranci a snížila toxicitu s 5-fluorouracil a Leukovorin.
Mnoho sloučenin ve skupinách vázajících thiol na zinek má dobrou vodu rozpustnost a jsou vzduch stabilní v plazma a tyto skupiny budou pokračovat v navrhování inhibitorů MMP.[7]
Inhibitory na bázi pyrimidinu

Ro 28-2653 je vysoce selektivní pro MMP-2, MMP-9 a membrána typu 1 (MT-1 ) -MMP. Je to protinádorové a antiangiogenní činidlo s perorální biologickou dostupností. Inhibice TACE a MMP-1 jsou spojeny s muskuloskeletální vedlejší účinky pozorované u inhibitorů hydroxamát metaloproteinázy, ale tato sloučenina šetří enzymy.[12] Bylo prokázáno, že snižuje růst nádoru v nosní rakovina u potkanů stejně jako prostata rakovina buněčné kultury. Sloučenina má pouze mírný účinek na myši tuková tkáň a žádné změny na kloubech. Na základě toho se dospělo k závěru, že třída inhibitorů je méně pravděpodobná spoušť neuromuskulární nepříznivé účinky. Na aktivním místě struktury je a pyrimidinetrion chelace a fenyl a piperidynil sekce zabírají vázací kapsy S1 ’a S2’ MMP-8.
Sloučenina 556052-30-3 je podobná jako Ro 28-2653, ale obsahuje 4 - ((2-methylchinolin-4-yl) methoxy) fenylový postranní řetězec, který je selektivní pro TACE.
5- (spiropyrrolidin-5-yl) pyrimidinetrion je sloučenina s názvem 848773-43-3, která je silným inhibitorem MMP-2, MMP-9 a MMP-13, který šetří MMP-1 a TACE.
Substitucí 1,3,4-oxadiazol-2-yl heteroarylu na C-4 'difenyletherového segmentu k dosažení MMP-13 selektivita vůči MT-1 MMP, učinila sloučeninu 420121-84-2. Sloučenina má IC50 (poloviční maximální inhibiční koncentrace) 1 nM pro MMP-13.
Bylo vyrobeno 1125-radioaktivních pyrimidinetrionů, které mají podobnou strukturu pro použití u MMP-9 zvýšené aterosklerózy a zvýšené MMP-2 a MMP-9 rakoviny.
Tato třída inhibitorů MMP je snadná syntetizovat a jsou silný dost pro klinické hodnocení.


Sloučenina 544678-85 je nejnovější inhibitor na bázi pyrimidinu, sloučeninou je pyrimidin-4,6-dikarboxamid, který je velmi účinný a selektivní pro MMP-13. Sloučenina má smyčku specificity, která je uvnitř kapsy S1 'a její 3-methyl-4-fluoro skupina je dostatečně blízko k zinku, aby změnila vodní entitu. Tyto sloučeniny mají dobrou orální biologickou dostupnost a vlastnosti, které je podporují jako dobrého kandidáta na podtypový inhibitor onemocnění založených na MMP-13 a budoucího vývoje.[7]
Pyrimidin dikarboxamidy jsou vysoce selektivní inhibitory MMP-13. V kapse S1 MMP-13 je boční kapsa S1, která je jedinečná pro maticovou metaloproteázu. Pyrimidindikarboxamidy se vážou na tuto boční kapsu, což zvyšuje selektivitu. Role MMP-13 se štěpí fibrilární kolagen neutrál pH a vyšší mRNA hladiny MMP-13 jsou detekovány v prsu karcinom a klouby osteoartrózy.
Příklad inhibitoru pyrimidinkarboxamidu na obrázku neinteraguje s katalytickým iontem zinku, ale spíše se váže na boční kapsu S1.[10] Jeden pyridyl rameno je umístěno ke vstupu do kapsy S1 ', zatímco druhé pyridylové rameno prochází kapsou S1' do boční kapsy.[13]
Inhibitory na bázi hydroxypyronu
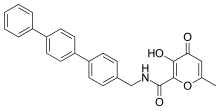
Účinné a selektivní inhibitory MMP-3 byly vyvinuty za použití hydroxypyronu jako skupiny vázající zinek. Připevněním arylového páteře do polohy 2 pyron kruhu, byla získána větší selektivita. Na hydroxypyronovém kruhu jsou k dispozici tři polohy pro připojení páteří, pozice 2-, 5- a 6-.[14]
Inhibitory MMP na bázi hydroxypyronu strukturně odpovídají pyrimidinetrionům. Nedávným inhibitorem je sloučenina 3-hydroxypyran-4-on nominovaná 868368-30-3. to je MMP-3 selektivní a jeho 0,0-bidentate chelatace zinku je strukturální část navržená jako odpovědná za MMP uznání.[7]
Inhibitory na bázi fosforu

Vyšetřování inhibitorů MMP s fosfor na bázi zinku vázající skupiny zaměřené na a-bifenylsulfonylaminofosfonáty. Tyto inhibitory se vážou přes dva fosfonátové atomy kyslíku. Byly vyvinuty inhibitory fosfonátů, které vykazují selektivitu pro MMP-8 oproti jiným MMP. Selektivní inhibitory MMP-8 mohou být užitečné při léčbě akutního onemocnění jater a roztroušená skleróza[15] Fosfinické inhibitory MMP byly údajně zaměřeny MMP-11 a MMP-13. MMP-13 hraje roli v chrupavka degradace při osteoartróze. Tyto fosfinátové inhibitory MMP obsahují fenylové segmenty, o nichž se předpokládá, že jsou odpovědné za selektivitu k MMP-13. Fosfinová skupina těchto inhibitorů (R.1R2 (O) OH) se váže jako ligand zinku. R1 a R.2 substituenty ovlivňují inhibiční účinnost.[7]
Byly vyvinuty inhibitory fosfinátu, které vykazovaly vysokou selektivitu pro MMP-11. Deriváty založené na fenylových kruzích vykazovaly nejlepší selektivitu. MMP-11 by mohl být užitečným cílem pro tumorgeneze u rakoviny prsu.

Inhibitory na bázi fosforu s karbamoyl fosfonátové skupiny vázající zinek se neváží přes dva kyslík fosfonátu. Skupiny vázající karbamoyl fosfonát zinek váží Zn2+ přes kyslík fosfonátu a kyslík z alfa karbonyl k fosfonátu. Tato vazba tvoří 5členný chelátový kruh, který vypadá podobně jako vazba kyseliny hydroxamové.
The amidová vazba karbamoylfosfonátu poskytují a vodíková vazba dárce pro protein interakce a amidová skupina má elektron darovací schopnost, která poskytuje silné Zn2+ chelatace. Skupiny vázající karbamoyl fosfonát zinek mají čistý zápor nabít který brání pronikání těchto inhibitorů do buněk a omezuje je na extracelulární prostor. Tato prevence buněčné penetrace přispívá k nízké toxicitě těchto inhibitorů. Inhibitory se skupinou vázající karbamoyl fosfonát zinek jsou selektivní pro MMP-2. MMP-2 může být užitečný cílová pro invazi nádoru a angiogeneze. Byl vyvinut inhibitor karbamoylfosfonátu, který ovlivňuje MMP-2 a MMP-9 šetřící jiné MMP. Tato sloučenina vykazovala inhibiční aktivitu na buněčnou invazi a nádor kolonizace. v in vivo studiích prokázal tento inhibitor účinnost při perorálním podání dávkování a správa do břišní dutina (intraperitoneální). Ukazuje se to pomalu vstřebávání, rychlý odstranění a orální biologická dostupnost. Prodloužená absorpce přispívá k trvalé účinnosti. Inhibitory s karbamoylfosfonátovými vazebnými skupinami zinku jsou rozpustné ve vodě při fyziologický pH.[15]
Inhibitory na bázi tetracyklinů

Tetracykliny jsou antibiotika které také vykazují MMP inhibiční aktivitu. Chelátují Zn2+ ion, čímž inhibuje aktivitu MMP. Předpokládá se, že tetracykliny také ovlivňují expresi MMP a proteolytickou aktivitu.[16]
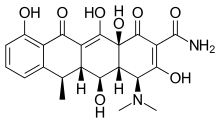
Doxycyklin je polosyntetický tetracyklin, který byl zkoumán zubní a lékařské aplikace. Jeho účinky na nemoci jako paradentóza a rakovina byla vyšetřována.[2] Doxycyklin je téměř úplně absorbován s biologickou dostupností v průměru asi 95% a snížením o 20% při současném podávání potravy. Své distribuční objem je 50–80 l (0,7 l / kg). Vazba na bílkoviny je 82–93%. to je vylučován v moči a ve stolici. Doxycyklin je k dispozici orálně a intravenózní formulář.[17] Doxycyklin vykazoval inhibiční aktivitu na MMP-2 a MMP-9.[2] Exprese a aktivita MMP-2 a MMP-9 jsou u lidské rakoviny často zvýšené. Zvýšená exprese a aktivita koreluje s pokročilým stadiem nádoru, zvýšenými metastázami a prognóza.[8]
Chemicky upraveno tetracykliny (CMT) byly vyvinuty s cílem prozkoumat jejich inhibiční potenciál. Většina studií s tetracykliny a CMT ukázala, že mohou inhibovat aktivitu MMP.

Ukázalo se, že jeden CMT zvaný COL-3 nebo metastat je silným inhibitorem MMP. COL-3 obsahuje tetracyklinové lešení, které je nesubstituované na pozicích C4 – C9.[16]
Výhody CMT nad konvenční tetracykliny jsou to, co při chronickém užívání nevede gastrointestinální toxicity a vyšších plazmatických hladin lze dosáhnout při prodlouženém časovém rozpětí snižujícím podávání frekvence.
The farmakokinetika COL-3 bylo studováno na potkanech. COL-3 se vstřebává pomalu z gastrointestinálního traktu. 3% jsou vylučovány prostřednictvím močové cesty zatímco 55–66% se vylučuje stolicí. The lék je velmi lipofilní a schopný překonat hematoencefalická bariéra při vyšších dávkách. COL-3 se hromadí ve vyšší koncentraci v srdce tkáně a varle V klinických studiích se ukázalo, že vazba na plazmatické bílkoviny je vysoká (~ 94,5%). Většina COL-3 se váže na sérový albumin.[2]
Endogenní inhibitory
Aktivita MMP je regulována na různých úrovních, například endogenní inhibitory jako α2-makroglobulin a tkáňové inhibitory metaloproteináz (TIMP).[18]
α2-makroglobulin reguluje široké spektrum proteázy, zatímco TIMP jsou konkrétnější endogenní inhibitory MMP. α2-makroglobulin je hojný plazmatický protein, který působí v tkáňových tekutinách.[8] Plazma glykoprotein sestává ze čtyř podjednotek.[19] a2-makroglobulin neinhibuje aktivaci MMP ani samotných MMP.[8] Zachytává proteinázy jako MMP a tvoří a komplex s nimi.[19] Komplex je endocytovaný a vymazáno a protein související s lipoproteinovým receptorem s nízkou hustotou.[8]
v lidé, Byly nalezeny 4 různé TIMP. Oni jsou vylučováno bílkoviny s nízkýmmolekulární váha. TIMP se nevážíkovalentně na aktivní stránku MMP.[18] Předpokládá se, že změny úrovní TIMP hrají roli v patologických stavech spojených s nevyváženými aktivitami MMP.[19] TIMP se skládají z 184-194 aminokyselin. Tyto inhibitory jsou rozděleny do dvou domén N-terminál a C-terminál.[19] N-koncové oblasti čtyř TIMP sdílejí společnou strukturu. Všechny obsahují dvanáct cystein zbytky, které tvoří šest disulfidové vazby. Tyto vazby jsou rozhodující pro konformaci N-terminálu a jeho MMP-inhibičních aktivit. C-svorky TIMP se navzájem liší.[8] N-koncová podjednotka je schopná inhibovat MMP. Forma molekuly TIMP zapadá do aktivního místa MMP. TIMP kontaktuje katalytické rozštěp MMP podobně jako substrát. TIMP inhibují všechny MMP kromě TIMP-1 který neinhibuje MT-1-MMP.[19]
Existují určité rozdíly v inhibičních preferencích TIMP. TIMP-1 například upřednostňuje inhibici MMP-9. Další příklady jsou TIMP-2 a TIMP-4 které jsou účinnějšími inhibitory MMP-2 než inhibitory MMP-9.[8]
TIMP mohou být potenciálně užitečné proti nemocem, jako je kardiovaskulární onemocnění a rakovina. Aplikace TIMP jako terapeutického nástroje prostřednictvím genová terapie nebo přímá aplikace proteinu je stále v raných stádiích vývoje. Je vhodnější inhibovat specifické MPP, které hrají roli v patologických stavech. Protože TIMP inhibují více MMP, je žádoucí vyvinout konstruované TIMP se změněnou specificitou.[19]
Aktuální stav
Primárním cílem konstrukce inhibitoru MMP je selektivita. Očekává se, že cílení na konkrétní MMP zlepší účinnost a zabrání vedlejší efekty jako muskuloskeletální syndrom (MSS).[15] 3D struktury inhibitorů MMP poskytují zdroj vhledu do strukturních vztahů pro selektivitu. Vysoce výkonný screening může také zvýšit šance na objevení inhibitorů s vysokou selektivitou.[13]
Viz také
- Matricová metaloproteináza
- Inhibitory MMP
- Kolagen
- Rakovina
- Parodontitida
- Artritida
- Revmatoidní artritida
- Osteoartróza
- Tetracyklin
- Periostat
Reference
- ^ A b C Frederick, W. (1999). „Inhibice matricové metaloproteinázy: od jury do třetího tisíciletí“. Ann N Y Acad Sci. 878 (1): 388–403. Bibcode:1999NYASA.878..388W. doi:10.1111 / j.1749-6632.1999.tb07697.x. PMID 10415743.
- ^ A b C d E F Acharya, M. R.; Venitz, J .; Figg, W. D .; Sparreboom, A. (2004). "Chemicky modifikované tetracykliny jako inhibitory matrixových metaloproteináz". Aktualizace drogové rezistence. 7 (3): 195–208. doi:10.1016 / j.drup.2004.04.002. PMID 15296861.
- ^ A b Whittaker, Mark; Ayscough, Andrew (2001). „Matricové metaloproteinázy a jejich inhibitory - současný stav a budoucí výzvy“. Přenosy buněk. 17 (1): 3–14.
- ^ Baker, Andrew; Dylan R. Edwards; Gillian Murphy (říjen 2002). „Inhibitory metaloproteinázy: biologické účinky a terapeutické možnosti“. J Cell Sci. 115 (19): 3719–3727. doi:10,1242 / jcs.00063. PMID 12235282.
- ^ A b C Durrant, J. D .; de Oliveira, C. A. F .; McCammon, J. A. (2011). „Inhibitory metaloproteináz typu 2 a 3 na bázi pyronu mohou fungovat jako inhibitory selektivní vůči konformaci“. Chemická biologie a design léčiv. 78 (2): 191–198. doi:10.1111 / j.1747-0285.2011.01148.x. PMC 3135671. PMID 21609408.
- ^ A b C d Brown, P. D. (1997). "Inhibitory matricové metaloproteinázy v léčbě rakoviny". Lékařská onkologie. 14 (1): 1–10. doi:10.1007 / BF02990939. PMID 9232605.
- ^ A b C d E F G h Fisher, J. F .; Mobashery, S. (2006). "Nedávné pokroky v designu inhibitorů MMP". Metastáza rakoviny Rev. 25 (1): 115–136. doi:10.1007 / s10555-006-7894-9. PMID 16680577.
- ^ A b C d E F G Hua, H .; Li, M .; Luo, T; Yin, Y .; Jiang, Y (2011). „Matricové metaloproteinázy v tumorogenezi: vyvíjející se paradigma“. Buněčné a molekulární biologické vědy. 68 (23): 3853–3868. doi:10.1007 / s00018-011-0763-x. PMID 21744247.
- ^ Chen, J .; Chu, Y .; Cao, J .; Wang, W .; Liu, J .; Wang, J. (2011). „Účinky toxinu T-2 a selenu na expresi chondrocytů matrixových metaloproteináz (MMP-1, MMP-13), α2-makroglobulinu (α2M) a TIMP“. Toxikologie in vitro. 25 (2): 492–499. doi:10.1016 / j.tiv.2010.12.001. PMID 21144892.
- ^ A b Engel, C. K .; Pirard, B .; Schimanski, S .; Kirsch, R .; Habermann, J .; Klingler, O .; Wendt, K.U. (2005). „Strukturální základ pro vysoce selektivní inhibici MMP-13“. Chemie a biologie. 12 (2): 181–189. doi:10.1016 / j.chembiol.2004.11.014. PMID 15734645.
- ^ Whittaker, M .; Floyd, C. D .; Brown, P .; Gearing, A. J. H. (1999). "Návrh a terapeutická aplikace inhibitorů matrixové metaloproteinázy". Chem. Rev. 99 (9): 2735–2776. doi:10.1021 / cr9804543. PMID 11749499.
- ^ Maquoi, E .; Sounni, N.E .; Devy, L .; Olivier, F .; Frankenne, F .; Krell, H. W .; Noel, A. (2004). „Antiinvazivní, protinádorová a antiangiogenní účinnost derivátu pyrimidin-2,4,6-trionu, perorálně aktivního a selektivního inhibitoru metaloproteináz matrice“. Clin Cancer Res. 10 (12): 4038–4047. doi:10.1158 / 1078-0432.ccr-04-0125. PMID 15217936.
- ^ A b Pirard, B (2007). "Pohled na strukturní determinanty pro selektivní inhibici matrixových metaloproteináz". Objev drog dnes. 12 (15–16): 640–646. doi:10.1016 / j.drudis.2007.06.003. PMID 17706545.
- ^ Yan, Y.-L .; Miller, M. T .; Cao, Y .; Cohen, S. M. (2009). „Syntéza inhibitorů matricové metaloproteinázy na bázi hydroxypyronu a hydroxythiopyronu: rozvoj vztahu struktury a aktivity“. Dopisy o bioorganické a léčivé chemii. 19 (7): 1970–1976. doi:10.1016 / j.bmcl.2009.02.044. PMC 2833267. PMID 19261472.
- ^ A b C Jacobsen, J. A .; Major Jourden, J. L .; Miller, M. T .; Cohen, S. M. (2010). „Vázat zinek nebo nevázat zinek: Zkoumání inovativních přístupů ke zlepšení inhibice metaloproteinázy“. Biochimica et Biophysica Acta (BBA) - výzkum molekulárních buněk. 1803 (1): 72–94. doi:10.1016 / j.bbamcr.2009.08.006. PMID 19712708.
- ^ A b Zakeri, B .; Wright, G. D. (2008). "Chemická biologie tetracyklinových antibiotik". Biochemie a buněčná biologie. 86 (2): 124–136. doi:10.1139 / o08-002. PMID 18443626.
- ^ Agwuh, K. N .; MacGowan, A. (2006). „Farmakokinetika a farmakodynamika tetracyklinů včetně glycylcyklinů“. Journal of Antimicrobial Chemotherapy. 58 (2): 256–265. doi:10.1093 / jac / dkl224. PMID 16816396.
- ^ A b Rundhaug, J. E. (2003). "Matricové metaloproteinázy, angiogeneze a rakovina". Clin Cancer Res. 9 (2): 551–554. PMID 12576417.
- ^ A b C d E F Nagase, H .; Visse, R .; Murphy, G. (2006). "Struktura a funkce matricových metaloproteináz a TIMP". Kardiovaskulární výzkum. 69 (3): 562–573. doi:10.1016 / j.cardiores.2005.12.002. PMID 16405877.
