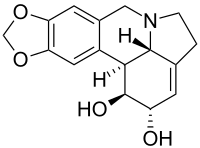
Lycorin - Lycorine
 | |
| Jména | |
|---|---|
| Název IUPAC 1,2,4,5,12b, 12c-hexahydro-7H- [1,3] dioxolo [4,5-j] pyrrolo [3,2,1-de] fenanthridin-1,2-diol | |
| Ostatní jména Galanthidin, amaryllin, narcissin, licorin, belamarin | |
| Identifikátory | |
3D model (JSmol ) | |
| ChEBI | |
| ChEMBL | |
| ChemSpider | |
| Informační karta ECHA | 100.006.822 |
PubChem CID | |
| UNII | |
Řídicí panel CompTox (EPA) | |
| |
| |
| Vlastnosti | |
| C16H17NÓ4 | |
| Molární hmotnost | 287.315 g · mol−1 |
Pokud není uvedeno jinak, jsou uvedeny údaje o materiálech v nich standardní stav (při 25 ° C [77 ° F], 100 kPa). | |
| Reference Infoboxu | |
Lycorin je toxický krystalický alkaloid nalézt v různých Amaryllidaceae druhy, jako je pěstovaná lilie keřová (Clivia miniata ), překvapivé lilie (Lycoris ) a narcisy (Narcis ). Při požití v určitých množstvích může být vysoce jedovatý nebo dokonce smrtelný.[1] Bez ohledu na to se někdy používá jako léčivo, důvod, proč některé skupiny mohou sklízet velmi populární Clivia miniata.
Zdroj
Lycorin se vyskytuje u různých druhů Amaryllidaceae které zahrnují květiny a cibule narcisu, sněženky (Galanthus) nebo lilie pavoučí (Lycoris). Lycorin je nejčastější alkaloid z Amaryllidaceae.[2]
Nejdříve diverzifikace Amaryllidaceae byl s největší pravděpodobností v severní Africe a na Pyrenejském poloostrově a že lykorin je jedním z nejstarších v biosyntetické cestě alkaloidů Amaryllidaceae.[3]
Mechanismus účinku
V současné době je velmi málo známo o mechanismu lykorinu. Existují předběžné představy o tom, jak se lykorin metabolizuje v důsledku provedené studie beagle psy.[4]
Lycorin inhibuje proteosyntéza,[5] a může inhibovat kyselina askorbová biosyntéza, ačkoli studie o druhém jsou kontroverzní a neprůkazné. V současné době slouží určitému zájmu o studium jistých droždí, hlavní organismus, na kterém je lykorin testován.[6]
Je známo, že lykorin slabě inhibuje acetylcholinesteráza (AChE) a biosyntéza kyseliny askorbové.[7] The IC50 Bylo zjištěno, že množství lykorinu se u různých druhů, u kterých se vyskytuje, lišilo, ale při pokusech s lykorinem se běžně dedukovalo, že měl určitý účinek na inhibici AChE.[8]
Lykorinové exponáty cytostatický účinky zaměřením na aktin cytoskelet spíše než indukcí apoptóza v rakovinných buňkách, ačkoli bylo zjištěno, že lycorin apoptóza v různých fázích buněčného cyklu.[9]
Biosyntéza

Jedna možná syntéza lycorinu by mohla pocházet O-methylnorbelladin, který je vidět na obrázku vpravo.
Toxicita
Otrava lycorinem obvykle nastává při požití cibulí narcisů. Cibule narcisů jsou někdy zaměňovány s cibule, což vede k náhodné otravě.[10]
Ve studii dávkování použitého na psech bíglů byly první známky nevolnosti pozorovány již při dávce 0,5 mg / kg a objevily se během 2,5 hodiny. Efektivní dávka k navození zvracení bylo u psů pozorováno 2,0 mg / kg a netrvalo déle než 2,5 hodiny po podání.[11]
Příznaky
Příznaky toxicity lykorinu jsou nevolnost,[12] zvracení, průjem, a křeče.[13]
Aktuální výzkum
Bylo zjištěno, že lycorin má slibné biologické a farmakologické účinky, jako jsou antibakteriální, antivirové nebo protizánětlivé účinky, a může mít protirakovinné vlastnosti.[14] Vykazovala různé inhibiční vlastnosti vůči více rakovinným buněčným liniím, které zahrnují lymfom, karcinom, mnohočetný myelom, melanom, leukémii, lidský A549 nemalobuněčný karcinom plic, lidský OE21 karcinom jícnu a další.[15]
Lycorin má mnoho derivátů používaných pro protinádorový výzkum, jako je lycorin hydrochlorid (LH), který je novým protinovariálním karcinogenním činidlem, a data ukazují, že LH účinně inhiboval mitotickou proliferaci buněk Hey1B s velmi nízkou toxicitou. Tento lék by mohl být v budoucnu použit pro účinnou léčbu rakoviny proti vaječníkům.[16]
Reference
- ^ "T3DB: Lycorine". www.t3db.ca. Citováno 2018-11-12.
- ^ Jahn, Sandra; Seiwert, Bettina; Kretzing, Sascha; Abraham, Getu; Regenthal, Ralf; Karst, Uwe (2012). „Metabolické studie amaryllidových alkaloidů galantamin a lycorin založené na elektrochemické simulaci kromě modelů in vivo a in vitro“. Analytica Chimica Acta. 756 (756): 60–72. doi:10.1016 / j.aca.2012.10.042. PMID 23176740. Citováno 25. dubna 2017.
- ^ Berkov, Strahil; Martinez-Frances, Vanessa; Bastida, Jaume; Codina, Carles; Rios, Sequndo (2014). "Vývoj biosyntézy alkaloidů v rodu Narcissus". Fytochemie. 99 (99): 95–106. doi:10.1016 / j.phytochem.2013.11.002. PMID 24461780.
- ^ Kretzing, Sascha; Abraham, Getu; Seiwert, Bettina; Ungemach, Fritz Rupert; Krugel, Ute; Regenthal, Ralf (2011). "Dávkově závislé emetické účinky amaryllidového alkaloidu lykorinu u psů bíglů". Toxicon. 57 (57): 117–124. doi:10.1016 / j.toxicon.2010.10.012. PMID 21055413. Citováno 25. dubna 2017.
- ^ Vrijsen R, Vanden Berghe DA, Vlietinck AJ, Boeyé A (1986). „Lycorin: eukaryotický inhibitor ukončení?“. J. Biol. Chem. 261 (2): 505–7. PMID 3001065.
- ^ Garuccio I, Arrigoni O (1989). "[Různá citlivost kvasinek na lykorin]". Boll. Soc. Ital. Biol. Sper. (v italštině). 65 (6): 501–8. PMID 2611011.
- ^ Jahn, Sandra; Seiwert, Bettina; Kretzing, Sascha; Abraham, Getu; Regenthal, Ralf; Karst, Uwe (2012). „Metabolické studie amaryllidových alkaloidů galantamin a lycorin založené na elektrochemické simulaci kromě modelů in vivo a in vitro“. Analytica Chimica Acta. 756 (756): 60–72. doi:10.1016 / j.aca.2012.10.042. PMID 23176740. Citováno 25. dubna 2017.
- ^ Elisha, I.L .; Elgorashi, E.E .; Hussein, A.A .; Duncan, G .; Eloff, J.N. (2013). „Acetlycholinesterázové inhibiční účinky cibule Ammocharis coranica (Amaryllidaceae) a její aktivní složky lycorin“. Jihoafrický věstník botaniky (85): 44–47. Citováno 25. dubna 2017.
- ^ Wang, Peng; Yuan, Hui-Hui; Zhang, Xue; Li, Yun-Ping; Shang, Lu-Qing; Yin, Zheng (21. února 2014). „Nové deriváty lykorinu jako protirakovinné látky: syntéza a biologické hodnocení in vitro“. Molekuly. 19 (2): 2469–2480. doi:10,3390 / molekuly 19022469. PMC 6271160. PMID 24566315. Citováno 25. dubna 2017.
- ^ Žáci nemocní poté, co žárovka vložila polévku, BBC novinky, 3. května 2009
- ^ Kretzing, Sascha; Abraham, Getu; Seiwert, Bettina; Ungemach, Fritz Rupert; Krugel, Ute; Regenthal, Ralf (2011). "Dávkově závislé emetické účinky amaryllidového alkaloidu lykorinu u psů bíglů". Toxicon. 57 (57): 117–124. doi:10.1016 / j.toxicon.2010.10.012. PMID 21055413. Citováno 25. dubna 2017.
- ^ Kretzing, Sascha; Abraham, Getu; Seiwert, Bettina; Ungemach, Fritz Rupert; Krugel, Ute; Regenthal, Ralf (2011). "Dávkově závislé emetické účinky amaryllidového alkaloidu lykorinu u psů bíglů". Toxicon. 57 (57): 117–124. doi:10.1016 / j.toxicon.2010.10.012. PMID 21055413. Citováno 25. dubna 2017.
- ^ Lycorin, definice na mercksource.com
- ^ Jahn, Sandra; Seiwert, Bettina; Kretzing, Sascha; Abraham, Getu; Regenthal, Ralf; Karst, Uwe (2012). „Metabolické studie amaryllidových alkaloidů galantamin a lycorin založené na elektrochemické simulaci kromě modelů in vivo a in vitro“. Analytica Chimica Acta. 756 (756): 60–72. doi:10.1016 / j.aca.2012.10.042. PMID 23176740. Citováno 25. dubna 2017.
- ^ Wang, Peng; Yuan, Hui-Hui; Zhang, Xue; Li, Yun-Ping; Shang, Lu-Qing; Yin, Zheng (21. února 2014). „Nové deriváty lykorinu jako protirakovinné látky: syntéza a biologické hodnocení in vitro“. Molekuly. 19 (2): 2469–2480. doi:10,3390 / molekuly 19022469. PMC 6271160. PMID 24566315. Citováno 25. dubna 2017.
- ^ Cao, Zhifei; Yu, Di; Fu, Shilong; Zhang, Gaochuan; Pan, Yanyan; Bao, Meimei; Tu, Jian; Shang, Bingxue; Guo, Pengda; Yang, Ping; Zhou, Quansheng (2013). „Lycorin hydrochlorid selektivně inhibuje proliferaci buněk lidského ovariálního karcinomu a neovaskularizaci tumoru s velmi nízkou toxicitou“. Toxikologické dopisy. 218 (2): 174–185. doi:10.1016 / j.toxlet.2013.01.018. PMID 23376478. Citováno 25. dubna 2017.
externí odkazy
- Hill, R. K.; Joule, J. A .; Loeffler, L. J. (1962). "Stereoselektivní syntézy d, l-α- a β-lycoranů". Journal of the American Chemical Society. 84 (24): 4951–4956. doi:10.1021 / ja00883a064.
- Wolfgang Oppolzer; Alan C. Spivey a Christian G. Bochet (1994). "Suprafacialita termálních cyklizace N-4-alkenylhydroxylaminu: Syntéza (±) -α-Lycoranu a (+) - tianthinu" (PDF). J. Am. Chem. Soc. 116 (7): 3139–3140. doi:10.1021 / ja00086a060. Archivovány od originál (PDF) dne 14.06.2011. Citováno 2009-11-04.
