Nitrosonium tetrafluoroborát - Nitrosonium tetrafluoroborate
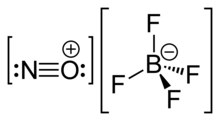 | |
| Jména | |
|---|---|
| Název IUPAC nitrosonium tetrafluoroborát | |
| Ostatní jména nitrosyl tetrafluorborát | |
| Identifikátory | |
3D model (JSmol ) | |
| ChemSpider | |
| Informační karta ECHA | 100.035.148 |
PubChem CID | |
| UNII | |
| |
| |
| Vlastnosti | |
| BF4NÓ | |
| Molární hmotnost | 116.81 g · mol−1 |
| Vzhled | bezbarvá krystalická pevná látka |
| Hustota | 2,185 g cm−3 |
| Bod tání | 250 ° C (482 ° F; 523 K) (sublimuje) |
| rozkládá se | |
Pokud není uvedeno jinak, jsou uvedeny údaje o materiálech v nich standardní stav (při 25 ° C [77 ° F], 100 kPa). | |
| Reference Infoboxu | |
Nitrosonium tetrafluoroborát, také zvaný nitrosyl tetrafluorborát, je chemická sloučenina s chemický vzorec NOBF4. Tato bezbarvá pevná látka se používá v organická syntéza jako nitrosační činidlo.[1]
NOBF4 je nitrosoniová sůl z kyselina fluoroboritá, a skládá se z a nitrosonium kation, [NE]+a tetrafluorborát anion, [BF4]−.
Reakce
Dominantní vlastnost NOBF4 je oxidační síla a elektrofilní charakter nitrosoniového kationtu. Vytváří barevné komplexy přenosu náboje s hexamethylbenzenem a s 18-koruny-6. Ten druhý, tmavě žlutý druh, poskytuje prostředek k rozpuštění NOBF4 v dichlormethanu.[2]
Nitrosoniumtetrafluorborát lze použít k přípravě kovových solí typu [M.II(CH3CN)X] [BF4]2 (M = Cr, Mn, Fe, Co, Ni, Cu). Nitrosoniový kation působí jako oxidační činidlo, které se samo redukuje na plynný oxid dusnatý:[3]
- M + 2NOBF4 + XCH3CN → [M (CH3CN)X] (BF4)2 + 2NO
S ferrocen the feroceniumtetrafluorborát je vytvořen.[4]
Reference
- ^ „A15806 Nitrosonium tetrafluoroborate, 98%“. Alfa Aesar webová stránka. Citováno 2010-09-04.
- ^ Lee, K. Y .; Kuchynka, D. J .; Kochi, Jay K. (1990). „Redoxní rovnováhy nitrosoniového kationtu a jeho nevázaných komplexů“. Anorganická chemie. 29 (21): 4196–4204. doi:10.1021 / ic00346a008.
- ^ Heintz, Robert A .; Smith, Jennifer A .; Szalay, Paul S .; Weisgerber, Amy; Dunbar, Kim R. (srpen 2004). "11. Homoleptické přechodové kationty acetonitrilu kovů s tetrafluoroborátovými nebo trifluormethansulfonátovými anionty". Inorg. Synth. 33: 75–83. doi:10.1002 / 0471224502.ch2. ISBN 978-0-471-46075-6.
- ^ Roger M. Nielson; George E. McManis; Lance K. Safford; Michael J. Weaver (1989). „Účinky rozpouštědel a elektrolytů na kinetiku samočinné výměny ferrocenium-ferrocen. Přehodnocení“. J. Phys. Chem. 93 (5): 2152. doi:10.1021 / j100342a086.
| Tento anorganické sloučenina –Příbuzný článek je a pahýl. Wikipedii můžete pomoci pomocí rozšiřovat to. |
