Šťavelan hořečnatý - Magnesium oxalate - Wikipedia
 | |
| Jména | |
|---|---|
| Název IUPAC oxalát hořečnatý | |
| Systematický název IUPAC oxalát hořečnatý | |
Ostatní jména
| |
| Identifikátory | |
3D model (JSmol ) | |
| ChemSpider | |
| Informační karta ECHA | 100.008.121 |
| Číslo ES |
|
PubChem CID | |
| UNII |
|
| UN číslo | 2811 [4] |
Řídicí panel CompTox (EPA) | |
| |
| Vlastnosti | |
| |
| Molární hmotnost |
|
| Vzhled | bílá pevná látka [2] |
| Hustota | 2,45 g / cm3[5] |
| Bod tání | mezi 420 a 620 ° C (788 až 1148 ° F; 693 až 893 K) 150 ° C (302 ° F; 423 K) (dihydrát) se rozkládají[7] |
| Bod varu | Nelze použít |
| 0,038 g / 100 g H2O (bezvodý a dihydrát)[2] | |
| Rozpustnost | nerozpustný v organických látkách |
| Tlak páry | 2.51×10−6 mmHg[3] |
| Termochemie | |
Std entalpie of formace (ΔFH⦵298) | -1269,0 kJ mol−1[2] |
| Nebezpečí | |
| Hlavní nebezpečí | Dráždivý |
| NFPA 704 (ohnivý diamant) | |
| Bod vzplanutí | Nelze použít |
| Nelze použít | |
| Související sloučeniny | |
Související sloučeniny | Oxid hořečnatý |
Pokud není uvedeno jinak, jsou uvedeny údaje o materiálech v nich standardní stav (při 25 ° C [77 ° F], 100 kPa). | |
| Reference Infoboxu | |
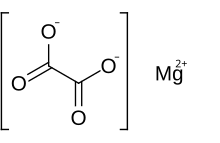
Šťavelan hořečnatý je anorganická sloučenina obsahující a hořčík kation s poplatkem 2+ spojeným s šťavelan anion. Má chemický vzorec MgC2Ó4. Oxalát hořečnatý je bílá pevná látka, která má dvě formy: an bezvodý forma a dihydrát forma, kde jsou dvě molekuly vody v komplexu se strukturou. Obě formy jsou prakticky nerozpustné ve vodě a jsou nerozpustné v organických roztocích.
Přirozený výskyt
Oxalát hořečnatý byl přirozeně nalezen poblíž Mill of Johnston, který se nachází v blízkosti Insch v severovýchodním Skotsku. Tento přirozeně se vyskytující oxalát hořečnatý se nazývá glushinskit a vyskytuje se na rozhraní lišejník / hornina hadovitý jako krémově bílá vrstva smíchaná s hyfy houby lišejníků. A rastrovací elektronový mikrofotografie odebraných vzorků ukázalo, že krystaly měly pyramidovou strukturu se zakřivenými i pruhovanými stranami. Velikost těchto krystalů se pohybovala od 2 do 5 μm.[8]
Syntéza a reakce
Oxalát hořečnatý lze syntetizovat kombinací hořečnaté soli nebo iontu s oxalátem.
- Mg2+ + C.2Ó42− → MgC2Ó4
Specifickým příkladem syntézy by bylo mísení Mg (NO3)2 a KOH a poté přidáním tohoto roztoku do dimethyloxalát, (COOCH3)2.[9]
Při zahřátí se oxalát hořečnatý rozloží. Nejprve se dihydrát rozloží při 150 ° C na bezvodou formu.
- MgC2Ó4• 2H2O → MgC2Ó4 + 2 H2Ó
Při dalším zahřívání se bezvodá forma dále rozloží oxid hořečnatý a oxidy uhlíku mezi 420 ° C a 620 ° C. Za prvé, kysličník uhelnatý a uhličitan hořečnatý formulář. Oxid uhelnatý pak oxiduje na oxid uhličitý a uhličitan hořečnatý se dále rozkládá na oxid hořečnatý a oxid uhličitý.[7]
- MgC2Ó4 → MgCO3 + CO
- CO + 1/2 O2 → CO2
- MgCO3 → MgO + CO2
Dihydrát oxalátu hořečnatého byl také použit při syntéze částic oxidu hořečnatého o velikosti nano, které mají větší povrchový poměr k objemu než běžně syntetizované částice a jsou optimální pro různé aplikace, například v katalýza. Použitím a syntéza sol-gel, který zahrnuje smíchání hořečnaté soli, v tomto případě oxalátu hořečnatého, s želatinačním činidlem, mohou být vyrobeny nanočástice oxidu hořečnatého.[10]
Zdraví a bezpečnost
Šťavelan hořečnatý dráždí pokožku a oči. Při vdechování bude dráždit plíce a sliznice. Šťavelan hořečnatý nemá žádné známé chronické účinky ani karcinogenní účinky. Šťavelan hořečnatý je nehořlavý a stabilní, ale v podmínkách požáru uvolňuje toxické výpary. Podle OSHA je oxalát hořečnatý považován za nebezpečný.[4][11]
Reference
- ^ A b C "Shrnutí oxalátové sloučeniny". Citováno 16. listopadu 2012.
- ^ A b C d E F G CRC Handbook of Chemistry and Physics (93 ed.). 2012–2013.
- ^ A b „Oxalát hořečnatý chemický vzorec, chemická látka CAS 547-66-0“. Citováno 16. listopadu 2012.
- ^ A b "Oxalát hořečnatý". Archivovány od originál dne 20. února 2014. Citováno 16. listopadu 2012.
- ^ A b "Oxalát hořečnatý". Citováno 16. listopadu 2012.
- ^ "Oxalát hořečnatý". Citováno 16. listopadu 2012.
- ^ A b Gadala, Ahmed (1984). "Kinetika rozkladu hydratovaných oxalátů vápníku a hořčíku ve vzduchu". Thermochimica Acta. 74: 255–272. doi:10.1016/0040-6031(84)80027-1.
- ^ Wilson, M; D. Jones; D.J. Russell (1980). "Glushinskite, přirozeně se vyskytující šťavelan hořečnatý". Mineralogický časopis. 43: 837–840. doi:10.1180 / minmag.1980.043.331.02.
- ^ Masuda, Yoshio (1987). „Kinetika tepelné dehydratace dihydrátu oxalátu hořečnatého v tekoucí atmosféře suchého dusíku“. J. Phys. Chem. 91: 6543–6547. doi:10.1021 / j100310a024.
- ^ Mastuli, Mohd; Roshidah Rusdi; Annie Mahat; Norazira Saat; Norlida Kamarulzaman (2012). „Sol-Gel Syntéza vysoce stabilního nano-dimenzovaného MgO z dihydrátu oxalátu hořečnatého“. Pokročilý výzkum materiálů. 545: 137–142. doi:10,4028 / www.scientific.net / amr.545.137.
- ^ "Bezpečnostní list materiálu Oxalát hořečnatý". Citováno 16. listopadu 2012.

