EF ruka - EF hand
| EF ruka | |||||||||
|---|---|---|---|---|---|---|---|---|---|
 | |||||||||
| Identifikátory | |||||||||
| Symbol | efhand | ||||||||
| Pfam | PF00036 | ||||||||
| InterPro | IPR002048 | ||||||||
| STRÁNKA | PDOC00018 | ||||||||
| SCOP2 | 1osa / Rozsah / SUPFAM | ||||||||
| CDD | cd00051 | ||||||||
| |||||||||
The EF ruka je spirála-smyčka-spirála strukturální doména nebo motiv nalezeno ve velkém rodina vázání vápníku bílkoviny.
Motiv EF-ruka obsahuje topologii šroubovice-smyčka-šroubovice, podobně jako roztažený palec a ukazováček lidské ruky, ve kterém Ca2+ ionty jsou koordinovány ligandy uvnitř smyčky. The motiv odvozuje svůj název od tradiční nomenklatury používané při popisu proteinu parvalbumin, který obsahuje tři takové motivy a je pravděpodobně zapojen do sval relaxace prostřednictvím jeho aktivity vázající vápník.
EF ruka se skládá ze dvou alfa helixy propojeno oblastí krátké smyčky (obvykle asi 12 aminokyseliny ), který se obvykle váže vápník ionty. EF-ruce se také objevují v každém strukturální doména z signální protein klimodulin a ve svalové bílkovině troponin-C.
Vazebné místo pro ionty vápníku
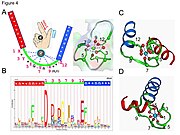
- Vápenatý iont je koordinován v pětiúhelníkové bipyramidové konfiguraci. Šest zbytků zapojených do vazby je v polohách 1, 3, 5, 7, 9 a 12; tyto zbytky jsou označeny X, Y, Z, -Y, -X a -Z. Invariant Glu nebo Asp v poloze 12 poskytuje dva kyslíky pro ligaci Ca (bidentátní ligand).
- Ion vápníku je vázán oběma páteř bílkovin atomy a aminokyselinami boční řetězy, konkrétně zbytky kyselých aminokyselin aspartát a glutamát. Tyto zbytky jsou záporně nabité a budou provádět nábojovou interakci s kladně nabitým iontem vápníku. EF ruční motiv byl mezi prvními strukturálními motivy, jejichž požadavky na sekvenci byly podrobně analyzovány. Pět zbytků smyčky váže vápník a má tedy silnou přednost kyslík - obsahující postranní řetězce, zejména aspartát a glutamát. Šestý zbytek ve smyčce je nutně glycin kvůli konformačním požadavkům páteře. Zbývající zbytky jsou obvykle hydrofobní a tvoří a hydrofobní jádro který spojuje a stabilizuje dvě šroubovice.
- Po navázání na Ca2+, tento motiv může projít konformačními změnami, které umožňují Ca2+-regulované funkce, jak je vidět na Ca2+ efektory, jako je kalmodulin (CaM) a troponin C (TnC) a Ca2+ pufry jako kalretikulin a kalbindin D9k. Zatímco většina známých proteinů vázajících vápník na bázi EF (CaBP) obsahuje spárované motivy EF na ruce, CaBP s jednotlivými EF rukama byly také objeveny u bakterií i eukaryot. Kromě toho byly u řady bakterií nalezeny „motivy podobné EF“. Ačkoli koordinační vlastnosti zůstávají podobné s kanonickým 29-zbytkovým motivem helix-loop-helix EF-hand, EF-hand-like motivy se liší od EF-hand v tom, že obsahují odchylky v sekundární struktuře hraničních sekvencí a / nebo kolísání délky Ca2+- koordinační smyčka.
- EF ruce mají velmi vysokou selektivitu pro vápník. Například disociační konstanta alfa parvalbumin pro Ca2+ je ~ 1 000krát nižší než u podobného iontu Mg2+.[2] Tato vysoká selektivita je způsobena relativně rigidní koordinační geometrií, přítomností více nabitých postranních řetězců aminokyselin ve vazebném místě, jakož i vlastnostmi solvatace iontů.[3][4][5]
Předpověď

- Hledání vzoru (podpisu motivu) je jedním z nejpřímějších způsobů, jak předpovědět kontinuální EF ruka2+vazebná místa v proteinech. Na základě výsledků seřazení sekvencí kanonických EF-ručních motivů, zejména konzervovaných postranních řetězců přímo zapojených do Ca2+ vazba, vzor PS50222 byl vygenerován k předpovědi kanonických stránek EF-hand. Servery s predikcemi najdete v sekci externích odkazů.
Klasifikace
- Od vymezení motivu EF-ruka v roce 1973 se rodina proteinů EF-ruky rozšířila tak, aby zahrnovala dosud alespoň 66 podrodin. EF-ruční motivy jsou rozděleny do dvou hlavních skupin:
- Kanonické EF-ruce jak je vidět u kalmodulinu (CaM) a prokaryotického proteinu podobného CaM kalerythrinu. Kanonická smyčka EF se 12 zbytky váže Ca2+ hlavně přes postranní řetězec karboxyláty nebo karbonyly (pozice sekvencí smyčky 1, 3, 5, 12). Zbytek na ose –X koordinuje Ca2+ iont přes přemostěnou molekulu vody. Ruční smyčka EF má bidentátní ligand (Glu nebo Asp) v ose –Z.
- Pseudo EF-ruce nachází se výlučně v N-koncích proteinů S100 a S100. 14-zbytková pseudo EF-ruční smyčka chelátuje Ca2+ primárně přes páteřní karbonyly (pozice 1, 4, 6, 9).
Další body:

- EF-ruční proteiny s diverzifikovanými sousedícími strukturními prvky kolem Ca2+-vázací smyčka byla hlášena u bakterií a virů. Tyto prokaryotické EF-podobné proteiny jsou široce zapojeny do Ca2+ signalizace a homeostáza v bakteriích. Obsahují flexibilní délky Ca2+-vázací smyčky, které se liší od motivů EF ruky. Jejich koordinační vlastnosti však připomínají klasické EF-ruční motivy.
- Například polokontinuální Ca2+vazebné místo v proteinu vázajícím D-galaktózu (GBP) obsahuje smyčku devíti zbytků. Ca2+ iont je koordinován sedmi proteinovými atomy kyslíku, z nichž pět pochází ze smyčky napodobující kanonickou EF smyčku, zatímco další dva jsou z karboxylátové skupiny vzdálené Glu.
- Dalším příkladem je nová doména s názvem Excalibur (extracelulární Ca2+-binding region) izolovaný z Bacillus subtilis. Tato doména má konzervovaný 10-zbytek Ca2+-vázací smyčka nápadně podobná kanonické 12-zbytkové smyčce EF-hand.
- Rozmanitost struktury lemující oblasti je ilustrována objevem domén podobných EF jako v bakteriálních proteinech. Například řetězec helix-loop-string místo struktury helix-loop-helix je v periplazmatickém proteinu vázajícím galaktózu (Salmonella typhimurium, PDB: 1gcg) Nebo protein vázající alginát (Sfingomonas sp., 1 kWh); vstupní helix chybí v ochranném antigenu (Bacillus anthracis, 1acc) Nebo dockerin (Clostridium thermocellum, 1daq).
- Ze všech dosud hlášených struktur je většina motivů EF-ruky spárována buď mezi dvěma kanonickými nebo jedním pseudo a jedním kanonickými motivy. U proteinů s lichým počtem EF-rukou, jako je penta-EF-ruka calpain, byly EF-ruce motivy spojeny pomocí homo- nebo hetero-dimerizace. Nedávno identifikovaná ruka EF obsahující ER Ca2+ Ukázalo se, že senzorový protein, molekula stromální interakce 1 a 2 (STIM1, STIM2) obsahuje Ca2+-vázací kanonický EF-ruční motiv, který se páruje s bezprostředním, po proudu atypickým „skrytým“ non-Ca2+-vázací EF ruka. Jednotlivé motivy EF ruky mohou sloužit jako moduly dokování proteinů: například jediná ruka EF v proteinech NKD1 a NKD2 váže proteiny Disheveled (DVL1, DVL2, DVL3).
- Funkčně lze EF-ruce rozdělit do dvou tříd: 1) signální proteiny a 2) pufrovací / transportní proteiny. První skupina je největší a zahrnuje nejznámější členy rodiny, jako je kalmodulin, troponin C a S100B. Tyto proteiny typicky procházejí konformační změnou závislou na vápníku, která otevírá místo vázající cíl. Druhá skupina je představována kalbindinem D9k a nepodléhá konformačním změnám závislým na vápníku.
Podskupiny
Příklady
Ekvorin
Aequorin je protein vázající vápník (CaBP) izolovaný z koelenterátu Aequorea victoria. Aequorin patří do rodiny EF-hand CaBP, se smyčkami EF-hand, které úzce souvisí s CaBP u savců. Aequorin se navíc již roky používá jako indikátor Ca2 + a ukázalo se, že je bezpečný a dobře tolerován buňkami. Ekvorin se skládá ze dvou složek - složky vázající vápník apoekvorin (AQ) a chemiluminiscenční molekula coelenterazin. Část AQ tohoto proteinu obsahuje EF-ruční domény vázající vápník.[6]
Lidské proteiny
Mezi lidské proteiny obsahující tuto doménu patří:
- ACTN1; ACTN2; ACTN3; ACTN4; APBA2BP; AYTL1; AYTL2
- C14orf143; CABP1; CABP2; CABP3; CABP4; CABP5; CABP7; CALB1; CALB2; CALM2; CALM3; CALML3; CALML4; CALML5; CALML6; CALN1; CALU; CAPN1; CAPN11; CAPN2; CAPN3; CAPN9; CAPNS1; CAPNS2; CAPS; CAPS2; CAPSL; CBARA1; CETN1; CETN2; CETN3; CHP; CHP2; CIB1; CIB2; CIB3; CIB4; CRNN
- DGKA; DGKB; DGKG; DST; DUOX1; DUOX2
- EFCAB1; EFCAB2; EFCAB4A; EFCAB4B; EFCAB6; EFCBP1; EFCBP2; EFHA1; EFHA2; EFHB; EFHC1; EFHD1; EFHD2; EPS15; EPS15L1
- FKBP10; FKBP14; FKBP7; FKBP9; FKBP9L; FREKVENCE; FSTL1; FSTL5
- GCA; GPD2; GUCA1A; GUCA1B; GUCA1C
- hippocalcin; HPCAL1; HPCAL4; HZGJ
- IFPS; ITSN1; ITSN2; KCNIP1; KCNIP2; KCNIP3; KCNIP4; KIAA1799
- LCP1
- MACF1; MRLC2; MRLC3; MST133; MYL1; MYL2; MYL5; MYL6B; MYL7; MYL9; MYLC2PL; MYLPF
- NCALD; NIN; NKD1; NKD2; NLP; NOX5; NUCB1; NUCB2
- OCM
- PDCD6; PEF1; PKD2; PLCD1; PLCD4; PLCH1; PLCH2; PLS1; PLS3; PP1187; PPEF1; PPEF2; PPP3R1; PPP3R2; PRKCSH; PVALB
- RAB11FIP3; RASEF; RASGRP; RASGRP1; RASGRP2; RASGRP3; RCN1; RCN2; RCN3; RCV1; RCVRN; REPS1; RHBDL3; RHOT1; RHOT2; RPTN; RYR2; RYR3
- S100A1; S100A11; S100A12; S100A6; S100A8; S100A9; S100B; S100G; S100Z; SCAMC-2; SCGN; SCN5A; SDF4; SLC25A12; SLC25A13; SLC25A23; SLC25A24; SLC25A25; SPATA21; SPTA1; SPTAN1; SRI
- TBC1D9; TBC1D9B; TCHH; TESC; TNNC1; TNNC2
- USP32
- VSNL1
- ZZEF1
Viz také
- Další výrazný motiv vázající vápník složený z alfa šroubovic je doména dockerin.
Reference
- ^ Ban C, Ramakrishnan B, Ling KY, Kung C, Sundaralingam M (leden 1994). "Struktura rekombinantního Paramecium tetraurelia calmodulin při rozlišení 1,68 A". Acta Crystallogr. D. 50 (Pt 1): 50–63. doi:10.1107 / S0907444993007991. PMID 15299476.
- ^ Schwaller, B. (13. října 2010). "Cytosolické pufry Ca2 +". Perspektivy Cold Spring Harbor v biologii. 2 (11): a004051 – a004051. doi:10.1101 / cshperspect.a004051. PMC 2964180. PMID 20943758.
- ^ Gifford, Jessica L .; Walsh, Michael P .; Vogel, Hans J. (15. července 2007). „Struktury a vazebné vlastnosti kov-ionty motivů EF-ruka helix – smyčka – helix vázající Ca“. Biochemical Journal. 405 (2): 199–221. doi:10.1042 / BJ20070255. PMID 17590154.
- ^ Dudev, Todor; Lim, Carmay (16. září 2013). „Soutěž mezi kovovými ionty pro místa vázající bílkoviny: Determinanty selektivity kovových iontů v proteinech“. Chemické recenze. 114 (1): 538–556. doi:10.1021 / cr4004665. PMID 24040963.
- ^ Jing, Zhifeng; Liu, Chengwen; Qi, Rui; Ren, Pengyu (23. července 2018). „Účinek mnoha těl určuje selektivitu pro Ca a Mg v bílkovinách“. Sborník Národní akademie věd. 115: 201805049. doi:10.1073 / pnas.1805049115. PMC 6094099. PMID 30038003.
- ^ Detert JA, Adams EL, Lescher JD, Lyons JA, Moyer JR (2013). „Předběžná léčba apoekvororinem chrání hipokampální CA1 neurony před nedostatkem kyslíku a glukózy“. PLOS ONE. 8 (11): e79002. doi:10.1371 / journal.pone.0079002. PMC 3823939. PMID 24244400.
Další čtení
- Branden C, Tooze J (1999). „Kapitola 2: Motivy proteinové struktury“. Úvod do proteinové struktury. New York: Garland Pub. str. 24–25. ISBN 0-8153-2305-0.
- Nakayama S, Kretsinger RH (1994). „Vývoj rodiny proteinů EF-hand“. Annu Rev Biophys Biomol Struct. 23: 473–507. doi:10.1146 / annurev.bb.23.060194.002353. PMID 7919790.
- Zhou Y, Yang W, Kirberger M, Lee HW, Ayalasomayajula G, Yang JJ (listopad 2006). „Predikce EF-ručních proteinů vázajících vápník a analýza bakteriálních EF-ručních proteinů“. Proteiny. 65 (3): 643–55. doi:10,1002 / prot.21139. PMID 16981205.
- Zhou Y, Frey TK, Yang JJ (červenec 2009). „Virová kaliomika: interplaye mezi Ca2 + a virem“. Buněčný vápník. 46 (1): 1–17. doi:10.1016 / j.ceca.2009.05.005. PMC 3449087. PMID 19535138.
- Nakayama S, Moncrief ND, Kretsinger RH (květen 1992). „Vývoj proteinů modulovaných vápníkem modulovaných na EF. II. Domény několika podskupin mají různé evoluční historie“. J. Mol. Evol. 34 (5): 416–48. doi:10.1007 / BF00162998. PMID 1602495.
- Hogue CW, MacManus JP, Banville D, Szabo AG (červenec 1992). "Porovnání zvýšení luminiscence terbia (III) u mutantů EF rukou vázajících proteiny vápníku". J. Biol. Chem. 267 (19): 13340–7. PMID 1618836.
- Bairoch A, Cox JA (září 1990). "EF-ruční motivy v inositol fosfolipidově specifické fosfolipáze C". FEBS Lett. 269 (2): 454–6. doi:10.1016/0014-5793(90)81214-9. PMID 2401372.
- Finn BE, Forsén S (leden 1995). „Vyvíjející se model kalmodulinové struktury, funkce a aktivace“. Struktura. 3 (1): 7–11. doi:10.1016 / S0969-2126 (01) 00130-7. PMID 7743133.
- Stathopulos PB, Zheng L, Li GY, Plevin MJ, Ikura M (říjen 2008). „Strukturální a mechanické pohledy na zahájení vstupu vápníku provozovaného v obchodě prostřednictvím STIM1“. Buňka. 135 (1): 110–22. doi:10.1016 / j.cell.2008.08.006. PMID 18854159.
- Nelson MR, Thulin E, Fagan PA, Forsén S, Chazin WJ (únor 2002). „Ruční doména EF: globálně kooperativní strukturální jednotka“. Protein Sci. 11 (2): 198–205. doi:10.1110 / ps.33302. PMC 2373453. PMID 11790829.
externí odkazy
- Zdroj eukaryotického lineárního motivu třída motivů LIG_EH_1
- Zdroj eukaryotického lineárního motivu třída motivů LIG_IQ
- Zdroj eukaryotického lineárního motivu třída motivů DOC_PP2B_LxvP_1
- Zdroj eukaryotického lineárního motivu třída motivů LIG_IQ
- Nelson M, Chazin W. „Datová knihovna proteinů vázajících vápník EF-Hand“. Vanderbiltova univerzita. Citováno 2009-08-29.
- Haiech J. "EF-hand proteinová databáze (EF-handome)". Evropská společnost vápníku a Université Libre de Bruxelles. Citováno 2009-08-29.
na vyžádání na [email protected]
- Yang J. „Calciomics“. Gruzínská státní univerzita. Archivovány od originál dne 12. 10. 2009. Citováno 2009-08-29.
predikční server pro EF-ruční proteiny vázající vápník
