Chloristan stříbrný - Silver perchlorate
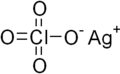 | |
| Jména | |
|---|---|
| Název IUPAC Chloristan stříbrný | |
| Systematický název IUPAC Chloričnan stříbrný (VII) | |
| Ostatní jména Kyselina chloristá, stříbrná (1+) sůl Argentous chloristan | |
| Identifikátory | |
| |
3D model (JSmol ) | |
| ChemSpider | |
| Informační karta ECHA | 100.029.123 |
| Číslo ES |
|
PubChem CID | |
| UNII | |
Řídicí panel CompTox (EPA) | |
| |
| |
| Vlastnosti | |
| AgClO4 | |
| Molární hmotnost | 207 319 g / mol |
| Vzhled | Bezbarvý hygroskopický krystaly |
| Hustota | 2,806 g / cm3 |
| Bod tání | 486 ° C (907 ° F; 759 K) (rozkládá se) |
| 557 g / 100 ml (25 ° C) 792,8 g / 100 ml (99 ° C) | |
| Rozpustnost | rozpustný v organických rozpouštědlech |
| Struktura | |
| krychlový | |
| Nebezpečí | |
| R-věty (zastaralý) | R8 R34 R50 |
| S-věty (zastaralý) | S15 S17 S26 S36 / 37/39 S45 |
| NFPA 704 (ohnivý diamant) | |
Pokud není uvedeno jinak, jsou uvedeny údaje o materiálech v nich standardní stav (při 25 ° C [77 ° F], 100 kPa). | |
| Reference Infoboxu | |
Chloristan stříbrný je chemická sloučenina se vzorcem AgClO4. Tato bílá pevná látka tvoří monohydrát a je mírně rozmělněný. Je to užitečný zdroj Ag+ ion, ačkoli přítomnost chloristan představuje rizika. Používá se jako katalyzátor v organické chemii.
Výroba
Chloristan stříbrný se vytváří zahříváním směsi kyselina chloristá s dusičnan stříbrný.
Alternativně může být připraven reakcí mezi chloristan barnatý a síran stříbrný nebo z reakce kyseliny chloristé s oxid stříbrný.
Rozpustnost
Chloristan stříbrný je pozoruhodný svou rozpustností v aromatických rozpouštědlech, jako je benzen (52,8 g / l) a toluen (1010 g / l).[1] V těchto rozpouštědlech se kation stříbra váže na aren, jak bylo prokázáno rozsáhlými krystalografickými studiemi na krystalech získaných z těchto roztoků.[2][3] Jeho rozpustnost ve vodě je extrémně vysoká, až 500 g na 100 ml vody.
Související činidla
Podobný dusičnan stříbrný, chloristan stříbrný je účinným činidlem pro výměnu halogenidy ligandy s chloristanem, což je slabě nebo nekoordinující anion. Použití chloristanu stříbrného v chemické syntéze pokleslo kvůli obavám z výbušnosti chloristanových solí. Další stříbrná činidla jsou tetrafluorboritan stříbrný a související trifluormethansulfonát stříbrný a hexafluorfosforečnan stříbrný.
Reference
- ^ F. Březina; J. Mollin; R. Pastorek; Z. Šindelář (1986). Chemické tabulky anorganických sloučenin [Chemické tabulky anorganických sloučenin] (v češtině). Praha: SNTL.
- ^ E. A. Hall Griffith; E. L. Amma (1974). „Metal Ion-Aromatic Complexes. XVIII. Preparation and Molecular Structure of Naftalene-Tetrakis (chloristan stříbrný) tetrahydrát“. Journal of the American Chemical Society. 96 (3): 743–749. doi:10.1021 / ja00810a018.
- ^ R. K. McMullan; T. F. Koetzle; C. J. Fritchie Jr. (1997). „Nízkoteplotní studie difrakce neutronů komplexu chloristan-benzen π“. Acta Crystallographica B. 53 (4): 645–653. doi:10.1107 / S0108768197000712.
| HClO4 | On | ||||||||||||||||
| LiClO4 | Buďte (ClO4)2 | B (ClO 4)− 4 B (ClO4)3 | ROClO3 | N (ClO4)3 NH4ClO4 NOClO4 | Ó | FClO4 | Ne | ||||||||||
| NaClO4 | Mg (ClO4)2 | Al (ClO4)3 | Si | P | S | ClO− 4 ClOClO3 Cl2Ó7 | Ar | ||||||||||
| KClO4 | Ca (ClO4)2 | Sc (ClO4)3 | Ti (ClO4)4 | VO (ClO4)3 VO2(ClO4) | Cr (ClO4)3 | Mn (ClO4)2 | Fe (ClO4)3 | Co (ClO4)2, Co (ClO4)3 | Ni (ClO4)2 | Cu (ClO4)2 | Zn (ClO4)2 | Ga (ClO4)3 | Ge | Tak jako | Se | Br | Kr |
| RbClO4 | Sr (ClO4)2 | Y (ClO4)3 | Zr (ClO4)4 | Nb (ClO4)5 | Mo | Tc | Ru | Rh (ClO4)3 | Pd (ClO4)2 | AgClO4 | Cd (ClO4)2 | V (ClO4)3 | Sn (ClO4)4 | Sb | TeO (ClO4)2 | Já | Xe |
| CsClO4 | Ba (ClO4)2 | Hf (ClO4)4 | Ta (ClO4)5 | Ž | Re | Os | Ir | Pt | Au | Hg2(ClO4)2, Hg (ClO4)2 | Tl (ClO4), Tl (ClO4)3 | Pb (ClO4)2 | Bi (ClO4)3 | Po | Na | Rn | |
| FrClO4 | Ra | Rf | Db | Sg | Bh | Hs | Mt. | Ds | Rg | Cn | Nh | Fl | Mc | Lv | Ts | Og | |
| ↓ | |||||||||||||||||
| Los Angeles | Ce (ClO4)X | Pr | Nd | Odpoledne | Sm (ClO4)3 | Eu (ClO4)3 | Gd (ClO4)3 | Tb (ClO4)3 | Dy (ClO4)3 | Ho (ClO4)3 | Er (ClO4)3 | Tm (ClO4)3 | Yb (ClO4)3 | Lu (ClO4)3 | |||
| Ac | Čt (ClO4)4 | Pa | UO2(ClO4)2 | Np | Pu | Dopoledne | Cm | Bk | Srov | Es | Fm | Md | Ne | Lr | |||

