PA klan proteáz - PA clan of proteases
| PA klan proteázy | |
|---|---|
 | |
| Identifikátory | |
| Symbol | N / A |
| Pfam klan | CL0124 |
| InterPro | IPR009003 |
| SCOP2 | 50494 / Rozsah / SUPFAM |
| Membranome | 319 |
The Klan PA (Protease smíšeného nukleofilu, nadčeleď A) je největší skupina proteázy se společným původem, jak je uvedeno v strukturní homologie. Členové mají chymotrypsin - jako záhyb a podobně proteolýza mechanismy, ale může mít identitu <10%. Klan obsahuje obojí cystein a serinové proteázy (odlišný nukleofily ).[1][2] PA klanové proteázy najdete v rostliny,[3] zvířata,[3] houby,[3] eubakterie,[4] archaea[5][6] a viry.[2]
Běžné používání katalytická triáda pro hydrolýzu více klany proteáz, včetně klanu PA, představuje příklad konvergentní evoluce.[7] Rozdíly v katalytické triádě v klanu PA jsou také příkladem odlišná evoluce z aktivní stránky v enzymech.[2]
Dějiny
V 60. letech 20. století sekvenční podobnost několik proteáz naznačilo, že jsou evolučně příbuzné.[8] Ty byly seskupeny do chymotrypsinům podobné serinové proteázy[9] (nyní nazývaný Rodina S1 ). Protože struktury těchto a dalších proteáz byly vyřešeny Rentgenová krystalografie v 70. a 80. letech bylo zjištěno, že několik virových proteáz jako např Virus proteázy tabáku Etch ukázal strukturní homologie navzdory zjevné podobnosti sekvence a dokonce i jinému nukleofilu.[2][10][11] Na základě strukturní homologie, a nadčeleď byl definován a později pojmenován klan PA (podle MEROPS klasifikační systém). Jak je vyřešeno více struktur, bylo do nadrodiny klanu PA přidáno více rodin proteáz.[12][13]
Etymologie
The P odkazuje na Protázy smíšeného nukleofilu. The A naznačuje, že to byl první takový klan, který byl identifikován (existují také klany PB, PC, PD a PE).[1]
Struktura
Navzdory zachování pouze 10% sekvenční identity se členové klanu PA izolovali z virů, prokaryot a eukaryot strukturní homologie a může být zarovnaný strukturální podobností (např. s DALI ).[3]
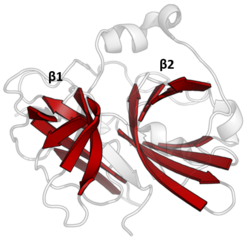
Dvojitá β-hlaveň
Protilátky klanu PA všechny sdílejí základní motiv dvou β-sudy s kovalentní katalýzou prováděnou kyselinou-histidin-nukleofilem katalytická triáda motiv. Sudy jsou uspořádány kolmo vedle sebe s hydrofobními zbytky, které je drží pohromadě jako základní lešení pro enzym. Zbytky triády jsou rozděleny mezi dva sudy tak katalýza probíhá na jejich rozhraní.[14]
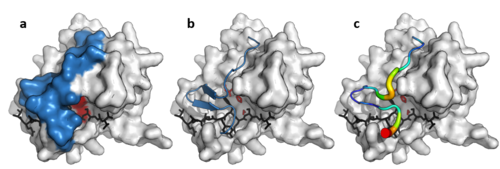
Smyčka virové proteázy
Kromě dvojitého jádra β-barelu jsou některé virové proteázy (např TEV proteáza ) mít dlouhý, flexibilní C-koncová smyčka, která tvoří víko, které zcela zakrývá podklad a vytváří vazebný tunel. Tento tunel obsahuje sadu těsných vazebných kapes, takže každý boční řetězec peptidu substrátu (P6 až P1 ') je navázán na komplementární místo (S6 až S1') a specificita je vybavena velkou kontaktní oblastí mezi enzymem a substrátem.[11] Naopak, buněčné proteázy, které tuto smyčku postrádají, jako např trypsin mít širší specifičnost.
Evoluce a funkce
Katalytická aktivita
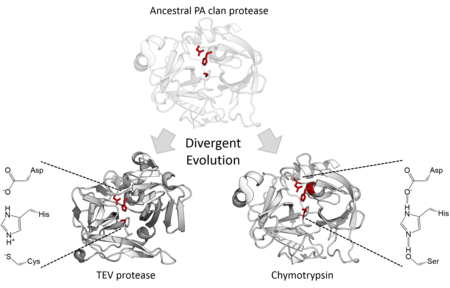
Strukturální homologie označuje, že členové klanu PA pocházejí ze společného předka stejného rodu. Ačkoli klanové proteázy PA používají katalytickou triádu, provádějte 2 kroky nukleofilní katalýza,[7] některé rodiny používají serin jako nukleofil zatímco ostatní používají cystein.[2] Nadčeleď je proto extrémním příkladem divergentní vývoj enzymů protože během evoluční historie se jádro katalytického zbytku enzymu změnilo v různých rodinách.[15] Kromě jejich strukturální podobnosti řízená evoluce Bylo prokázáno, že je schopné konvertovat cysteinovou proteázu na aktivní serinovou proteázu.[16] Všechny buněčné PA klanové proteázy jsou serinové proteázy, existují však jak serin, tak cysteinová proteáza rodiny virových proteáz.[7] Většina je endopeptidázy, s výjimkou rodiny S46 z exopeptidázy.[17][18]
Biologická role a specificita substrátu
Kromě divergence ve svém jádrovém katalytickém aparátu vykazují proteiny klanu PA také široký divergentní vývoj ve funkci. Členy klanu PA najdete v eukaryoty, prokaryoty a viry a zahrnuje širokou škálu funkcí. U savců jsou někteří zapojeni do srážení krve (např. trombin ), a tak mají vysokou specificitu substrátu stejně jako trávení (např. trypsin ) se širokou specificitou substrátu. Několik hadí jedy jsou také klanové proteázy PA, jako např zmije hemotoxin a zasahovat do kaskády srážení krve oběti. Navíc bakterie jako např Zlatý stafylokok vylučovat exfoliativní toxin které tráví a poškozují tkáně hostitele. Mnoho virů vyjadřuje své genom jako jediný masivní polyprotein a pomocí proteázy PA klanu jej rozštěpíte na funkční jednotky (např. obrna, norovirus, a TEV proteázy ).[19][20]
Je jich také několik pseudoenzymy v superrodině, kde byly zmutovány zbytky katalytické triády a fungují jako vazebné proteiny.[21] Například heparin -vazebný protein Azurocidin má glycin místo nukleofilu a serin místo histidinu.[22]
Rodiny
V klanu PA (P = proteázy smíšených nukleofily ), rodiny jsou označeny svým katalytickým nukleofilem (C =cysteinové proteázy, S =serinové proteázy ). Přes nedostatek sekvenční homologie pro klan PA jako celek lze jednotlivé rodiny v něm identifikovat pomocí sekvenční podobnosti.
Viz také
Reference
- ^ A b Rawlings ND, Barrett AJ, Bateman A (leden 2012). „MEROPS: databáze proteolytických enzymů, jejich substrátů a inhibitorů“. Výzkum nukleových kyselin. 40 (Problém s databází): D343-50. doi:10.1093 / nar / gkr987. PMC 3245014. PMID 22086950.
- ^ A b C d E Bazan JF, Fletterick RJ (listopad 1988). „Virové cysteinové proteázy jsou homologní s rodinou serinových proteáz podobné trypsinu: strukturální a funkční důsledky“. Sborník Národní akademie věd Spojených států amerických. 85 (21): 7872–6. Bibcode:1988PNAS ... 85.7872B. doi:10.1073 / pnas.85.21.7872. PMC 282299. PMID 3186696.
- ^ A b C d Laskar A, Rodger EJ, Chatterjee A, Mandal C (květen 2012). „Modelování a strukturní analýza serinových proteáz klanu PA“. Poznámky k výzkumu BMC. 5: 256. doi:10.1186/1756-0500-5-256. PMC 3434108. PMID 22624962.
- ^ Barbosa JA, Saldanha JW, Garratt RC (červenec 1996). „Nové rysy aktivních míst serinové proteázy a kapsy specificity: sekvenční analýza a modelové studie endopeptidáz specifických pro glutamát a epidermolytických toxinů“. Proteinové inženýrství. 9 (7): 591–601. doi:10.1093 / protein / 9.7.591. PMID 8844831.
- ^ „MEROPS - proteázy Archaeal S01“.
- ^ Ruiz-Perez F, Nataro JP (březen 2014). „Bakteriální serinové proteázy vylučované cestou autotransportéru: klasifikace, specificita a role ve virulenci“. Buněčné a molekulární biologické vědy. 71 (5): 745–70. doi:10.1007 / s00018-013-1355-8. PMC 3871983. PMID 23689588.
- ^ A b C Buller AR, Townsend CA (únor 2013). „Vnitřní evoluční omezení struktury proteáz, acylace enzymů a identity katalytické triády“. Sborník Národní akademie věd Spojených států amerických. 110 (8): E653-61. Bibcode:2013PNAS..110E.653B. doi:10.1073 / pnas.1221050110. PMC 3581919. PMID 23382230.
- ^ de Haën C, Neurath H, Teller DC (únor 1975). „Fylogeneze serinproteáz souvisejících s trypsinem a jejich zymogenů. Nové metody pro zkoumání vzdálených evolučních vztahů“. Journal of Molecular Biology. 92 (2): 225–59. doi:10.1016/0022-2836(75)90225-9. PMID 1142424.
- ^ Lesk AM, Fordham WD (květen 1996). "Zachování a variabilita ve strukturách serinových proteináz rodiny chymotrypsinů". Journal of Molecular Biology. 258 (3): 501–37. doi:10.1006 / jmbi.1996.0264. PMID 8642605.
- ^ Gorbalenya AE, Blinov VM, Donchenko AP (leden 1986). „Poliovirusem kódovaná proteináza 3C: možná evoluční vazba mezi rodinami buněčných serinových a cysteinových proteináz“. FEBS Dopisy. 194 (2): 253–7. doi:10.1016/0014-5793(86)80095-3. PMID 3000829.
- ^ A b Phan J, Zdanov A, Evdokimov AG, Tropea JE, Peters HK, Kapust RB, Li M, Wlodawer A, Waugh DS (prosinec 2002). „Strukturální základ pro substrátovou specificitu proteázy viru tabáku etch“. The Journal of Biological Chemistry. 277 (52): 50564–72. doi:10,1074 / jbc.M207224200. PMID 12377789.
- ^ Allaire M, Chernaia MM, Malcolm BA, James MN (květen 1994). „Pikoravirové 3C cysteinové proteinázy mají složení podobné serinovým proteinázám podobným chymotrypsinu“. Příroda. 369 (6475): 72–6. Bibcode:1994 Natur.369 ... 72A. doi:10.1038 / 369072a0. PMID 8164744.
- ^ Snijder EJ, Wassenaar AL, van Dinten LC, Spaan WJ, Gorbalenya AE (březen 1996). „Arterivirová nsp4 proteáza je prototypem nové skupiny enzymů podobných chymotrypsinu, serinových proteáz podobných 3C“. The Journal of Biological Chemistry. 271 (9): 4864–71. doi:10.1074 / jbc.271.9.4864. PMID 8617757.
- ^ Dougherty WG, Parks TD, Cary SM, Bazan JF, Fletterick RJ (září 1989). "Charakterizace katalytických zbytků 49-kDa proteinázy viru tabáku etch". Virologie. 172 (1): 302–10. doi:10.1016/0042-6822(89)90132-3. PMID 2475971.
- ^ Laskar A, Rodger EJ, Chatterjee A, Mandal C (květen 2012). „Modelování a strukturní analýza serinových proteáz klanu PA“. Poznámky k výzkumu BMC. 5 (1): 256. doi:10.1186/1756-0500-5-256. PMC 3434108. PMID 22624962.
- ^ Shafee T, Gatti-Lafranconi P, Minter R, Hollfelder F (září 2015). „Evoluce hendikepu a obnovy vede k chemicky univerzální, nukleofilní permisivní proteáze“. ChemBioChem. 16 (13): 1866–1869. doi:10.1002 / cbic.201500295. PMC 4576821. PMID 26097079.
- ^ Suzuki Y, Sakamoto Y, Tanaka N, Okada H, Morikawa Y, Ogasawara W (březen 2014). "Identifikace katalytické triády rodiny S46 exopeptidáz, úzce souvisejících s klanovými PA endopeptidázami". Vědecké zprávy. 4: 4292. doi:10.1038 / srep04292. PMC 3944710. PMID 24598890.
- ^ Sakamoto Y, Suzuki Y, Iizuka I, Tateoka C, Roppongi S, Fujimoto M, Inaka K, Tanaka H, Masaki M, Ohta K, Okada H, Nonaka T, Morikawa Y, Nakamura KT, Ogasawara W, Tanaka N (květen 2014 ). „S46 peptidázy jsou první exopeptidázy, které jsou členy klanu PA“. Vědecké zprávy. 4: 4977. doi:10.1038 / srep04977. PMC 4021333. PMID 24827749.
- ^ Salvesen G (2013). Rawlings N (ed.). Příručka proteolytických enzymů. Boston: Academic Press. ISBN 9780123822192.
- ^ Polgár L (říjen 2005). "Katalytická triáda serinových peptidáz". Buněčné a molekulární biologické vědy. 62 (19–20): 2161–72. doi:10.1007 / s00018-005-5160-x. PMID 16003488.
- ^ Todd AE, Orengo CA, Thornton JM (říjen 2002). "Sekvence a strukturní rozdíly mezi enzymy a neenzymovými homology". Struktura. 10 (10): 1435–51. doi:10.1016 / s0969-2126 (02) 00861-4. PMID 12377129.
- ^ Iversen LF, Kastrup JS, Bjørn SE, Rasmussen PB, Wiberg FC, Flodgaard HJ, Larsen IK (duben 1997). "Struktura HBP, multifunkčního proteinu se záhybem serinové proteinázy". Přírodní strukturní biologie. 4 (4): 265–8. doi:10.1038 / nsb0497-265. PMID 9095193.


