O-6-methylguanin-DNA methyltransferáza - O-6-methylguanine-DNA methyltransferase - Wikipedia
Ó6-alkylguanin DNA alkyltransferáza (také známý jako AGT, MGMT nebo AGAT) je protein že u lidí je kódován Ó6-methylguanin DNA methyltransferáza (MGMT) gen.[5][6]Ó6-metylguaninová DNA methyltransferáza je zásadní pro stabilitu genomu. Opravuje přirozeně se vyskytující mutagenní lézi DNA Ó6-methylguanin zpět k guanin a předchází nesouladu a chybám během replikace DNA a transkripce. Proto ztráta MGMT zvyšuje karcinogenní riziko u myší po expozici alkylační činidla.[7]Dva bakteriální isozymy jsou Ada a Ogt.
Funkce a mechanismus
| 'Ó6-alkylguanin DNA alkyltransferáza ' | |||||||||
|---|---|---|---|---|---|---|---|---|---|
| Identifikátory | |||||||||
| EC číslo | 2.1.1.63 | ||||||||
| Číslo CAS | 77271-19-3 | ||||||||
| Databáze | |||||||||
| IntEnz | IntEnz pohled | ||||||||
| BRENDA | Vstup BRENDA | ||||||||
| EXPASY | Pohled NiceZyme | ||||||||
| KEGG | Vstup KEGG | ||||||||
| MetaCyc | metabolická cesta | ||||||||
| PRIAM | profil | ||||||||
| PDB struktur | RCSB PDB PDBe PDBsum | ||||||||
| |||||||||
Ačkoli alkylovat mutageny přednostně upravit guaninovou bázi v poloze N7, Ó6-alkyl-guanin je hlavní karcinogenní lézí v DNA. Tento DNA adukt je odstraněn opravným proteinem Ó6-alkylguanin DNA alkyltransferáza prostřednictvím SN2 mechanismus. Tento protein není pravda enzym protože odstraňuje alkylovou skupinu z léze v a stechiometrický reakce a aktivní enzym se neregeneruje po alkylaci (označuje se jako a sebevražedný enzym ). Metyl-akceptorový zbytek v proteinu je a cystein.[8]
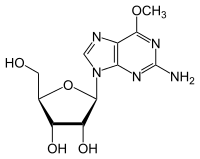
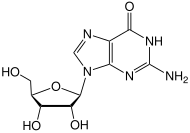
- Demetylace 6-0-methylguanosin na Guanosin
Klinický význam
Methylace genu promotér může hrát významnou roli v karcinogeneze. U pacientů s glioblastom, závažný typ nádoru na mozku, metylační stav MGMT gen určil, zda budou nádorové buňky reagovat temozolomid; pokud byl promotor methylován, byl temozolomid účinnější.[9] Na klinické úrovni se to promítá do prodlouženého přežití pacientů s glioblastomem s methylovaným MGMT promotér. Navíc, MGMT methylace může být použita k předpovědi přežití pacienta v modelech klinické predikce.[10] Pro testování stavu methylace promotoru MGMT v klinickém prostředí jsou upřednostňovány metody založené na DNA, jako je methylačně specifická polymerázová řetězová reakce (MS-PCR) nebo pyrosekvenování před imunohistochemickými nebo RNA založenými testy.[11]
MGMT Ukázalo se také, že je užitečným nástrojem zvyšujícím účinnost genové terapie. Použitím dvousložkového vektoru sestávajícího z požadovaného transgenu a MGMT, in vivo výběr léků lze použít k výběru úspěšně transdukovaných buněk.[12]
Mutageny v životním prostředí,[13] v tabákovém kouři,[14] jídlo,[15] stejně jako endogenní metabolické produkty[16] generují reaktivní elektrofilní druhy, které alkylovat nebo konkrétně methylát Generování DNA 6-0-methylguanin (m6G).
V roce 1985 Yarosh shrnul ranou práci, která stanovila m6G jako alkylovanou bázi v DNA, která byla nejvíce mutagenní a karcinogenní.[17] V roce 1994 Rasouli-Nia a kol.[18] ukázal, že přibližně jedna mutace byla indukována na každých osm neopravených m6G v DNA. Mutace mohou způsobit progresi k rakovině procesem přirozeného výběru.[Citace je zapotřebí ]
Exprese v rakovině
| Typ rakoviny | Četnost nedostatku rakoviny | Četnost nedostatku v sousedních defekt pole |
|---|---|---|
| Krční[19] | 61% | 39% |
| Kolorektální | 40%-90%[20][21][22][23][24] | 11%-34%[20][21] |
| Kolorektální s nestabilita mikrosatelitu[25] | 70% | 60% |
| Adenokarcinom jícnu | 71%-79%[26][27] | 89%[27] |
| Spinocelulární karcinom jícnu | 38%-96%[26][28][29] | 65%[29] |
| Glioblastom v důsledku metylace promotoru | 44%-59%[30][31] | |
| Spinocelulární karcinom hlavy a krku | 54%[32] | |
| Hepatocelulární karcinom (spojený s virem hepatitidy C)[33] | 68% | 65% |
| Hrtan | 54%-61%[34][35] | 38%[35] |
| Žaludek | 32%-88%[36][37] | 17%-78%[36][37] |
| Štítná žláza[38] | 87% |
Epigenetická represe
Pouze menšina sporadických rakovin s nedostatkem opravy DNA má mutaci v genu opravy DNA. Většina sporadických rakovin s nedostatkem opravy DNA však má jeden nebo více epigenetický změny, které snižují nebo umlčují expresi genu opravy DNA. Například ve studii se 113 sekvenčními kolorektálními rakovinami měli pouze čtyři missense mutace v opravném genu DNA MGMT, zatímco většina snížila expresi MGMT kvůli methylaci MGMT promotor region (an epigenetický změna).[39]
MGMT lze epigeneticky potlačovat mnoha způsoby.[40] Když je exprese MGMT potlačena u rakoviny, je to často způsobeno methylací její promotorové oblasti.[40] Exprese však může být také potlačena di-methylací lysinu 9 histonu 3[41] nebo nadměrnou expresí řady mikroRNA včetně miR-181d, miR-767-3p a miR-603.[40][42][43]
Nedostatek vad pole

A defekt pole je oblast nebo „pole“ epitelu, které bylo předem upraveno epigenetickými změnami a / nebo mutacemi, aby jej předurčilo k rozvoji rakoviny. Porucha pole je znázorněna na fotografii a schématu segmentu tlustého střeva, který má rakovinu tlustého střeva a čtyři malé polypy ve stejné oblasti. Jak zdůraznil Rubin: „Drtivá většina studií v oblasti výzkumu rakoviny byla provedena na dobře definovaných nádorech in vivo, nebo na diskrétních neoplastických ložiscích in vitro.[44] Přesto existují důkazy, že více než 80% somatických mutací nalezených v mutantních fenotypových lidských kolorektálních nádorech se vyskytuje před nástupem terminální klonální expanze. “[45] Podobně Vogelstein et al.[46] poukazují na to, že více než polovina somatických mutací identifikovaných v nádorech se vyskytla v pre-neoplastické fázi (v defektu pole), během růstu zdánlivě normálních buněk.
V tabulce výše byly zjištěny nedostatky MGMT u defektů pole (histologicky normální tkáně) obklopujících většinu rakovin. Pokud je MGMT epigeneticky omezeno nebo umlčeno, pravděpodobně by to kmenové buňce nepřineslo selektivní výhodu. Snížená nebo nepřítomná exprese MGMT by však způsobila zvýšené rychlosti mutace a jeden nebo více mutovaných genů může poskytnout buňce selektivní výhodu. Nedostatek výrazu MGMT Gen by pak mohl být přenášen jako selektivně neutrální nebo jen mírně škodlivý gen pro cestující (stopař), když mutovaná kmenová buňka generuje expandovaný klon. Pokračující přítomnost klonu s epigeneticky potlačeným MGMT bude i nadále generovat další mutace, z nichž některé mohou produkovat nádor.
Nedostatek s exogenním poškozením
Samotný nedostatek MGMT nemusí být dostatečný k tomu, aby způsobil progresi rakoviny. Myši s homozygotní mutací MGMT nevyvinuli více rakovin než myši divokého typu, když byly pěstovány bez stresu.[47] Stresující léčba myší azoxymethanem a dextransulfátem však způsobila více než čtyři nádory tlustého střeva na MGMT mutovanou myš, ale méně než jeden nádor na myš divokého typu.[48]
Represe v koordinaci s jinými geny pro opravu DNA
U rakoviny je často zjištěno, že je několik reparačních genů DNA současně potlačováno.[49] V jednom příkladu zahrnutí MGMT, Jiang et al.[50] provedli studii, kde hodnotili expresi mRNA 27 genů pro opravu DNA u 40 astrocytomů ve srovnání s normálními mozkovými tkáněmi od neastrocytomových jedinců. Z 27 hodnocených opravných genů DNA bylo 13 opravných genů DNA, MGMT, NTHL1, OGG1, SMUG1, ERCC1, ERCC2, ERCC3, ERCC4, MLH1, MLH3, RAD50, XRCC4 a XRCC5 všechny byly významně down-regulovány ve všech třech stupních (II, III a IV) astrocytomů. Represe těchto 13 genů v astrocytomech nižšího stupně i v astrocytomech vyššího stupně naznačuje, že mohou být důležité v časných i pozdějších stadiích astrocytomu. V dalším příkladu Kitajima et al.[51] zjistili, že imunoreaktivita pro MGMT a MLH1 exprese úzce korelovala u 135 vzorků rakoviny žaludku a ztráta MGMT a hMLH1 se zdála být synchronně urychlena během progrese nádoru.
Nedostatečná exprese více genů pro opravu DNA se často vyskytuje u rakoviny,[49] a může přispět k tisícům mutací, které se obvykle vyskytují u rakoviny (viz frekvence mutací u rakoviny ).
Interakce
Ó6Bylo prokázáno, že -methylguanin-DNA methyltransferáza komunikovat s estrogenový receptor alfa.[52]
Viz také
Reference
- ^ A b C GRCh38: Vydání souboru 89: ENSG00000170430 - Ensembl, Květen 2017
- ^ A b C GRCm38: Vydání souboru 89: ENSMUSG00000054612 - Ensembl, Květen 2017
- ^ „Human PubMed Reference:“. Národní centrum pro biotechnologické informace, Americká národní lékařská knihovna.
- ^ „Myš PubMed Reference:“. Národní centrum pro biotechnologické informace, Americká národní lékařská knihovna.
- ^ Tano K, Shiota S, Collier J, Foote RS, Mitra S (leden 1990). "Izolace a strukturní charakterizace cDNA klonu kódujícího lidský DNA opravný protein pro O6-alkylguanin". Proc. Natl. Acad. Sci. USA. 87 (2): 686–90. doi:10.1073 / pnas.87.2.686. PMC 53330. PMID 2405387.
- ^ Natarajan AT, Vermeulen S, Darroudi F, Valentine MB, Brent TP, Mitra S, Tano K (leden 1992). „Chromozomální lokalizace genu lidské O6-methylguanin-DNA methyltransferázy (MGMT) in situ hybridizací“. Mutageneze. 7 (1): 83–5. doi:10.1093 / mutage / 7.1.83. PMID 1635460.
- ^ Shiraishi A, Sakumi K, Sekiguchi M (říjen 2000). „Zvýšená citlivost myší na chemoterapeutická alkylační činidla s deficitem DNA opravné methyltransferázy“. Karcinogeneze. 21 (10): 1879–83. doi:10.1093 / carcin / 21.10.1879. PMID 11023546.
- ^ Kaina B, Christmann M, Naumann S, Roos WP (srpen 2007). „MGMT: klíčový uzel v boji proti genotoxicitě, karcinogenitě a apoptóze vyvolané alkylačními činidly“. Oprava DNA (Amst.). 6 (8): 1079–99. doi:10.1016 / j.dnarep.2007.03.008. PMID 17485253.
- ^ Hegi ME, Diserens AC, Gorlia T, Hamou MF, de Tribolet N, Weller M, Kros JM, Hainfellner JA, Mason W, Mariani L, Bromberg JE, Hau P, Mirimanoff RO, Cairncross JG, Janzer RC, Stupp R (2005 ). „Umlčení genu MGMT a prospěch z temozolomidu v glioblastomu“. N. Engl. J. Med. 352 (10): 997–1003. doi:10.1056 / NEJMoa043331. PMID 15758010.
- ^ Molenaar RJ, Verbaan D, Lamba S, Zanon C, Jeuken JW, Boots-Sprenger SH, Wesseling P, Hulsebos TJ, Troost D, van Tilborg AA, Leenstra S, Vandertop WP, Bardelli A, van Noorden CJ, Bleeker FE (2014) ). „Kombinace mutací IDH1 a stavu methylace MGMT předpovídá přežití v glioblastomu lépe než v případě samotného IDH1 nebo MGMT“. Neuronkologie. 16 (9): 1263–73. doi:10.1093 / neuonc / nou005. PMC 4136888. PMID 24510240.
- ^ Preusser, M.; Janzer, Charles R .; Felsberg, J .; Reifenberger, G .; Hamou, M. F .; Diserens, A. C .; Stupp, R .; Gorlia, T .; Marosi, C .; Heinzl, H .; Hainfellner, J. A .; Hegi, M. (říjen 2008). „Anti-O6-methylguanin-methyltransferáza (MGMT) imunohistochemie v multiformním glioblastomu: variabilita pozorovatele a nedostatečná souvislost s přežitím pacienta brání jeho použití jako klinického biomarkeru“. Brain Pathol. 18 (4): 520–532. doi:10.1111 / j.1750-3639.2008.00153.x. PMID 18400046. S2CID 21167901.
- ^ Chang AH, Stephan MT, Lisowski L, Sadelain M (2008). „Dodání lidského faktoru IX specifického pro erytroid z in vivo vybraných hematopoetických kmenových buněk po nemyeloablativní úpravě u myší s hemofilií B“. Mol. Ther. 16 (10): 1745–52. doi:10.1038 / mt.2008.161. PMC 2658893. PMID 18682698.
- ^ Bartsch H, Montesano R (1984). „Význam nitrosaminů pro lidskou rakovinu“. Karcinogeneze. 5 (11): 1381–93. doi:10.1093 / carcin / 5.11.1381. PMID 6386215.
- ^ Christmann M, Kaina B (2012). „O (6) -methylguanin-DNA methyltransferáza (MGMT): dopad na riziko rakoviny v reakci na tabákový kouř“. Mutat. Res. 736 (1–2): 64–74. doi:10.1016 / j.mrfmmm.2011.06.004. PMID 21708177.
- ^ Fahrer J, Kaina B (2013). „O6-methylguanin-DNA methyltransferáza v obraně proti N-nitrososloučeninám a kolorektálnímu karcinomu“. Karcinogeneze. 34 (11): 2435–42. doi:10.1093 / carcin / bgt275. PMID 23929436.
- ^ De Bont R, van Larebeke N (2004). „Endogenní poškození DNA u lidí: přehled kvantitativních údajů“. Mutageneze. 19 (3): 169–85. doi:10.1093 / mutage / geh025. PMID 15123782.
- ^ Yarosh DB (1985). „Role O6-methylguanin-DNA methyltransferázy v přežití buněk, mutagenezi a karcinogenezi“. Mutat. Res. 145 (1–2): 1–16. doi:10.1016/0167-8817(85)90034-3. PMID 3883145.
- ^ Rasouli-Nia A, Sibghat-Ullah, Mirzayans R, Paterson MC, Day RS (1994). „O kvantitativním vztahu mezi zbytky O6-methylguaninu v genomové DNA a produkcí výměn, mutací a letálních událostí sesterských chromatidů v linii nádorových buněk Mer-human“. Mutat. Res. 314 (2): 99–113. doi:10.1016/0921-8777(94)90074-4. PMID 7510369.
- ^ Iliopoulos D, Oikonomou P, Messinis I, Tsezou A (2009). "Korelace hypermethylace promotoru v genech hTERT, DAPK a MGMT s progresí cervikální onkogeneze". Oncol. Rep. 22 (1): 199–204. doi:10,3892 / nebo_00000425. PMID 19513524.
- ^ A b Shen L, Kondo Y, Rosner GL, Xiao L, Hernandez NS, Vilaythong J, Houlihan PS, Krouse RS, Prasad AR, Einspahr JG, Buckmeier J, Alberts DS, Hamilton SR, Issa JP (2005). „Methylace promotoru MGMT a defekt pole u sporadického kolorektálního karcinomu“. J. Natl. Cancer Inst. 97 (18): 1330–8. doi:10.1093 / jnci / dji275. PMID 16174854.
- ^ A b Lee KH, Lee JS, Nam JH, Choi C, Lee MC, Park CS, Juhng SW, Lee JH (2011). „Stav methylace promotoru genů hMLH1, hMSH2 a MGMT u kolorektálního karcinomu spojeného se sekvencí adenom-karcinom“. Langenbecks Arch Surg. 396 (7): 1017–26. doi:10.1007 / s00423-011-0812-9. PMID 21706233. S2CID 8069716.
- ^ Psofaki V, Kalogera C, Tzambouras N, Stephanou D, Tsianos E, Seferiadis K, Kolios G (2010). „Stav methylace promotoru hMLH1, MGMT a CDKN2A / p16 u kolorektálních adenomů“. Svět J. Gastroenterol. 16 (28): 3553–60. doi:10,3748 / wjg.v16.i28,3553. PMC 2909555. PMID 20653064.
- ^ Amatu A, Sartore-Bianchi A, Moutinho C, Belotti A, Bencardino K, Chirico G, Cassingena A, Rusconi F, Esposito A, Nichelatti M, Esteller M, Siena S (2013). „Promotér CpG ostrovní hypermethylace enzymu pro opravu DNA MGMT předpovídá klinickou odpověď na dakarbazin ve studii fáze II pro metastatický kolorektální karcinom“. Clin. Cancer Res. 19 (8): 2265–72. doi:10.1158 / 1078-0432.CCR-12-3518. PMID 23422094.
- ^ Mokarram P, Zamani M, Kavousipour S, Naghibalhossaini F, Irajie C, Moradi Sarabi M, Hosseini SV (2013). „Různé vzorce methylace DNA dvou odlišných promotorových oblastí O6-methylguanin-DNA methyltransferázy (O6-MGMT) u kolorektálního karcinomu“. Mol. Biol. Rep. 40 (5): 3851–7. doi:10.1007 / s11033-012-2465-3. PMID 23271133. S2CID 18733871.
- ^ Svrček M, Buhard O, Colas C, Coulet F, Dumont S, Massaoudi I, Lamri A, Hamelin R, Cosnes J, Oliveira C, Seruca R, Gaub MP, Legrain M, Collura A, Lascols O, Tiret E, Fléjou JF , Duval A (2010). „Methylační tolerance v důsledku defektu pole O6-methylguanin DNA methyltransferázy (MGMT) v sliznici tlustého střeva: inicializační krok ve vývoji neodpovídajících opravných deficitu kolorektálních karcinomů“. Střevo. 59 (11): 1516–26. doi:10.1136 / gut.2009.194787. PMID 20947886. S2CID 206950452.
- ^ A b Hasina R, Surati M, Kawada I, Arif Q, Carey GB, Kanteti R, Husain AN, Ferguson MK, Vokes EE, Villaflor VM, Salgia R (2013). „Methylace methyltransferázy O-6-methylguanin-deoxyribonukleové kyseliny zvyšuje reakci na léčbu temozolomidem u rakoviny jícnu“. J Carcinog. 12: 20. doi:10.4103/1477-3163.120632. PMC 3853796. PMID 24319345.
- ^ A b Kuester D, El-Rifai W, Peng D, Ruemmele P, Kroeckel I, Peters B, Moskaluk CA, Stolte M, Mönkemüller K, Meyer F, Schulz HU, Hartmann A, Roessner A, Schneider-Stock R (2009). „Ztlumení exprese MGMT hypermethylací promotoru v sekvenci metaplasie - dysplázie - karcinomu Barrettova jícnu“. Cancer Lett. 275 (1): 117–26. doi:10.1016 / j.canlet.2008.10.009. PMC 4028828. PMID 19027227.
- ^ Ling ZQ, Li P, Ge MH, Hu FJ, Fang XH, Dong ZM, Mao WM (2011). „Aberantní metylace různých genů pro opravu DNA prokazuje zřetelnou prognostickou hodnotu pro rakovinu jícnu“. Kopat. Dis. Sci. 56 (10): 2992–3004. doi:10.1007 / s10620-011-1774-z. PMID 21674174. S2CID 22913110.
- ^ A b Su Y, Yin L, Liu R, Sheng J, Yang M, Wang Y, Pan E, Guo W, Pu Y, Zhang J, Liang G (2014). „Stav methylace promotoru MGMT, hMSH2 a hMLH1 a jeho vztah k odpovídající expresi proteinu a mutacím TP53 v karcinomu spinocelulárních buněk z jícnu“. Med. Oncol. 31 (2): 784. doi:10.1007 / s12032-013-0784-4. PMID 24366688. S2CID 22746140.
- ^ Morandi L, Franceschi E, de Biase D, Marucci G, Tosoni A, Ermani M, Pession A, Tallini G, Brandes A (2010). „Promotorová methylační analýza O6-methylguanin-DNA methyltransferázy v glioblastomu: detekce uzamčenou kvantitativní PCR na bázi nukleové kyseliny s použitím otištěného genu (SNURF) jako reference“. Rakovina BMC. 10: 48. doi:10.1186/1471-2407-10-48. PMC 2843669. PMID 20167086.
- ^ Quillien V, Lavenu A, Karayan-Tapon L, Carpentier C, Labussière M, Lesimple T, Chinot O, Wager M, Honnorat J, Saikali S, Fina F, Sanson M, Figarella-Branger D (2012). „Srovnávací hodnocení 5 metod (methylačně specifická polymerázová řetězová reakce, MethyLight, pyrosekvenování, methylačně citlivé tavení s vysokým rozlišením a imunohistochemie) pro analýzu O6-methylguanin-DNA-methyltranferázy u řady 100 pacientů s glioblastomem.“ Rakovina. 118 (17): 4201–11. doi:10.1002 / cncr.27392. PMID 22294349. S2CID 8145409.
- ^ Koutsimpelas D, Pongsapich W, Heinrich U, Mann S, Mann WJ, Brieger J (2012). „Promotorová methylace MGMT, MLH1 a RASSF1A nádorových supresorových genů v karcinomu skvamózních buněk hlavy a krku: farmakologická demetylace genomu snižuje proliferaci skvamózních buněk hlavy a krku“. Oncol. Rep. 27 (4): 1135–41. doi:10.3892 / nebo 2012.1624. PMC 3583513. PMID 22246327.
- ^ Zekri AR, Bahnasy AA, Shoeab FE, Mohamed WS, El-Dahshan DH, Ali FT, Sabry GM, Dasgupta N, Daoud SS (2014). „Methylace více genů v hepatocelulárním karcinomu spojeném s virem hepatitidy C“. J Adv Res. 5 (1): 27–40. doi:10.1016 / j.jare.2012.11.002. PMC 4294722. PMID 25685469.
- ^ Pierini S, Jordanov SH, Mitkova AV, Chalakov IJ, Melnicharov MB, Kunev KV, Mitev VI, Kaneva RP, Goranova TE (2014). „Promotérová hypermethylace genů CDKN2A, MGMT, MLH1 a DAPK v laryngeálním spinocelulárním karcinomu a jejich asociace s klinickými profily pacientů“. Hlava krku. 36 (8): 1103–8. doi:10.1002 / hed.23413. PMID 23804521. S2CID 11916790.
- ^ A b Paluszczak J, Misiak P, Wierzbicka M, Woźniak A, Baer-Dubowska W (2011). "Častá hypermethylace DAPK, RARbeta, MGMT, RASSF1A a FHIT v laryngeálních spinocelulárních karcinomech a sousední normální sliznici". Oral Oncol. 47 (2): 104–7. doi:10.1016 / j.oraloncology.2010.11.006. PMID 21147548.
- ^ A b Jin J, Xie L, Xie CH, Zhou YF (2014). „Aberantní DNA methylace genů MGMT a hMLH1 v predikci rakoviny žaludku“. Genet. Mol. Res. 13 (2): 4140–5. doi:10.4238 / 2014.Květen 30.9. PMID 24938706.
- ^ A b Zou XP, Zhang B, Zhang XQ, Chen M, Cao J, Liu WJ (2009). "Promotérová hypermethylace více genů u časného adenokarcinomu žaludku a prekancerózních lézí". Hučení. Pathol. 40 (11): 1534–42. doi:10.1016 / j.humpath.2009.01.029. PMID 19695681.
- ^ Mokhtar M, Kondo K, Namura T, Ali AH, Fujita Y, Takai C, Takizawa H, Nakagawa Y, Toba H, Kajiura K, Yoshida M, Kawakami G, Sakiyama S, Tangoku A (2014). "Metylační a expresní profily genu MGMT v nádorech epitelu brzlíku". Rakovina plic. 83 (2): 279–87. doi:10.1016 / j.lungcan.2013.12.004. PMID 24388682.
- ^ Halford S, Rowan A, Sawyer E, Talbot I, Tomlinson I (červen 2005). „O (6) -methylguanin methyltransferáza u kolorektálních karcinomů: detekce mutací, ztráta exprese a slabá asociace s přechody G: C> A: T“. Střevo. 54 (6): 797–802. doi:10.1136 / gut.2004.059535. PMC 1774551. PMID 15888787.
- ^ A b C Cabrini G, Fabbri E, Lo Nigro C, Dechecchi MC, Gambari R (2015). „Regulace exprese O6-methylguanin-DNA methyltransferázy a léčba glioblastomu (recenze)“. Int. J. Oncol. 47 (2): 417–28. doi:10.3892 / ijo.2015.3026. PMC 4501657. PMID 26035292.
- ^ Nakagawachi T, Soejima H, Urano T, Zhao W, Higashimoto K, Satoh Y, Matsukura S, Kudo S, Kitajima Y, Harada H, Furukawa K, Matsuzaki H, Emi M, Nakabeppu Y, Miyazaki K, Sekiguchi M, Mukai T (2003). „Ztlumení účinku hypermethylace ostrova CpG a modifikací histonu na expresi genu O6-methylguanin-DNA methyltransferázy (MGMT) u lidské rakoviny“. Onkogen. 22 (55): 8835–44. doi:10.1038 / sj.onc.1207183. PMID 14647440.
- ^ Kushwaha D, Ramakrishnan V, Ng K, Steed T, Nguyen T, Futalan D, Akers JC, Sarkaria J, Jiang T, Chowdhury D, Carter BS, Chen CC (2014). „Screening miRNA v celém genomu odhalil miR-603 jako miRNA regulující MGMT v glioblastomech“. Cílový cíl. 5 (12): 4026–39. doi:10.18632 / oncotarget.1974. PMC 4147303. PMID 24994119.
- ^ Zhang W, Zhang J, Hoadley K, Kushwaha D, Ramakrishnan V, Li S, Kang C, You Y, Jiang C, Song SW, Jiang T, Chen CC (2012). „miR-181d: prediktivní biomarker glioblastomu, který snižuje expresi MGMT“. Neuronkologie. 14 (6): 712–9. doi:10.1093 / neuonc / nos089. PMC 3367855. PMID 22570426.
- ^ Rubin H (březen 2011). „Pole a rakovina pole: preneoplastický původ rakoviny: asymptomatická hyperplastická pole jsou prekurzory neoplazie a jejich postup k nádorům lze sledovat hustotou nasycení v kultuře“. BioEssays. 33 (3): 224–31. doi:10.1002 / bies.201000067. PMID 21254148. S2CID 44981539.
- ^ Tsao JL, Yatabe Y, Salovaara R, Järvinen HJ, Mecklin JP, Aaltonen LA, Tavaré S, Shibata D (únor 2000). „Genetická rekonstrukce historie jednotlivých kolorektálních nádorů“. Proc. Natl. Acad. Sci. USA. 97 (3): 1236–41. doi:10.1073 / pnas.97.3.1236. PMC 15581. PMID 10655514.
- ^ Vogelstein B, Papadopoulos N, Velculescu VE, Zhou S, Diaz LA, Kinzler KW (březen 2013). „Krajiny genomu rakoviny“. Věda. 339 (6127): 1546–58. doi:10.1126 / science.1235122. PMC 3749880. PMID 23539594.
- ^ Meira LB, Calvo JA, Shah D, Klapacz J, Moroski-Erkul CA, Bronson RT, Samson LD (2014). „Oprava endogenních lézí bází DNA moduluje životnost myší“. Oprava DNA (Amst.). 21: 78–86. doi:10.1016 / j.dnarep.2014.05.012. PMC 4125484. PMID 24994062.
- ^ Wirtz S, Nagel G, Eshkind L, Neurath MF, Samson LD, Kaina B (2010). „Jak základní excizní oprava, tak O6-methylguanin-DNA methyltransferáza chrání před methylací indukovanou karcinogenezí tlustého střeva“. Karcinogeneze. 31 (12): 2111–7. doi:10.1093 / carcin / bgq174. PMC 2994278. PMID 20732909.
- ^ A b Bernstein C, Bernstein H (2015). „Epigenetická redukce opravy DNA při progresi do rakoviny trávicího traktu“. Svět J Gastrointest Oncol. 7 (5): 30–46. doi:10,4251 / wjgo.v7.i5.30. PMC 4434036. PMID 25987950.
- ^ Jiang Z, Hu J, Li X, Jiang Y, Zhou W, Lu D (2006). "Expresní analýzy 27 genů pro opravu DNA v astrocytomu pomocí pole TaqMan s nízkou hustotou". Neurosci. Lett. 409 (2): 112–7. doi:10.1016 / j.neulet.2006.09.038. PMID 17034947.
- ^ Kitajima Y, Miyazaki K, Matsukura S, Tanaka M, Sekiguchi M (2003). "Ztráta exprese DNA opravných enzymů MGMT, hMLH1 a hMSH2 během progrese nádoru u rakoviny žaludku". Rakovina žaludku. 6 (2): 86–95. doi:10.1007 / s10120-003-0213-z. PMID 12861399.
- ^ Teo AK, Oh HK, Ali RB, Li BF (říjen 2001). „Modifikovaný lidský DNA opravný enzym O (6) -methylguanin-DNA methyltransferáza je negativním regulátorem transkripce zprostředkované estrogenovým receptorem při poškození alkylací DNA.“. Mol. Buňka. Biol. 21 (20): 7105–14. doi:10.1128 / MCB.21.20.7105-7114.2001. PMC 99886. PMID 11564893.
Další čtení
- Margison GP, Povey AC, Kaina B, Santibáñez Koref MF (2003). "Variabilita a regulace O6-alkylguanin-DNA alkyltransferázy". Karcinogeneze. 24 (4): 625–35. doi:10.1093 / carcin / bgg005. PMID 12727789.