Nepafenac - Nepafenac
 | |
| Klinické údaje | |
|---|---|
| Obchodní názvy | Nevanac, Ilevro, Amnac a další |
| AHFS /Drugs.com | Monografie |
| MedlinePlus | a606007 |
| Licenční údaje | |
| Těhotenství kategorie | |
| Trasy z správa | Aktuální oční kapky |
| ATC kód | |
| Právní status | |
| Právní status |
|
| Identifikátory | |
| |
| Číslo CAS | |
| PubChem CID | |
| IUPHAR / BPS | |
| DrugBank | |
| ChemSpider | |
| UNII | |
| KEGG | |
| ChEBI | |
| ChEMBL | |
| Řídicí panel CompTox (EPA) | |
| Informační karta ECHA | 100.207.414 |
| Chemické a fyzikální údaje | |
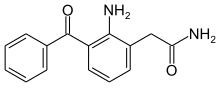
| Vzorec | C15H14N2Ó2 |
| Molární hmotnost | 254.289 g · mol−1 |
| 3D model (JSmol ) | |
| |
| |
| | |
Nepafenac, prodávané pod značkou Nevanac mimo jiné je a nesteroidní protizánětlivé léčivo (NSAID), obvykle prodávány jako předpis slza 0,1% roztok (Nevanac) nebo 0,3% roztok (Ilevro). Používá se k léčbě bolesti a zánětů spojených s šedý zákal chirurgická operace.[2] Nepafenac je a proléčivo z amfenak, inhibitor COX-1 a COX-2 aktivita.[3][4]
Lékařské použití
Nepafenac je indikován k použití při léčbě bolesti a zánětu po operaci katarakty.[2][5][6][7]
V Evropské unii je nepafenac indikován také ke snížení rizika pooperačního stavu makulární edém spojené s operací katarakty u lidí s cukrovkou.[7]
Farmakologie
Mechanismus účinku
Nepafenac je NSAID, o kterém se předpokládá, že je proléčivem amfenaku po konverzi hydrolázami oční tkáně po penetraci rohovka.[5][6] Amfenac, stejně jako ostatní NSAID, je považován za inhibitor cyklooxygenáza akce.[5][6]
Nežádoucí účinky
Vedlejší efekty zahrnovat bolest hlavy; rýma; bolest nebo tlak v obličeji; nevolnost; zvracení; a suché, svědění, lepkavé oči.[8] Mezi závažné nežádoucí účinky patří červené nebo krvavé oči; pocit cizího těla v oku; citlivost na světlo; snížil zraková ostrost; vidět skvrny nebo skvrny; uslzené oči; nebo výtok z očí nebo tvorba krust.[8]
Regulační
Nevanac
Dne 25. února 2005 podala společnost Alcon Nová aplikace drog (NDA) s USA Úřad pro kontrolu potravin a léčiv (FDA) pro Nevanac 0,1%.[9] Výsledky dvou studií uvedených v NDA (studie fáze 2/3 C-02-53; studie fáze 3 C-03-32) nebyly zveřejněny.[10] Studie C-02-53 sestávala z 228 pacientů v 10 centrech ve Spojených státech.[11] Studie C-03-32 sestávala z 522 pacientů ve 22 centrech ve Spojených státech.[11] Prezentované výsledky účinnosti byly potvrzeny ve studii publikované v roce 2007.[12]
Nevanac byl schválen FDA 19. srpna 2005 pod číslem aplikace 021–862.[13]
Ilevro
NDA pro společnost Ilevro byla podána 15. prosince 2011.[14] V jednoměsíční studii nevznikly v nové formulaci nepafenaku žádné nové toxicity.[15] Informace o bezpečnosti a účinnosti byly odvozeny z předchozí aplikace přípravku Nevanac.[15] V červnu 2010 byla zahájena potvrzující studie (studie C09055), která se skládala z více než 2 000 pacientů ze 49 lokalit v USA a 37 evropských lokalit.[16][17] Druhá studie fáze 3 (studie C11003) byla provedena na populaci 1342 pacientů na 37 místech po celých Spojených státech, kde se nepodařilo prokázat převahu nad přípravkem Nevanac při změněném režimu dávkování.[16]
Společnost Ilevro byla schválena úřadem FDA dne 16. října 2012 pod číslem žádosti 203–491.[18]
Komercializace
Nevanac i Ilevro vyrábí a prodává společnost Alcon, Inc.[5][6] Alcon je v současné době divizí Novartis International AG se sídlem především ve Švýcarsku.[19] Alcon, Inc. má také pobočky ve Švýcarsku a ve Spojených státech.[20] Společnost prošla několika změnami názvů, od Alcon Laboratories, Inc. po Alcon Universal, Ltd., až po Alcon, Inc.[20]
Nevanac vstoupil na trh v roce 2005 jako produkt společnosti Alcon, v té době dceřiné společnosti Nestlé.[21] 6. dubna 2008 společnost Novartis souhlasila s nákupem přibližně 74 milionů akcií společnosti Alcon od společnosti Nestlé za 143,18 USD za akcii.[21] Dne 4. ledna 2010 společnost Novartis souhlasila s nákupem všech zbývajících akcií společnosti Alcon od společnosti Nestlé, celkem 156 milionů akcií nebo 77% akcií společnosti.[21] V době nákupu byl představenstvu společnosti Alcon předložen návrh na fúzi podle švýcarského zákona o spojování.[21] Fúze byla dohodnuta 15. prosince 2010, čímž se Alcon stal „druhou největší divizí v rámci Novartisu“.[21] Fúze byla dokončena 8. dubna 2011.[22]
Společnost Ilevro zahájila společnost Alcon 21. ledna 2013.[23] V letech 2014 a 2015 čistý prodej společnosti Alcon vzrostl, k čemuž částečně přispěl zvýšený objem prodeje společnosti Ilevro.[24][25][26] V tomto finančním roce společnost Novartis vykázala celkový finanční dluh ve výši 18 miliard USD.[24] Od té doby se toto číslo neustále zvyšuje. V roce 2016 společnost Novartis vykázala celkový dluh 23,8 miliard USD,[27] vzrostl z 21,9 miliard dolarů vykázaných v roce 2015 [26] a 20,4 miliard USD vykázaných v roce 2014.[25] Od května 2017 má Novartis odhadovanou hodnotu 193,2 miliard dolarů.[28]
27. ledna 2016 se společnost Alcon přestěhovala do pobočky divize inovativních léčiv ve společnosti Novartis.[27] Na začátku roku 2016 Alcon uzavřel dohody s TrueVision i PowerVision a získal Transcend Medical.[27] Od ledna 2017 Novartis váží možnosti společnosti Alcon v obchodní struktuře.[27]
Náklady
Jak 2015, zhruba 266 751 pacientů Medicare Part D bylo předepsáno Ilevro jako součást jejich terapeutického režimu pro operaci katarakty, což společnosti Novartis vydělalo v roce 2015 přibližně 95,2 milionu $ ze 411 000 žádostí podaných pro tento lék.[29] Průměrné roční náklady na pacienta Medicare Part D pro Ilevro jsou 94 $.[29] Odhadovaná jednotková cena pro Nevanac ve Spojených státech je 88,93 USD.[30] U společnosti Ilevro je průměrná cena za jednotku 1,7 ml lahve 156,89 USD a jednotková cena za láhev 3 ml činí 88,91 USD.[31] Průměrná cena obou léků je podobná.[30][31]
Generické formulace ještě nejsou k dispozici pro žádný lék.[30][31]
Obchodní rizika
Alcon čelil v roce 2016 klesajícímu růstu, když čelil výzvám ve vývoji a marketingu nových produktů.[27]
Marketing
Novartis udržuje podrobnou jednotku zaměřenou na zdravotnické pracovníky, která se skládá z více než 3 000 zaměstnanců ve Spojených státech a dalších 21 000 po celém světě.[27] Novartis také usiluje o rozšíření přímé reklamy na spotřebitele a vstupu na trhy speciálních produktů.[27] Novartis rovněž bere na vědomí vliv pozice a preferencí v amerických centrech pro vzorce Medicare a Medicaid při rozšiřování jejich tržní hodnoty.[27]
Nepafenac, Nevanac a Ilevro chybí ve výroční zprávě za rok 2016 vydané společností Novartis.[27]
Duševní vlastnictví
V současné době existují[když? ] podáno sedm amerických patentů, které jsou přímo spojeny s modernizovanými formulacemi nepafenaku, všechny pocházejí od společnosti Novartis.[32] S Nevanacem jsou stále spojené tři patenty[když? ] aktivní[33] a čtyři spojené s Ilevro.[34] Nejstarší patent týkající se moderních formulací nepafenaku byl schválen 11. června 2002, poté, co byl podán v roce 1999, Bahramem Asgharianem.[35] Warren Wong, spojený se společností Alcon, Inc., podal patent ze dne Fort Worth, Texas, 2. prosince 2005, pro vodné suspenze nepafenaku.[36] Další patent na lék na bázi nepafenaku podali 8. května 2006 Geoffrey Owen, Amy Brooks a Gustav Graff.[37] Patent podali Masood A. Chowhan a Huagang Chen dne 9. února 2007 a byl schválen 24. května 2011,[38] těsně následovaný patentem podaným Warrenem Wongem 23. září 2010 a schváleným 6. prosince 2011.[39] Masood A. Chowhan, Malay Ghosh, Bahram Asgharian a Wesley Wehsin Han podali další patent 1. prosince 2010 a schválili 30. prosince 2014.[40] Nejčerstvější[když? ] patent podali Masood A. Chowhan, Malay Ghosh, Bahram Asgharian a Wesley Weshin Han dne 12. listopadu 2014 a byl schválen 30. května 2017.[41] Tyto patenty jsou platné do data v rozmezí od 17. července 2018 do 31. března 2032.[34]
Společnost Novartis také udržuje patenty na nepafenac ve 26 zemích mimo USA.[42]
Výzvy
Tato část musí být aktualizováno. (Červenec 2020) |
Společnost Alcon podala dne 4. března 2016 žalobu proti společnosti Watson Laboratories v Delaware za výrobu generické verze 0,3% nepafenacového přípravku Ilevro.[43] Stížnost byla změněna dne 14. června 2017.[44]
Reference
- ^ A b „Oční použití nepafenaku během těhotenství“. Drugs.com. 6. června 2019. Citováno 13. září 2020.
- ^ A b Nepafenac Monografie
- ^ Drugbank: Nepafenac
- ^ Zanetti FR, Fulco EA, Chaves FR, da Costa Pinto AP, Arieta CE, Lira RP (červenec 2012). „Účinek předoperačního použití lokálního prednisolon-acetátu, ketorolac tromethaminu, nepafenaku a placeba na udržení intraoperační mydriázy během operace katarakty: randomizovaná studie“. Indian Journal of Ophthalmology. 60 (4): 277–81. doi:10.4103/0301-4738.98705. PMC 3442462. PMID 22824596.
- ^ A b C d "Nevanac - nepafenac suspenze / kapky". DailyMed. 9. září 2019. Citováno 6. července 2020.
- ^ A b C d „Odpružení Ilevro-nepafenac“. DailyMed. 9. září 2019. Citováno 6. července 2020.
- ^ A b „Nevanac EPAR“. Evropská agentura pro léčivé přípravky (EMA). Citováno 6. července 2020.
- ^ A b "Nepafenac Oční". MedlinePlus. Americká národní lékařská knihovna. Citováno 31. října 2017.
- ^ „Schvalovací balíček Nevanac“ (PDF). NÁS. Úřad pro kontrolu potravin a léčiv (FDA). Citováno 31. října 2017.
- ^ Gaynes BI, Onyekwuluje A (červen 2008). „Aktuální oční NSAID: diskuse se zaměřením na oční suspenzi nepafenaku“. Klinická oftalmologie. 2 (2): 355–68. doi:10,2147 / opth.s1067. PMC 2693998. PMID 19668727.
- ^ A b „Statistický přehled Nevanacu“ (PDF). NÁS. Úřad pro kontrolu potravin a léčiv (FDA). Citováno 31. října 2017.
- ^ Lane SS, Modi SS, Lehmann RP, Holland EJ (leden 2007). „Oční suspenze Nepafenac 0,1% pro prevenci a léčbu očních zánětů spojených s operací katarakty“. Journal of Cataract and Refractive Surgery. 33 (1): 53–8. doi:10.1016 / j.jcrs.2006.08.043. PMID 17189793. S2CID 38881826.
- ^ „Balíček pro schválení léků: Nevanac (Nepafenac) Oční suspenze NDA # 021862“. NÁS. Úřad pro kontrolu potravin a léčiv (FDA). 6. ledna 2005. Citováno 27. říjen 2017.
- ^ „Schvalovací balíček Ilevro“ (PDF). NÁS. Úřad pro kontrolu potravin a léčiv (FDA). Citováno 31. října 2017.
- ^ A b „Přehled farmakologie 203491“ (PDF). NÁS. Úřad pro kontrolu potravin a léčiv (FDA). Citováno 31. října 2017.
- ^ A b „Statistický přehled Ilevro“ (PDF). NÁS. Úřad pro kontrolu potravin a léčiv (FDA). Citováno 31. října 2017.
- ^ „Potvrzovací studie Nepafenac 0,3%“. ClinicalTrials.gov. Americká národní lékařská knihovna. Citováno 31. října 2017.
- ^ „Balíček pro schválení léků: oční suspenze Nepafenac, 0,3% NDA # 203491“. NÁS. Úřad pro kontrolu potravin a léčiv (FDA). 8. dubna 2013. Citováno 27. říjen 2017.
- ^ "O nás". Novartis. Citováno 27. říjen 2017.
- ^ A b „Nevanacské správní dokumenty a korespondence“ (PDF). NÁS. Úřad pro kontrolu potravin a léčiv (FDA). Citováno 27. říjen 2017.
- ^ A b C d E „Výroční zpráva Alcon 2010“ (PDF). SEC EDGAR. Americká komise pro cenné papíry. Citováno 30. října 2017.
- ^ „Alcon Form 15“. SEC EDGAR. Americká komise pro cenné papíry. Citováno 30. října 2017.
- ^ „Alcon uvádí na trh ILEVRO ™ (oční suspenze nepafenacu) 0,3%, nový nesteroidní protizánětlivý lék, pro léčbu bolesti a zánětu spojeného s operací katarakty“. Alcon. Citováno 30. října 2017.
- ^ A b „Formulář 20-F“. SEC EDGAR. Americká komise pro cenné papíry. Citováno 30. října 2017.
- ^ A b „Formulář 20-F“. SEC EDGAR. Americká komise pro cenné papíry. Citováno 30. října 2017.
- ^ A b „Formulář 20F“. SEC EDGAR. Americká komise pro cenné papíry. Citováno 30. října 2017.
- ^ A b C d E F G h i „Formulář 20-F“. SEC EDGAR. Americká komise pro cenné papíry. Citováno 31. října 2017.
- ^ „Novartis na seznamu nejlepších nadnárodních umělců Forbes“. Forbes. Citováno 31. října 2017.
- ^ A b „Kontrola předepisujícího lékaře: Ilevro“. Kontrola předepisujícího lékaře. ProPublica. Citováno 30. října 2017.
- ^ A b C „Ceny, kupóny a programy pomoci pacientům Nevanac“. Drugs.com. Citováno 31. října 2017.
- ^ A b C „Ceny, kupóny a programy pomoci pacientům Ilevro“. Drugs.com. Citováno 31. října 2017.
- ^ „Nepafenac“. Patenty USA. PharmaCompass. Citováno 30. října 2017.
- ^ „Obecná dostupnost Nevanacu“. Drugs.com. Citováno 31. října 2017.
- ^ A b „Obecná dostupnost Ilevro“. Drugs.com. Citováno 31. října 2017.
- ^ „Patentová přihláška USA: 6403609“. Úřad pro patenty a ochranné známky Spojených států. Citováno 31. října 2017.
- ^ „Patentová přihláška USA: 0060122277“. Úřad pro patenty a ochranné známky Spojených států. Citováno 30. října 2017.
- ^ „Patentová přihláška USA: 0060257487“. Úřad pro patenty a ochranné známky Spojených států. Citováno 27. říjen 2017.
- ^ „Patent USA: 7947295“. Úřad pro patenty a ochranné známky Spojených států. Citováno 31. října 2017.
- ^ „Patent USA: 8071648“. Úřad pro patenty a ochranné známky Spojených států. Citováno 31. října 2017.
- ^ „Patent USA: 8921337“. Úřad pro patenty a ochranné známky Spojených států. Citováno 31. října 2017.
- ^ „Patent Spojených států: 9662398“. Úřad pro patenty a ochranné známky Spojených států. Citováno 31. října 2017.
- ^ „Nepafenac - podrobnosti o generických drogách“. Hodinky DrugPatent. thinkBiotech LLC. Citováno 31. října 2017.
- ^ "Stížnost". RPX Insight. Citováno 31. října 2017.
- ^ „Pozměněná stížnost“. RPX Insight. Citováno 31. října 2017.
externí odkazy
- „Nepafenac“. Informační portál o drogách. Americká národní lékařská knihovna.
