Dehydratáza kyseliny delta-aminolevulinové - Delta-aminolevulinic acid dehydratase
| porfobilinogen syntáza | |||||||||
|---|---|---|---|---|---|---|---|---|---|
 DALA dehydratáza | |||||||||
| Identifikátory | |||||||||
| EC číslo | 4.2.1.24 | ||||||||
| Číslo CAS | 9036-37-7 | ||||||||
| Databáze | |||||||||
| IntEnz | IntEnz pohled | ||||||||
| BRENDA | Vstup BRENDA | ||||||||
| EXPASY | Pohled NiceZyme | ||||||||
| KEGG | Vstup KEGG | ||||||||
| MetaCyc | metabolická cesta | ||||||||
| PRIAM | profil | ||||||||
| PDB struktur | RCSB PDB PDBe PDBsum | ||||||||
| Genová ontologie | AmiGO / QuickGO | ||||||||
| |||||||||
| Dehydratáza kyseliny delta-aminolevulinové | |||||||
|---|---|---|---|---|---|---|---|
| Identifikátory | |||||||
| Symbol | ALAD | ||||||
| Gen NCBI | 210 | ||||||
| HGNC | 395 | ||||||
| OMIM | 125270 | ||||||
| RefSeq | NM_001003945 | ||||||
| UniProt | P13716 | ||||||
| Další údaje | |||||||
| EC číslo | 4.2.1.24 | ||||||
| Místo | Chr. 9 q32 | ||||||
| |||||||
| ALAD | |||||||||
|---|---|---|---|---|---|---|---|---|---|
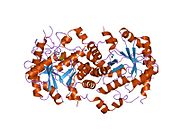
 krystalická struktura s vysokým rozlišením dehydratázy 5-aminolevulinové kyseliny závislé na mg2 | |||||||||
| Identifikátory | |||||||||
| Symbol | ALAD | ||||||||
| Pfam | PF00490 | ||||||||
| Pfam klan | CL0036 | ||||||||
| InterPro | IPR001731 | ||||||||
| STRÁNKA | PDOC00153 | ||||||||
| SCOP2 | 1aw5 / Rozsah / SUPFAM | ||||||||
| |||||||||
Dehydratáza kyseliny delta-aminolevulinové (porfobilinogen syntázanebo ALA dehydratázanebo aminolevulinát dehydratáza) je enzym (ES 4.2.1.24 ), který je u lidí kódován ALAD gen.[5][6] Porfobilinogen syntáza (nebo ALA dehydratázanebo aminolevulinát dehydratáza) syntetizuje porfobilinogen přes asymetrický kondenzace ze dvou molekuly z kyselina aminolevulinová. Vše přírodní tetrapyrroly, počítaje v to lemy, chlorofyly a vitamin B12, sdílejte porfobilinogen jako běžného předchůdce. Prototypem je porfobilinogen syntáza morpheein.[7]
Funkce
Katalyzuje následující reakci, druhý krok biosyntézy porfyrin:
- 2 kyselina 8-aminolevulinová porfobilinogen + 2 H2Ó
Katalyzuje tedy kondenzaci 2 molekul delta-aminolevulinátu za vzniku porfobilinogenu (prekurzoru heme, cytochromy a jiné hemoproteiny). Tato reakce je prvním společným krokem v biosyntéze všech biologických tetrapyrrolů. Zinek je nezbytný pro enzymatickou aktivitu.
Struktura
Strukturální základ pro alosterická regulace Porphobilinogen synthase (PBGS) je modulace a kvartérní strukturní rovnováha mezi oktamerem a hexamerem (pomocí dimerů), která je schematicky znázorněna jako 6mer * ↔ 2mer * ↔ 2mer ↔ 8mer. * Představuje přesměrování mezi dvěma doménami každé podjednotky, ke kterému dochází v disociovaném stavu, protože je ve větších multimerech stericky zakázáno.[7]

PBGS je kódován jediným gen a každý multimer PBGS se skládá z více kopií stejného proteinu. Každá podjednotka PBGS se skládá z ~ 300 zbytek doména αβ-barel, která obsahuje aktivní místo enzymu ve svém středu, a doména N-terminálního ramene zbytku> 25. Alosterickou regulaci PBGS lze popsat z hlediska orientace domény αβ-barelu vzhledem k doméně N-koncového ramene.
Každé N-koncové rameno má až dvě interakce s jinými podjednotkami v multimeru PBGS. Jedna z těchto interakcí pomáhá stabilizovat „uzavřený“ konformace víka aktivního místa. Druhá interakce omezuje přístup rozpouštědla z druhého konce αβ-barelu.
V neaktivním multimerním stavu N-terminál doména paže není zapojena do interakce stabilizující víčko a v krystalové struktuře neaktivní sestavy je víčko aktivního místa neuspořádané.
Allosterické regulátory
Jako téměř univerzální enzym s vysoce konzervovaným aktivním místem by PBGS nebyl hlavním cílem vývoje antimikrobiální látky a / nebo herbicidy. Naopak alosterická místa mohou být mnohem více fylogeneticky variabilní než aktivní místa, což představuje více příležitostí pro vývoj léčiv.[7]
Fylogenetické variace v PBGS allostery vede k vymezení diskuse o alosterické regulaci PBGS z hlediska vnitřních a vnějších faktorů.
Vnitřní alosterické regulátory
Hořčík
Alosterické hořčík ion leží na vysoce hydratovaném rozhraní dvou pro-oktamerových dimerů. Zdá se, že je snadno oddělitelný a ukázalo se, že při odstraňování hořčíku se hromadí hexamery in vitro.[8]
pH
I když to není běžné zvažovat hydronium ionty jako alosterické regulátory, v případě PBGS, bylo prokázáno, že protonace postranního řetězce v jiných než aktivních místech ovlivňuje rovnováhu kvartérní struktury, a tím ovlivňuje také rychlost jeho katalyzované reakce.
Vnější alosterické regulátory
Stabilizace hexameru s malou molekulou
Inspekce PBGS 6mer * odhalila povrchovou dutinu, která se v 8meru nenachází. Bylo navrženo, aby se malá molekula vázající na tuto fylogeneticky proměnlivou dutinu stabilizovala 6mer * cílených PBGS a následně inhibovala aktivitu.
Takové alosterické regulátory jsou známé jako morphlocks protože blokují PBGS ve specifické morfheeinové formě (6mer *).[9]
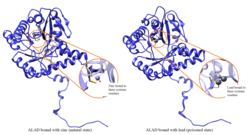
Otrava olovem
Enzymatická aktivita ALAD je inhibována Vést, počínaje hladinami olova v krvi, které byly kdysi považovány za bezpečné (<10 μg / dL), a pokračující negativní korelací v rozmezí od 5 do 95 μg / dL.[10] Inhibice ALAD olovem vede k anémie primárně proto, že inhibuje syntézu hemu a zkracuje životnost oběhu červené krvinky, ale také stimulací nadměrné produkce hormonu erytropoetin, což vede k nedostatečnému zrání červených krvinek od jejich předků. Porucha strukturního genu ALAD může způsobit zvýšenou citlivost na otravu olovem a akutní játra porfyrie. Alternativně byly identifikovány sestřihové varianty transkriptu kódující různé izoformy.[11]
Nedostatek
Nedostatek syntázy porfobilinogenu se obvykle získává (spíše než dědičně) a může být způsoben otrava těžkými kovy, zvláště otrava olovem, protože enzym je velmi citlivý na inhibici těžkými kovy.[12]
Dědičná nedostatečnost porfobilinogen syntázy se nazývá nedostatek porfobilinogen syntázy (nebo ALA dehydratázy) poprhyria. Je to extrémně vzácná příčina porfyrie,[13] s méně než 10 hlášenými případy.[14] Všechny varianty proteinu spojené s onemocněním upřednostňují tvorbu hexameru ve srovnání s lidským enzymem divokého typu.[13]
 Syntéza hemu - všimněte si, že některé reakce probíhají v cytoplazma a někteří v mitochondrie (žlutá) |
PBGS jako prototyp morpheeinu
Model morfheeinu allostery, jehož příkladem je PBGS, přidává další vrstvu porozumění potenciálním mechanismům pro regulaci funkce bílkovin a doplňuje zvýšené zaměření, které komunita pro vědu o bílkovinách klade na dynamiku struktury proteinů.[7]
Tento model ilustruje, jak se střídá dynamika jevů, jako jsou alternativní konformace proteinů oligomerní stavů a mohou být využity přechodné interakce protein-protein pro alosterickou regulaci katalytické aktivity.
Reference
- ^ A b C GRCh38: Vydání souboru 89: ENSG00000148218 - Ensembl, Květen 2017
- ^ A b C GRCm38: Vydání souboru 89: ENSMUSG00000028393 - Ensembl, Květen 2017
- ^ „Human PubMed Reference:“. Národní centrum pro biotechnologické informace, Americká národní lékařská knihovna.
- ^ „Myš PubMed Reference:“. Národní centrum pro biotechnologické informace, Americká národní lékařská knihovna.
- ^ Eiberg H, Mohr J, Nielsen LS (únor 1983). „delta-aminolevulinátdehydráza: synteny s ABO-AK1-ORM (a přiřazení k chromozomu 9)“. Klinická genetika. 23 (2): 150–4. doi:10.1111 / j.1399-0004.1983.tb01864.x. PMID 6839527. S2CID 27267679.
- ^ Beaumont C, Foubert C, Grandchamp B, Weil D, Gross MS, Nordmann Y (květen 1984). "Přiřazení lidského genu pro delta aminolevulinát dehydrasu na chromozom 9 hybridizací somatických buněk a specifickým enzymovým imunotestem". Annals of Human Genetics. 48 (2): 153–9. doi:10.1111 / j.1469-1809.1984.tb01010.x. PMID 6378062. S2CID 24098976.
- ^ A b C d Jaffe EK, Lawrence SH (březen 2012). „Allostery and the dynamic oligomerization of porphobilinogen synthase“. Archivy biochemie a biofyziky. 519 (2): 144–53. doi:10.1016 / j.abb.2011.10.010. PMC 3291741. PMID 22037356.
- ^ Breinig S, Kervinen J, Stith L, Wasson AS, Fairman R, Wlodawer A, et al. (Září 2003). „Kontrola biosyntézy tetrapyrrolu alternativními kvartérními formami syntázy porfobilinogenu“. Přírodní strukturní biologie. 10 (9): 757–63. doi:10.1038 / nsb963. PMID 12897770. S2CID 24188785.
- ^ Lawrence SH, Jaffe EK (2008). „Rozšíření konceptů vztahů mezi strukturou a funkcí proteinů a kinetiky enzymů: výuka pomocí morfeinů“. Výuka biochemie a molekulární biologie. 36 (4): 274–283. doi:10,1002 / bmb.20211. PMC 2575429. PMID 19578473.
- ^ Abadin H, Ashizawa A, Stevens YW, Llados F, Diamond G, Sage G, Citra M, Quinones A, Bosch SJ, Swarts SG (srpen 2007). Toxikologický profil olova (PDF). Atlanta, GA: Agentura pro registr toxických látek a nemocí (USA). 22, 30. PMID 24049859. Citováno 22. listopadu 2015.
- ^ „Entrez Gene: ALAD aminolevulinate, delta-, dehydratase“.
- ^ ALA dehydratázová reakce, z NetBiochem na University of Utah. Poslední úprava 5. 5. 95
- ^ A b Jaffe EK, Stith L (únor 2007). „ALAD porfyrie je konformační onemocnění“. American Journal of Human Genetics. 80 (2): 329–37. doi:10.1086/511444. PMC 1785348. PMID 17236137.
- ^ Přehled porfyrií Archivováno 2011-07-22 na Wayback Machine at The Porphyrias Consortium (a part of NIH Rare Diseases Clinical Research Network (RDCRN)) Citováno červen 2011
externí odkazy
- Člověk ALAD umístění genomu a ALAD stránka s podrobnostmi o genu v UCSC Genome Browser.
- delta-aminolevulinová + kyselina + dehydratáza v americké národní lékařské knihovně Lékařské předměty (Pletivo)
- http://www.omim.org/entry/125270?search=pbgs&highlight=pbgs
Další čtení
- Bernard A, Lauwerys R (1988). „Kovem vyvolané alterace dehydratázy kyseliny delta-aminolevulinové“. Annals of the New York Academy of Sciences. 514: 41–7. doi:10.1111 / j.1749-6632.1987.tb48759.x. PMID 3327436. S2CID 41966070.
- Jaffe EK (říjen 2004). "Porfobilinogen syntáza katalyzovaná reakčním mechanismem". Bioorganická chemie. 32 (5): 316–25. doi:10.1016 / j.bioorg.2004.05.010. PMID 15381398.
- Roels HA, Buchet JP, Lauwerys RR, Sonnet J (srpen 1975). „Srovnání in vivo účinku anorganického olova a kadmia na systém glutathion reduktázy a delta-aminolevulinát dehydratázu v lidských erytrocytech“. British Journal of Industrial Medicine. 32 (3): 181–92. doi:10.1136 / oem.32.3.181. PMC 1008057. PMID 1156566.
- Ishida N, Fujita H, Fukuda Y, Noguchi T, Doss M, Kappas A, Sassa S (květen 1992). „Klonování a exprese defektních genů u pacienta s porfyrií delta-aminolevulinát dehydratázy“. The Journal of Clinical Investigation. 89 (5): 1431–7. doi:10,1172 / JCI115732. PMC 443012. PMID 1569184.
- Dawson SJ, White LA (květen 1992). „Léčba endokarditidy Haemophilus aphrophilus ciprofloxacinem“. The Journal of Infection. 24 (3): 317–20. doi:10.1016 / S0163-4453 (05) 80037-4. PMID 1602151.
- Astrin KH, Kaya AH, Wetmur JG, Desnick RJ (Srpen 1991). „RsaI polymorfismus v lidském genu delta-aminolevulinát dehydratázy v 9q34“. Výzkum nukleových kyselin. 19 (15): 4307. doi:10.1093 / nar / 19.15.4307-a. PMC 328595. PMID 1678509.
- Wetmur JG, Kaya AH, Plewinska M, Desnick RJ (říjen 1991). „Molekulární charakterizace alely lidské delta-aminolevulinát dehydratázy 2 (ALAD2): důsledky pro molekulární screening jedinců na genetickou náchylnost k otravě olovem“. American Journal of Human Genetics. 49 (4): 757–63. PMC 1683158. PMID 1716854.
- Plewinska M, Thunell S, Holmberg L, Wetmur JG, Desnick RJ (červenec 1991). „porfyrie s deficitem delta-aminolevulinát dehydratázy: identifikace molekulárních lézí u těžce postiženého homozygota“. American Journal of Human Genetics. 49 (1): 167–74. PMC 1683193. PMID 2063868.
- Potluri VR, Astrin KH, Wetmur JG, Bishop DF, Desnick RJ (červenec 1987). „Human delta-aminolevulinate dehydratase: chromosomal localization to 9q34 by in situ hybridization“. Genetika člověka. 76 (3): 236–9. doi:10.1007 / BF00283614. PMID 3036687. S2CID 32211471.
- Gibbs PN, Jordan PM (červen 1986). "Identifikace lysinu v aktivním místě lidské 5-aminolaevulinát dehydratázy". The Biochemical Journal. 236 (2): 447–51. doi:10.1042 / bj2360447. PMC 1146860. PMID 3092810.
- Wetmur JG, Bishop DF, Cantelmo C, Desnick RJ (říjen 1986). „Lidská delta-aminolevulinát dehydratáza: nukleotidová sekvence klonu cDNA plné délky“. Sborník Národní akademie věd Spojených států amerických. 83 (20): 7703–7. Bibcode:1986PNAS ... 83,7703W. doi:10.1073 / pnas.83.20.7703. PMC 386789. PMID 3463993.
- Wetmur JG, Bishop DF, Ostasiewicz L, Desnick RJ (1986). "Molekulární klonování cDNA pro lidskou delta-aminolevulinát dehydratázu". Gen. 43 (1–2): 123–30. doi:10.1016/0378-1119(86)90015-6. PMID 3758678.
- Doss M, von Tiepermann R, Schneider J (1981). „Akutní syndrom jaterní porfyrie s defektem porfobilinogen syntázy“. International Journal of Biochemistry. 12 (5–6): 823–6. doi:10.1016 / 0020-711X (80) 90170-6. PMID 7450139.
- Kaya AH, Plewinska M, Wong DM, Desnick RJ, Wetmur JG (leden 1994). „Gen lidské delta-aminolevulinát dehydratázy (ALAD): struktura a alternativní sestřih erytroidních a udržovacích mRNA“. Genomika. 19 (2): 242–8. doi:10.1006 / geno.1994.1054. PMID 8188255.
- Akagi R, Yasui Y, Harper P, Sassa S (září 1999). "Nová mutace delta-aminolaevulinát dehydratázy u zdravého dítěte s 12% aktivitou erytrocytového enzymu". British Journal of Hematology. 106 (4): 931–7. doi:10.1046 / j.1365-2141.1999.01647.x. PMID 10519994. S2CID 24044521.
- Akagi R, Shimizu R, Furuyama K, Doss MO, Sassa S (březen 2000). „Nové molekulární defekty genu delta-aminolevulinát dehydratázy u pacienta se zděděnou akutní jaterní porfyrií“. Hepatologie. 31 (3): 704–8. doi:10,1002 / hep. 510310321. PMID 10706561. S2CID 8998084.
- Kervinen J, Jaffe EK, Stauffer F, Neier R, Wlodawer A, Zdanov A (červenec 2001). „Mechanický základ pro sebevražednou inaktivaci porfobilinogen syntázy kyselinou 4,7-dioxosebakovou, inhibitorem, který vykazuje dramatickou druhovou selektivitu“. Biochemie. 40 (28): 8227–36. CiteSeerX 10.1.1.374.9639. doi:10.1021 / bi010656k. PMID 11444968.