Biliverdin reduktáza - Biliverdin reductase
| biliverdin reduktáza | |||||||||
|---|---|---|---|---|---|---|---|---|---|
 | |||||||||
| Identifikátory | |||||||||
| EC číslo | 1.3.1.24 | ||||||||
| Číslo CAS | 9074-10-6 | ||||||||
| Databáze | |||||||||
| IntEnz | IntEnz pohled | ||||||||
| BRENDA | Vstup BRENDA | ||||||||
| EXPASY | Pohled NiceZyme | ||||||||
| KEGG | Vstup KEGG | ||||||||
| MetaCyc | metabolická cesta | ||||||||
| PRIAM | profil | ||||||||
| PDB struktur | RCSB PDB PDBe PDBsum | ||||||||
| Genová ontologie | AmiGO / QuickGO | ||||||||
| |||||||||
| biliverdin reduktáza A | |||||||
|---|---|---|---|---|---|---|---|
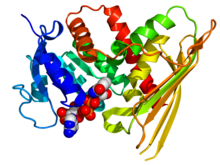 Krystalografická struktura lidské biliverdin reduktázy A na základě PDB: 2H63Souřadnice. Enzym je zobrazen jako karikatura duhové barvy (N-konec = modrá, C-konec = červená) zatímco NADP kofaktor je zobrazen jako model vyplňování prostoru (uhlík = bílá, kyslík = červená, dusík = modrá, fosfor = oranžová). | |||||||
| Identifikátory | |||||||
| Symbol | BLVRA | ||||||
| Alt. symboly | BLVR | ||||||
| Gen NCBI | 644 | ||||||
| HGNC | 1062 | ||||||
| OMIM | 109750 | ||||||
| RefSeq | NM_000712 | ||||||
| UniProt | P53004 | ||||||
| Další údaje | |||||||
| EC číslo | 1.3.1.24 | ||||||
| Místo | Chr. 7 p14-cen | ||||||
| |||||||
| biliverdin reduktáza B | |||||||
|---|---|---|---|---|---|---|---|
| Identifikátory | |||||||
| Symbol | BLVRB | ||||||
| Alt. symboly | FLR | ||||||
| Gen NCBI | 645 | ||||||
| HGNC | 1063 | ||||||
| OMIM | 600941 | ||||||
| RefSeq | NM_000713 | ||||||
| UniProt | P30043 | ||||||
| Další údaje | |||||||
| EC číslo | 1.3.1.24 | ||||||
| Místo | Chr. 19 q13.1-13.2 | ||||||
| |||||||
| Biliverdin reduktáza, katalytická | |||||||||
|---|---|---|---|---|---|---|---|---|---|
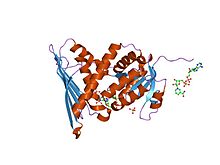 krystalová struktura komplexu biliverdin reduktáza enzym-kofaktor | |||||||||
| Identifikátory | |||||||||
| Symbol | Biliv-reduc_cat | ||||||||
| Pfam | PF09166 | ||||||||
| InterPro | IPR015249 | ||||||||
| SCOP2 | 1lc0 / Rozsah / SUPFAM | ||||||||
| |||||||||
Biliverdin reduktáza (BVR) je enzym (ES 1.3.1.24 ) nalezené ve všech tkáních za normálních podmínek, zejména však v retikulo-makrofágech jater a sleziny. BVR usnadňuje převod biliverdin na bilirubin přes snížení dvojné vazby mezi druhou a třetí pyrrol kroužek do jednoduché vazby.
Existují dva isozymy u lidí, každý kódovaný svým vlastním genem, biliverdin reduktáza A (BLVRA) a biliverdin reduktáza B (BLVRB).
Mechanismus katalýzy
BVR jedná biliverdin redukcí jeho dvojné vazby mezi pyrrolovými kruhy na jednoduchou vazbu.[1] Dosahuje toho pomocí NADPH + H+ jako donor elektronů, formování bilirubin a NADP+ jako produkty.
BVR katalyzuje tuto reakci prostřednictvím překrývajícího se vazebného místa včetně Lys18, Lys22, Lys179, Arg183a Arg185 jako zbytky klíčů.[2] Toto vazebné místo se váže na biliverdin a způsobuje jeho disociaci od hemu oxygenázy (HO) (která katalyzuje reakci železitého hemu -> biliverdin ), což způsobí následnou redukci na bilirubin.[3]
 Redukce biliverdinu na bilirubin katalyzovaná biliverdin reduktázou. |
Struktura
BVR se skládá ze dvou těsně zabalených domén o délce 247-415 aminokyselin a obsahující a Rossmann fold.[4] Bylo také stanoveno, že BVR je protein vázající zinek, přičemž každý enzymový protein má jeden silně vázající atom zinku.[5][6]
The C-terminál polovina BVR obsahuje katalytická doména, který přijímá a struktura obsahující šest pramenů beta-list který je na jedné straně lemován několika alfa-šroubovice. Tato doména obsahuje katalytické Aktivní stránky, což snižuje gama-methinový můstek otevřeného tetrapyrrolu, biliverdin IX alfa, na bilirubin s doprovodem oxidace NADH nebo NADPH kofaktor.[7]
Funkce
BVR pracuje s redoxním cyklem biliverdin / bilirubin. Přeměňuje biliverdin na bilirubin (silný antioxidant), který je poté přeměněn zpět na biliverdin působením reaktivní formy kyslíku (ROS). Tento cyklus umožňuje neutralizaci ROS a opětovné použití produktů biliverdinu. Biliverdin je také v cyklu doplňován tvorbou z hemových jednotek hem oxygenáza (HO) lokalizované z endoplazmatického retikula.[8]
Bilirubin, jeden z posledních produktů heme degradace v játrech, je dále zpracován a vylučován žlučí po konjugaci s kyselina glukuronová.[9] Tímto způsobem je BVR u mnoha savců nezbytný pro likvidaci hem katabolitů - zejména u plodu, kde jsou placentární membrány propustné pro bilirubin, ale nepropustné pro biliverdin - což pomáhá při odstraňování potenciálně toxického hromadění bílkovin.[10]
Společnost BVR byla nedávno také uznána jako regulátor metabolismus glukózy a v buněčném růstu a kontrole apoptózy, díky svému charakteru kinázy s dvojí specificitou.[11] Tato kontrola nad metabolizmem glukózy naznačuje, že BVR může hrát roli v patogenezi mnoha metabolických onemocnění - ta pozoruhodná je cukrovka řízením předřazeného aktivátoru inzulínového růstového faktoru-1 (IGF-1) a signální dráha mitogenem aktivovaná protein kináza (MAPK).[12]
Relevance nemoci
BVR působí jako prostředek k regeneraci bilirubinu v opakujícím se redoxním cyklu bez významné úpravy koncentrace dostupného bilirubinu. Při zachování těchto úrovní se zdá, že BVR představuje novou strategii léčby roztroušená skleróza a další typy chorob zprostředkovaných oxidačním stresem.[13] Tento mechanismus je způsoben zesílením silného antioxidačního působení bilirubinu, protože to může zlepšit onemocnění zprostředkovaná volnými radikály.[14]
Studie ukázaly, že redoxní cyklus BVR je nezbytný pro zajištění fyziologické cytoprotekce. Genetické knock-outy a snížené hladiny BVR prokázaly zvýšenou tvorbu ROS a mají za následek zvýšenou smrt buněk. Buňky, u kterých došlo k 90% snížení BVR, zaznamenaly třikrát normální hladiny ROS.[15] Prostřednictvím tohoto ochranného a zesilovacího cyklu umožňuje BVR nízkým koncentracím bilirubinu překonat 10 000krát vyšší koncentrace ROS.[16]
Reference
- ^ Rigney E, Mantle TJ (listopad 1988). "Reakční mechanismus hovězí ledviny biliverdin reduktázy". Biochimica et Biophysica Acta (BBA) - proteinová struktura a molekulární enzymologie. 957 (2): 237–42. doi:10.1016/0167-4838(88)90278-6. PMID 3191141.
- ^ Wang J, de Montellano PR (květen 2003). „Vazebná místa na lidské hemoxygenáze-1 pro reduktázu cytochromu p450 a biliverdin reduktázu“. The Journal of Biological Chemistry. 278 (22): 20069–76. doi:10,1074 / jbc.M300989200. PMID 12626517.
- ^ Ahmad Z, Salim M, Maines MD (březen 2002). „Lidská biliverdin reduktáza je protein vázající DNA podobný leucinovému zipu a funguje při transkripční aktivaci hemoxygenázy-1 oxidačním stresem.“. The Journal of Biological Chemistry. 277 (11): 9226–32. doi:10,1074 / jbc.M108239200. PMID 11773068.
- ^ Bellamacina CR (září 1996). „Nikotinamidový dinukleotidový vazebný motiv: srovnání proteinů vázajících nukleotidy“. FASEB Journal. 10 (11): 1257–69. doi:10.1096 / fasebj.10.11.8836039. PMID 8836039.
- ^ Maines MD, Polevoda BV, Huang TJ, McCoubrey WK (leden 1996). „Lidská biliverdin IXalfa reduktáza je zinek-metaloprotein. Charakterizace purifikovaných a Escherichia coli exprimovaných enzymů“. European Journal of Biochemistry / FEBS. 235 (1–2): 372–81. doi:10.1111 / j.1432-1033.1996.00372.x. PMID 8631357.
- ^ PDB: 1GCU; Kikuchi A, Park SY, Miyatake H, Sun D, Sato M, Yoshida T, Shiro Y (březen 2001). "Krystalová struktura krysí biliverdin reduktázy". Přírodní strukturní biologie. 8 (3): 221–5. doi:10.1038/84955. PMID 11224565. S2CID 42293456.
- ^ Whitby FG, Phillips JD, Hill CP, McCoubrey W, Maines MD (červen 2002). "Krystalová struktura komplexu biliverdin IXalpha reduktáza enzym-kofaktor". Journal of Molecular Biology. 319 (5): 1199–210. doi:10.1016 / S0022-2836 (02) 00383-2. PMID 12079357.
- ^ Kravets A, Hu Z, Miralem T, Torno MD, Maines MD (květen 2004). „Biliverdin reduktáza, nový regulátor pro indukci aktivačního transkripčního faktoru-2 a hemoxygenázy-1“. The Journal of Biological Chemistry. 279 (19): 19916–23. doi:10,1074 / jbc.M314251200. PMID 14988408.
- ^ Bosma PJ, Seppen J, Goldhoorn B, Bakker C, Oude Elferink RP, Chowdhury JR, Chowdhury NR, Jansen PL (červenec 1994). „Bilirubin UDP-glukuronosyltransferáza 1 je u člověka jedinou relevantní bilirubinovou glukuronidační izoformou“. The Journal of Biological Chemistry. 269 (27): 17960–4. PMID 8027054.
- ^ McDonagh AF, Palma LA, Schmid R (leden 1981). "Snížení biliverdinu a placentární přenos bilirubinu a biliverdinu u březích morčat". The Biochemical Journal. 194 (1): 273–82. doi:10.1042 / bj1940273. PMC 1162741. PMID 7305981.
- ^ Florczyk UM, Jozkowicz A, Dulak J (leden – únor 2008). „Biliverdin reduktáza: nové vlastnosti starého enzymu a jeho potenciální terapeutický význam“. Farmakologické zprávy. 60 (1): 38–48. PMC 5536200. PMID 18276984.
- ^ Kapitulnik J, MD Maines (březen 2009). „Pleiotropní funkce biliverdin reduktázy: buněčná signalizace a tvorba cytoprotektivního a cytotoxického bilirubinu“. Trendy ve farmakologických vědách. 30 (3): 129–37. doi:10.1016 / j.tips.2008.12.003. PMID 19217170.
- ^ Maghzal GJ, Leck MC, Collinson E, Li C, Stocker R (říjen 2009). „Omezená role pro redox amplifikační cyklus bilirubin-biliverdin v buněčné antioxidační ochraně biliverdin reduktázou“. The Journal of Biological Chemistry. 284 (43): 29251–9. doi:10.1074 / jbc.M109.037119. PMC 2785555. PMID 19690164.
- ^ Liu Y, Li P, Lu J, Xiong W, Oger J, Tetzlaff W, Cynader M (srpen 2008). „Bilirubin má silnou imunomodulační aktivitu a potlačuje experimentální autoimunitní encefalomyelitidu“. Journal of Immunology. 181 (3): 1887–97. doi:10,4049 / jimmunol.181.3.1887. PMID 18641326.
- ^ Baranano DE, Rao M, Ferris CD, Snyder SH (prosinec 2002). „Biliverdin reduktáza: hlavní fyziologický cytoprotektant“. Sborník Národní akademie věd Spojených států amerických. 99 (25): 16093–8. Bibcode:2002PNAS ... 9916093B. doi:10.1073 / pnas.252626999. PMC 138570. PMID 12456881.
- ^ Sedlak TW, Snyder SH (červen 2004). „Výhody bilirubinu: ochrana buněk antioxidačním cyklem biliverdin reduktázy“. Pediatrie. 113 (6): 1776–82. doi:10,1542 / peds.113.6.1776. PMID 15173506.
externí odkazy
- biliverdin + reduktáza v americké národní lékařské knihovně Lékařské předměty (Pletivo)
