Mravenčan amonný - Ammonium formate
 | |
 | |
| Jména | |
|---|---|
| Název IUPAC Mravenčan amonný | |
| Identifikátory | |
3D model (JSmol ) | |
| ChemSpider | |
| Informační karta ECHA | 100.007.959 |
PubChem CID | |
| Číslo RTECS |
|
| UNII | |
Řídicí panel CompTox (EPA) | |
| |
| |
| Vlastnosti | |
| CH5NÓ2 | |
| Molární hmotnost | 63.056 g · mol−1 |
| Vzhled | Bílé monoklinické krystaly, rozmělněný |
| Zápach | Mírně čpavkové |
| Hustota | 1,26 g / cm3[1] |
| Bod tání | 116 ° C (241 ° F; 389 K) |
| Bod varu | 180 ° C (356 ° F; 453 K) rozkládá se[2] |
| (gramy na 100 g vody) 102 g (0 ° C) 142,7 g (20 ° C) 202,4 g (40 ° C) 516 g (80 ° C)[2] | |
| Rozpustnost v jiných rozpouštědlech | Rozpustný v kapalině amoniak, alkohol, diethylether[2] |
| Termochemie | |
Std entalpie of formace (ΔFH⦵298) | -556,18 kJ / mol |
| Nebezpečí | |
| Bezpečnostní list | Bezpečnostní list JT Baker |
| Piktogramy GHS |  [1] [1] |
| Signální slovo GHS | Varování |
| H315, H319, H335[1] | |
| P261, P305 + 351 + 338[1] | |
| NFPA 704 (ohnivý diamant) | |
| Smrtelná dávka nebo koncentrace (LD, LC): | |
LD50 (střední dávka ) | 410 mg / kg (myši, intravenózně)[2] |
Pokud není uvedeno jinak, jsou uvedeny údaje o materiálech v nich standardní stav (při 25 ° C [77 ° F], 100 kPa). | |
| Reference Infoboxu | |
Mravenčan amonný, NH4HCO2, je amonný sůl z kyselina mravenčí. Je to bezbarvý, hygroskopický, krystalický pevný.
Redukční aminace
Aceton lze přeměnit na isopropylamin jak následuje:[Citace je zapotřebí ]
- CH3C (O) CH3 + 2 HCO2− +NH4 → (CH3)2CHNHCHO + 2 H2O + NH3 + CO2
- (CH3)2CHNHCHO + H2O → (CH3)2CHNH2 + HCO2H
Použití
Čistý mravenčan amonný se rozkládá na formamid a voda při zahřátí, což je jeho primární použití v průmyslu. Kyselina mravenčí lze také získat reakcí mravenčanu amonného se zředěnou kyselinou, a protože mravenčan amonný se také vyrábí z kyseliny mravenčí, může sloužit jako způsob skladování kyseliny mravenčí.
Mravenčan amonný lze také použít v palladium na uhlíku (Pd / C) redukce funkčních skupin. V přítomnosti Pd / C se mravenčan amonný rozkládá na vodík, oxid uhličitý, a amoniak. Tento plynný vodík je adsorbován na povrch palladium kov, kde může reagovat s různými funkčními skupinami. Například, alkeny lze snížit na alkany nebo formaldehyd na methanolu. Aktivované jednoduché vazby na heteroatomy lze také nahradit vodíky (hydrogenolýza ).
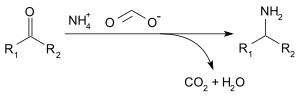
Lze použít formiát amonný redukční aminace z aldehydy a ketony (Leuckartova reakce ), následující reakcí:[3]
Formiát amonný lze použít jako pufr v vysoce účinná kapalinová chromatografie (HPLC), a je vhodný pro použití s kapalinová chromatografie - hmotnostní spektrometrie (LC / MS). The pK.A hodnoty kyseliny mravenčí jsou 3,8 a amonného iontu 9,2.
Reakce
Při zahřátí mravenčan amonný vylučuje vodu a tvoří se formamid. Při dalším zahřívání se tvoří kyanovodík (HCN) a vodu. Vedlejší reakcí je rozklad formamidu na kysličník uhelnatý (CO) a amoniak.
Reference
- ^ A b C d Sigma-Aldrich Co., Mravenčan amonný. Citováno 2014-06-10.
- ^ A b C d http://chemister.ru/Database/properties-en.php?dbid=1&id=1071
- ^ Alexander, Elliot; Ruth Bowman Wildman (1948). "Studie o mechanismu Leuckartovy reakce". Journal of the American Chemical Society. 70: 1187–1189. doi:10.1021 / ja01183a091.
externí odkazy
![]() Média související s Mravenčan amonný na Wikimedia Commons
Média související s Mravenčan amonný na Wikimedia Commons