Diacetát sodný - Sodium diacetate
 Diacetát sodný | |
| Jména | |
|---|---|
| Název IUPAC Diacetát sodný | |
| Ostatní jména Diacetát sodný (bezvodý); Hydrogen-octan sodný; Octan sodný | |
| Identifikátory | |
3D model (JSmol ) | |
| ChemSpider | |
| Informační karta ECHA | 100.004.378 |
| Pletivo | diacetát sodný diacetát |
PubChem CID | |
| UNII | |
Řídicí panel CompTox (EPA) | |
| |
| |
| Vlastnosti | |
| C4H7NaÓ4 | |
| Molární hmotnost | 142.086 g · mol−1 |
| Vzhled | bílý prášek |
| Zápach | Vůně kyseliny octové (octa) |
| 1 g / ml | |
| Rozpustnost v alkoholu | Mírně |
| Rozpustnost v éter | Nerozpustný |
| Nebezpečí | |
| Bezpečnostní list | PubChem sodný diacetát LCSS |
| Piktogramy GHS |   [1] [1] |
| Signální slovo GHS | Nebezpečí |
| H318, H319[2] | |
| P264, P280, P305 + 351 + 338, P310, P337 + 313[2] | |
| Inhalace nebezpečí | Dráždivý[2] |
| Oko nebezpečí | Dráždivý[2] |
| Bod vzplanutí | > 150 ° C (302 ° F)[2] |
| Smrtelná dávka nebo koncentrace (LD, LC): | |
LD50 (střední dávka ) | > 2 000 mg / kg (potkan, dermálně), 5 600 mg / kg (potkan, orálně) |
Pokud není uvedeno jinak, jsou uvedeny údaje o materiálech v nich standardní stav (při 25 ° C [77 ° F], 100 kPa). | |
| Reference Infoboxu | |
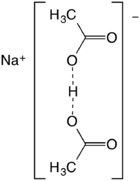
Diacetát sodný je sloučenina se vzorcem NaH (C
2H
3Ó
2)
2. Je to sůl z octová kyselina. Je to bezbarvá pevná látka, která se používá v kořeních a jako antimikrobiální látka.
Příprava a struktura
Sůl se tvoří po poloviněneutralizace kyseliny octové s následným odpařením roztoku. Lze jej zobrazit jako výsledek homoassociace, účinek, který zvyšuje kyselost octová kyselina v koncentrovaném roztoku:
- 2 CH3CO2H + NaOH → Na+[(CH3CO2)2H]− + H2Ó
Také popisován jako sodík kyselá sůl kyseliny octové je nejlépe popsat jako sodnou sůl kyseliny octové vodíkově vázané anion (CH3CO2)2H−. Vzdálenost O ··· O je asi 2,47 angstrom.[3] Tento druh nemá v řešení žádnou významnou existenci, ale je stabilní krystaly.
Aplikace
Jako přísada do potravin[4] má to Číslo E. E262 a používá se k dodání soli a octové příchuti.
Viz také
Reference
- ^ PubChem. „Diacetát sodný“. PubChem. Citováno 2019-10-24.
- ^ A b C d E PubChem. „Diacetát sodný“. PubChem. Citováno 2019-10-24.
- ^ Barrow, Michael J .; Currie, Murdoch; Muir, Kenneth W .; Speakman, J. Clare; White, David N, J. "Krystalové struktury některých kyselých solí monobázických kyselin. XVII. Struktura hydrogen-diacetátu sodného, znovu stanovena neutronovou difrakcí" Journal of the Chemical Society, Perkin Transaction 2: Physical Organic Chemistry 1975, str. 15- 18. doi:10.1039 / P29750000015
- ^ Peter J. Taormina „Důsledky redukce soli a sodíku na bezpečnost mikrobiálních potravin“ v CriticalReviews in Food Science and Nutrition, 2010, sv. 50, 209-227. doi:10.1080/10408391003626207
Acetylhalogenidy a jejich soli acetát ion | |||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| AcOH | On | ||||||||||||||||||
| LiOAc | Být (OAc)2 BeAcOH | B (OAc)3 | AcOAc ROAc | NH4OAc | Ahoj | FAc | Ne | ||||||||||||
| NaOAc | Mg (OAc)2 | Al (OAc)3 ALSOL Al (OAc)2ACH Al2TAK4(OAc)4 | Si | P | S | ClAc | Ar | ||||||||||||
| KOAc | Ca (OAc)2 | Sc (OAc)3 | Ti (OAc)4 | VO (OAc)3 | Cr (OAc)2 Cr (OAc)3 | Mn (OAc)2 Mn (OAc)3 | Fe (OAc)2 Fe (OAc)3 | Co (OAc)2, Co (OAc)3 | Ni (OAc)2 | Cu (OAc)2 | Zn (OAc)2 | Ga (OAc)3 | Ge | Jako (OAc)3 | Se | BrAc | Kr | ||
| RbOAc | Sr (OAc)2 | Y (OAc)3 | Zr (OAc)4 | Pozn | Mo (OAc)2 | Tc | Ru (OAc)2 Ru (OAc)3 Ru (OAc)4 | Rh2(OAc)4 | Pd (OAc)2 | AgOAc | Cd (OAc)2 | v | Sn (OAc)2 Sn (OAc)4 | Sb (OAc)3 | Te | IAc | Xe | ||
| CsOAc | Ba (OAc)2 | Hf | Ta | Ž | Re | Os | Ir | Pt (OAc)2 | Au | Hg2(OAc)2, Hg (OAc)2 | TlOAc Tl (OAc)3 | Pb (OAc)2 Pb (OAc)4 | Bi (OAc)3 | Po | Na | Rn | |||
| Fr. | Ra | Rf | Db | Sg | Bh | Hs | Mt. | Ds | Rg | Cn | Nh | Fl | Mc | Lv | Ts | Og | |||
| ↓ | |||||||||||||||||||
| La (OAc)3 | Ce (OAc)X | Pr | Nd | Odpoledne | Sm (OAc)3 | EU (OAc)3 | Gd (OAc)3 | Tb | Dy (OAc)3 | Ho (OAc)3 | Er | Tm | Yb (OAc)3 | Lu (OAc)3 | |||||
| Ac | Čt | Pa | UO2(OAc)2 | Np | Pu | Dopoledne | Cm | Bk | Srov | Es | Fm | Md | Ne | Lr | |||||
