Neurogenomika - Neurogenomics
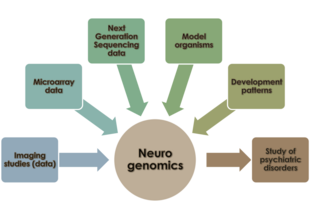
Neurogenomika je studie o tom, jak genom organismu ovlivňuje vývoj a funkci jeho nervové soustavy.[1] Toto pole se chce spojit funkční genomika a neurobiologie abychom pochopili nervový systém jako celek z genomické perspektivy.
Nervový systém u obratlovců je tvořen dvěma hlavními typy buněk - neurogliální buňky a neurony. U lidí existují stovky různých typů neuronů s různými funkcemi - některé zpracovávají vnější podněty; jiné generují reakci na podněty; jiní se organizují v centralizovaných strukturách (mozek, spinální ganglia ), které jsou odpovědné za poznávání, vnímání a regulaci motorických funkcí. Neurony v těchto centralizovaných umístěních mají tendenci se organizovat v obřích sítích a intenzivně spolu komunikovat. Před dostupností pole výrazů a Metodiky sekvenování DNA, vědci se snažili pochopit buněčné chování neuronů (včetně tvorba synapsí a neuronální vývoj a regionalizace v lidském nervovém systému), pokud jde o základní molekulární biologii a biochemii, bez pochopení vlivu genomu neuronu na jeho vývoj a chování. Jak se naše chápání genomu rozšířilo, role sítí genových interakcí při udržování neuronální funkce a chování vzbudila zájem o neurovědy výzkumná komunita. Neurogenomika umožňuje vědcům studovat nervový systém organismů v kontextu těchto základních regulačních a transkripčních sítí. Tento přístup je odlišný od neurogenetika, který při studiu nervového systému zdůrazňuje roli jednotlivých genů bez kontextu interakce se sítí.[2]
Přístupy
Příchod vysoce výkonné biologie
V roce 1999 Cirelli & Tononi[3] nejprve ohlásil asociaci profilování genové exprese mozku v celém genomu (pomocí mikročipy ) s fenotypem chování u myší. Od té doby byla globální data exprese mozkových genů odvozená z mikročipů srovnána s různými lokacemi kvantitativních znaků chování (QTL) a uvedena v několika publikacích.[4][5][6] Přístupy založené na microarray však mají své vlastní problémy, které komplikují analýzu - nasycení sondy může vést k velmi malé měřitelné odchylce genové exprese mezi geneticky jedinečnými jedinci,[7] a přítomnost jednonukleotidových polymorfismů (SNP) může vést k hybridizačním artefaktům.[8][9] Kromě toho mohou mikročipy díky své povaze založené na sondě přijít o mnoho typů přepisů (ncRNA, miRNA, a mRNA izoformy ). Sondy mohou mít také druhově specifické vazebné afinity, které mohou zmást srovnávací analýzu.
Zejména je to souvislost mezi vzorci chování a vysokou pronikavost singl genové loci spadá do kompetence neurogenetika výzkum, ve kterém je cílem identifikovat jednoduchý příčinný vztah mezi jediným genem s vysokou penetrací a pozorovanou funkcí / chováním. Ukázalo se však, že bývá několik neurologických onemocnění polygenní, který je ovlivňován několika různými geny a regulační oblasti místo jednoho genu samotného. Odtud došlo k posunu od přístupů s jedním genem k přístupům k síti pro studium neurologického vývoje a nemocí, k posunu, který byl značně poháněn příchodem sekvenování nové generace metodiky.
Postupy sekvenování nové generace
Studie dvojčat to odhalili schizofrenie,[10] bipolární porucha,[11] poruchou autistického spektra (ASD),[12][13] a porucha pozornosti s hyperaktivitou[14] (ADHD) jsou vysoce dědičné, geneticky složité psychiatrické poruchy. Studie vazeb však do značné míry selhaly při identifikaci příčinných variant psychiatrických poruch, jako jsou tyto, zejména kvůli jejich složité genetické architektuře. Několikanásobná penetrace rizikové varianty mohou být agregovány u postižených jedinců a rodin a sady kauzálních variant se mohou u jednotlivých rodin lišit. Studie v tomto duchu určily a polygenní základ pro několik psychiatrické poruchy.[15] Několik nezávisle se vyskytujících de novo mutace u pacientů Alzheimerova choroba Bylo zjištěno, že narušují sdílenou sadu funkčních drah zapojených například do neuronové signalizace.[16] Snaze porozumět příčinné biologii psychiatrických poruch tedy velmi napomáhá schopnost analyzovat celé genomy postižených a nepostižených jedinců nezaujatým způsobem.[17]
S dostupností masivně paralelní sekvenování nové generace metodologie, vědci byli schopni nahlédnout za zachycení exprimovaných genů pomocí sondy. RNA sekvence například identifikuje o 25-60% více exprimovaných genů než mikročipy. V nadcházející oblasti neurogenomiky se doufá, že pochopením genomických profilů různých částí mozku bychom mohli zlepšit naše chápání toho, jak interakce mezi geny a cestami ovlivňují buněčnou funkci a vývoj. Očekává se, že tento přístup bude schopen identifikovat sekundární genové sítě, které jsou narušeny při neurologických poruchách, a následně napomáhat lákadlům při vývoji léků pro onemocnění mozku.[18] The Iniciativa BRAIN zahájená v roce 2013 se například snaží „informovat o vývoji budoucích způsobů léčby poruch mozku, včetně Alzheimerovy choroby, epilepsie a traumatického poranění mozku" .
Vzácné varianty asociačních studií (RVAS) zdůraznily roli de novo mutace v několika kongenitální a poruchy v raném dětství jako autismus.[19][20] Několik z těchto mutací narušujících bílkoviny bylo možné identifikovat pouze pomocí sekvenování celého genomu úsilí a ověřeno pomocí RNA-sekv. Navíc tyto mutace nejsou statisticky obohaceny v jednotlivých genech, ale spíše vykazují vzorce statistického obohacení ve skupinách genů spojených se sítěmi regulujícími neurologický vývoj a údržbu. Takový objev by byl nemožný s předchozími přístupy zaměřenými na gen (neurogenetika, behaviorální neurovědy ). Neurogenomika umožňuje vysoce výkonný systémový přístup k pochopení polygenní na základě neuropsychiatrické poruchy.[17]
Zobrazovací studie a optické mapování
Když autismus byla identifikována jako zřetelná biologická porucha v 80. letech, vědci zjistili, že autističtí jedinci vykazovali v mozku abnormality růstu mozku mozeček v jejich raných vývojových letech.[21] Následující výzkum ukázal, že 90% autistických dětí má ve věku od 2 do 4 let větší objem mozku než jejich vrstevníci a vykazuje rozšíření obsahu bílé a šedé hmoty v mozek.[22] Bílá a šedá hmota v mozku je spojena s učením a poznáváním a tvorbou amyloidové plaky v bílé hmotě byla spojena s Alzheimerova choroba. Tato zjištění zdůraznila vliv strukturní odchylky v mozku na psychiatrické poruchy a motivovala použití zobrazovacích technologií k mapování oblastí divergence mezi zdravými a nemocnými mozky. Kromě toho, i když nemusí být vždy možné získat biologické vzorky z různých oblastí, živé lidské mozky, neuroimaging techniky nabízejí neinvazivní prostředky k pochopení biologického základu neurologických poruch. Doufáme, že porozumění lokalizačním vzorům různých psychiatrických onemocnění by zase mohlo poskytnout informace o studiích síťové analýzy v neurogenomice.
MRI
Zobrazování strukturální magnetickou rezonancí (MRI) lze použít k identifikaci strukturního složení mozku. Zejména v souvislosti s neurogenomikou hrálo MRI při studiu rozsáhlou roli Alzheimerova choroba (AD) za poslední čtyři desetiletí. To bylo původně používáno k vyloučení jiných příčin demence,[16] ale nedávné studie naznačily přítomnost charakteristických změn u pacientů s AD. Výsledkem je, že MRI skeny se v současné době používají jako neuroimagingový nástroj k identifikaci časové a prostorové patofyziologie Alzheimerovy choroby, jako jsou specifické mozkové změny a amyloidové zobrazování.[16]
Snadnost a neinvazivní povaha MRI skenů motivovala výzkumné projekty, které sledují vývoj a nástup psychiatrických onemocnění v mozku. Alzheimerova choroba se stala klíčovým kandidátem v tomto topografickém přístupu k psychiatrickým onemocněním. Například MRI skeny se v současné době používají ke sledování klidových a na úlohách závislých funkčních profilů mozků u dětí s autozomálně dominantní Alzheimerovou chorobou.[23] Tyto studie zjistily náznaky časných nástupů změn mozku u rizikových jedinců s AD.[16] Centrum excelence pro autismus na Kalifornské univerzitě v San Diegu také provádí studie MRI u dětí ve věku od 12 do 42 měsíců v naději, že charakterizuje abnormality vývoje mozku u dětí, které vykazují příznaky autismu v chování.[24]
Další výzkum ukázal, že existují specifické vzorce atrofie v mozku (jako dopad na neurodegenerace ) u různých neurologických poruch a nemocí. Tyto chorobně specifické vzorce progrese atrofie lze identifikovat pomocí MRI a poskytnout tak neurogenomickému výzkumu klinický kontext fenotypu. Časové informace o progresi onemocnění poskytované tímto přístupem mohou také potenciálně informovat o interpretaci poruch na úrovni genové sítě u psychiatrických onemocnění.[16]
Optické mapování
Jedním z neúnosných rysů metod generování sekvenování druhé generace je horní hranice genomového rozsahu přístupného pro párování. Optické mapování je rozvíjející se metodika používaná k překlenutí rozsáhlých variant, které obvykle nelze detekovat pomocí spárovaných koncových čtení. Tento přístup byl úspěšně použit k detekci strukturální varianty v oligodendroglioma, druh rakoviny mozku.[25] Nedávná práce také zdůraznila univerzálnost optických map při zlepšování existujících genomových sestav. Chromozomální přesmyky, mikrodelece a ve velkém měřítku translokace byly spojeny se zhoršenými neurologickými a kognitivní funkce, například v dědičnosti neuropatie a neurofibromatóza. Optické mapování může významně zlepšit detekci variant a informovat síťové modely genové interakce pro nemocný stav u neurologických poruch.
Studium dalších onemocnění mozku
Kromě neurologických poruch existují i další nemoci, které se projevují v mozku a vytvořily vzorové scénáře případu použití aplikace zobrazování mozku v síťové analýze. V klasickém příkladu zobrazovacích a genomových analýz srovnávala výzkumná studie v roce 2012 MRI skeny a profily genové exprese 104 pacientů s gliomem, aby bylo možné rozlišit výsledky léčby a identifikovat nové cílené genomové dráhy v Glioblastoma Multiforme (GBM). Vědci našli dvě odlišné skupiny pacientů s výrazně odlišnou organizací bílá hmota (invazivní vs. neinvazivní). Následná analýza dat genové exprese naznačila mitochondriální dysfunkci jako hlavní kanonickou cestu v agresivním GBM fenotypu s nízkou úmrtností.[26]
Rozšíření přístupů zobrazování mozku k dalším nemocem může být použito k vyloučení jiných zdravotních onemocnění při diagnostice psychiatrických poruch, ale nemůže být použito k informování o přítomnosti nebo nepřítomnosti psychiatrické poruchy.
Výzkum vývojových modelů
U lidí
Současné přístupy ke shromažďování údajů o genové expresi v lidských mozcích je třeba použít buď mikročipy nebo RNA sekvence. V současné době je vzácné shromažďovat „živou“ mozkovou tkáň - pouze v případě, že léčba zahrnuje chirurgický zákrok na mozku, existuje možnost, že se mozková tkáň během postupu odebere. To je případ epilepsie.
V současné době se data genové exprese obvykle shromažďují na mozcích po smrti, což je často překážkou výzkumu neurogenomiky u lidí.[27][28] Po smrti je doba mezi smrtí a sběrem dat z mozku po smrti známá jako post mortem interval (PMI). Vzhledem k tomu, že se RNA po smrti degraduje, je nový mozek optimální - ale ne vždy k dispozici. To zase může ovlivnit řadu následných analýz. Při práci je třeba vzít v úvahu následující faktory „Omics data shromážděné z mozků post mortem:
- V ideálním případě by měl být lidský mozek kontrolován na PMI pro danou studii.[29][30]
- Příčina smrti je také důležitou proměnnou, kterou je třeba vzít v úvahu při odběru vzorků lidského mozku pro účely výzkumu neurogenomiky. Například vzorky mozku jedinců s klinickým nálezem Deprese jsou často shromažďovány po sebevraždě. Určité podmínky úmrtí, jako je předávkování drogami nebo střelné střely způsobené samy sebou, ovlivní expresi mozku.
- Dalším problémem při studiu genové exprese v mozku je buněčná heterogenita vzorků mozkové tkáně. Objemové vzorky mozku se mohou případ od případu lišit v poměru specifických populací buněk. To může ovlivnit podpisy genové exprese a může významně změnit diferenciální analýzu exprese.
- Jedním z přístupů k řešení tohoto problému je použití jednobuněčná RNA sekv. To by řídilo konkrétní typ buňky. Toto řešení je však použitelné pouze tam, kde studie nejsou specifické pro buněčný typ.[31]
Diferenciální diagnostika také zůstává kritickým předanalytickým zmatkem celoskupinových studií neurologických poruch spektra. Konkrétně to bylo poznamenáno jako problém s kromulantem u studií Alzheimerovy choroby a poruch autistického spektra. Jak se dále zlepšuje naše chápání různých symptomů a genomových základů různých neurogenomických poruch, samotná diagnostická kritéria procházejí přesmyky a kontrolou.[32]
Zvířecí modely
Probíhající genomický výzkum neurologických poruch má tendenci využívat zvířecí modely (a odpovídající genové homology ) porozumět síťovým interakcím, které jsou základem konkrétní poruchy v důsledku etických problémů souvisejících s získáváním biologických vzorků ze živých lidských mozků. I to není bez překážek.
Neurogenomický výzkum s modelovým organismem je podmíněn dostupností plně sekvenovaného a anotovaného referenčního genomu. Navíc profily RNA (miRNA, ncRNA, mRNA ) modelového organismu musí být dobře katalogizovány a všechny závěry z nich aplikované na člověka musí mít základ ve funkčním / pořadí homologie.[33]
Zebrafish
Zebrafish vývoj se opírá o genové sítě, které jsou mezi všemi vysoce konzervované obratlovců.[34] Navíc s extrémně dobře anotovanou sadou 12 000 genů a 1 000 mutantů raného vývoje, které jsou skutečně viditelné v opticky čistých embryích a larvách zebrafish, nabízí zebrafish propracovaný systém pro mutageneze a zobrazování rozvojových patologií v reálném čase. Tento model raného vývoje byl použit ke studiu nervového systému při buněčném rozlišení.[35][36] Zebrafish modelový systém již byl použit ke studiu neuroregenerace[37] a těžké polygenní lidské nemoci jako rakovina a srdeční choroby.[38] Bylo izolováno několik mutantů zebrafish s variacemi chování v reakci na dávku kokainu a alkoholu a mohou také tvořit základ pro studium patogeneze poruch chování.[39][40]
Hlodavec
Modely hlodavců byly při studiu lidských poruch přední. Tyto modely byly značně anotovány genovými homology několika monogenní poruchy u lidí. Vyřazovací studie těchto homologů vedlo k rozšíření našeho chápání síťových interakcí genů v lidských tkáních. Například FMR1 Gen byl zapleten do autismu z řady síťových studií.[41][42] Vyřazení pomocí FMR1 u myší vytváří model pro Syndrom křehkého X, jedna z poruch v Spektrum autismu.[43]
Myši xenoštěpy jsou zvláště užitečné pro objevování drog,[44] a byly nesmírně důležité při objevování brzy antipsychotický léky. V posledních několika letech se také zlepšil vývoj zvířecích modelů pro komplexní psychiatrická onemocnění. Modely hlodavců prokázaly změny fenotypu chování připomínající pozitivní schizofrenie stavu, buď po genetické manipulaci, nebo po léčbě léky, které cílí na oblasti mozku, u nichž existuje podezření, že ovlivňují hyperaktivitu nebo neurovývoj.[45] Vzbudil zájem o identifikaci narušení sítě zprostředkovaných těmito laboratorními manipulacemi a sběr genomových dat z studie na hlodavcích významně přispěla k lepšímu pochopení genomiky psychiatrických onemocnění.
První myší mozek přepis byl vygenerován v roce 2008.[46] Od té doby byla s budováním provedena rozsáhlá práce sociální stres myší modely ke studiu signatur exprese různých psychiatrických onemocnění na úrovni dráhy. Nedávný dokument simuloval rysy posttraumatické stresové poruchy (PTSD) u myší a profiloval celý transkriptom těchto myší.[47] Autoři našli diferenciální regulaci v mnoha biologických drahách, z nichž některé se podílely na úzkostných poruchách (hyperaktivita, reakce na strach ), poruchy nálady a poruchy poznávání. Tato zjištění jsou podložena rozsáhlými transkriptomické analýzy Předpokládá se, že úzkostné poruchy a změny úrovně exprese v biologických cestách spojených s učením strachu a pamětí přispívají k projevům chování těchto poruch.[47] Předpokládá se, že funkční obohacení genů zapojených do dlouhodobé synaptické potenciace, deprese a plasticity hraje důležitou roli při získávání, konsolidaci a udržování traumatických vzpomínek, které jsou základem úzkostných poruch.[47][48]
Experimentální myší modely pro psychiatrické poruchy
Běžným přístupem k používání modelu myši je použití experimentální léčby těhotné myši, aby se ovlivnil celý vrh. Klíčovým problémem v této oblasti je však zpracování vrhů ve statistické analýze. Většina studií zvažuje celkový počet vyprodukovaných potomků, protože to může vést ke zvýšení statistické síly. Správným způsobem je však počítat podle počtu vrhů a normalizovat je na základě velikosti vrhu. Bylo zjištěno, že několik studií autismu nesprávně provedlo své statistické analýzy na základě celkového počtu potomků místo počtu vrhů.[49]
Několik úzkostných poruch, jako je posttraumatická stresová porucha (PTSD) zapojit heterogenní změny v několika různých oblastech mozku, jako je hipokampus, amygdala, a nucleus accumbens. Ukázalo se, že buněčné kódování traumatických událostí a behaviorální reakce vyvolané takovými událostmi spočívají primárně ve změnách signálních molekul spojených s synaptický přenos.
Globální profilování genové exprese různých genových oblastí zapojených do zpracování strachu a úzkosti pomocí myších modelů vedlo k identifikaci časově a prostorově odlišných souborů odlišně exprimovaných genů. Analýza dráhy těchto genů naznačila možné role v neurogeneze a behaviorální reakce související s úzkostí, spolu s dalšími funkčními a fenotypovými pozorováními.[47]
Myší modely pro výzkum mozku významně přispěly vývoj léků a zvýšilo naše chápání genomových základů několika neurologických onemocnění v poslední generaci. Chlorpromazin, první antipsychotikum lék (objevený v roce 1951), byl identifikován jako životaschopná možnost léčby poté, co se na obrazovce chování ukázalo, že potlačuje reakci na averzivní podněty u potkanů.
Výzvy
Modelování a hodnocení latentních příznaků (myšlenky, verbální učení, sociální interakce, kognitivní chování) zůstává výzvou při používání modelových organismů ke studiu psychiatrické poruchy se složitou genetikou patologie. Například daný genotyp + fenotyp v myším modelu musí napodobovat genomové základy fenotypu pozorovaného u člověka.
Toto je obzvláště důležitá položka v úvahu u poruch spektra, jako je autismus. Autismus je porucha, jejíž příznaky lze rozdělit do dvou kategorií: (i) deficity sociálních interakcí a (ii) opakující se chování a omezené zájmy. Protože myši mají tendenci být více společenskými tvory mezi všemi členy řádu Rodentia v současné době používané jako modelové organismy se myši obecně používají k co nejpřesnějšímu modelování lidských psychiatrických poruch. Zejména pro autismus jsou v současné době k dispozici následující řešení, která by napodobovala příznaky chování člověka:
- U první diagnostické kategorie narušeného sociálního chování jsou myši podrobeny sociálnímu testu, který má představovat typické autistické sociální deficity. Normální sociální chování pro myši zahrnuje čichání, sledování, fyzický kontakt a allogrooming. Lze použít také hlasovou komunikaci.
- Existuje řada způsobů, jak lze u myší pozorovat druhou diagnostickou kategorii. Mezi příklady opakujícího se chování patří nadměrné kroužení, péče o sebe a nadměrné kopání. Obvykle by tato chování byla prováděna konzistentně během dlouhého měření času (tj. Samočinná péče po dobu 10 minut).[50]
- I když lze snadno pozorovat opakované chování, je obtížné charakterizovat skutečné omezené zájmy myší. Jedním z aspektů omezených zájmů autistických jedinců je „naléhání na stejnost“ - koncept, že autističtí jedinci vyžadují, aby jejich prostředí zůstalo konzistentní. Pokud by se toto prostředí mělo změnit, jedinec by prožíval stres a úzkost. Byl hlášen úspěch při potvrzování myšího modelu autismu změnou prostředí myši.[51]
V kterémkoli z těchto experimentů mají „autistické“ myši „normálního“ socializačního partnera a vědci, kteří pozorují myši, si neuvědomují („slepí“) genotypy myší.
Genová exprese v mozku
Profil genové exprese centrální nervový systém (CNS) je jedinečný. Osmdesát procent všech lidských genů je exprimováno v mozku; 5 000 z těchto genů je exprimováno pouze v CNS. Lidský mozek má nejvyšší míru genové exprese ze všech studovaných savčích mozků. Ve srovnání, tkáně mimo mozek budou mít více podobných úrovní exprese ve srovnání se svými protějšky ze savců. Jedním ze zdrojů zvýšených úrovní exprese v lidském mozku je z oblasti neproteinové kódující oblasti genomu. Četné studie ukázaly, že lidský mozek má vyšší úroveň exprese v regulačních oblastech ve srovnání s jinými mozky savců. Existuje také pozoruhodné obohacení o další alternativní sestřih události v lidském mozku.[2]
Prostorové rozdíly
Profily genové exprese se také liší v konkrétních oblastech mozku. A microarray studie ukázaly, že transkriptomový profil klastrů CNS společně na základě regionu. Jiná studie charakterizovala regulaci genové exprese v 10 různých oblastech na základě jejich eQTL signály.[52] Příčina měnících se profilů výrazů souvisí s funkcí, migrace neuronů a buněčná heterogenita regionu. Dokonce i tři vrstvy mozková kůra mají odlišné profily výrazu.[53]
Studie dokončená na Harvardské lékařské fakultě v roce 2014 dokázala identifikovat vývojové linie vycházející z neuronových mutací jedné báze. Vědci sekvenovali 36 neuronů z mozkové kůry tří normálních jedinců a zjistili, že vysoce exprimované geny a geny spojené s nervy byly významně obohaceny o jeden neuron SNV. Na druhé straně bylo zjištěno, že tyto SNV korelovaly s chromatinovými markery transkripce z mozku plodu.[54]
Vývojové vzorce u lidí
Genová exprese mozku se mění v různých fázích života. Nejvýznamnější úrovně exprese se nacházejí během časného vývoje, přičemž rychlost genové exprese je nejvyšší během vývoje plodu. To je výsledkem rychlého růstu neuronů v embryu. Neurony v této fázi procházejí neuronální diferenciace, proliferace buněk, migrační události a dendritické a synaptický vývoj.[55] Vzory genové exprese se během embryonálního vývoje posunují blíže ke specializovaným funkčním profilům, avšak určité vývojové kroky stále probíhají po porodu. V důsledku toho se profily genové exprese dvou mozkových hemisfér zdají asymetrické při narození. Při narození jsou profily genové exprese mezi nimi asymetrické mozkové hemisféry. Jak vývoj pokračuje, profily genové exprese se stávají mezi hemisférami podobné. U zdravého dospělého zůstávají expresní profily relativně konstantní od konce dvacátých let do konce čtyřicátých let. Od padesátých let dochází k výraznému snížení exprese genů důležitých pro správnou funkci. Navzdory tomu dochází ke zvýšení rozmanitosti genů exprimovaných v mozku. S touto věkovou změnou výrazu lze korelovat Obsah GC. V pozdějších fázích života dochází ke zvýšení indukce klíčových genů s nízkým obsahem GC a také ke zvýšení potlačování klíčových genů s vysokým obsahem GC.[53] Další příčinou posunu v genové diverzitě je akumulace mutací a poškození DNA. Studie genové exprese ukazují, že geny, které akumulují tyto mutace související s věkem, jsou konzistentní mezi jednotlivci ve stárnoucí populaci. Geny, které jsou při vývoji vysoce exprimovány, se významně snižují v pozdních stadiích života, zatímco geny, které jsou při vývoji vysoce potlačovány, se v pozdních stádiích významně zvyšují.[54]
Vývoj mozku savců
Vývoj Homo sapiens protože odchylka od společného předka primátů prokázala výraznou expanzi ve velikosti a složitosti mozku, zejména v mozková kůra.[56][57][58][59] Ve srovnání s primáti, člověk mozková kůra má vyražený povrch, ale liší se jen mírně v tloušťce. Mnoho rozsáhlých studií v porozumění rozdílům lidského mozku od jiných druhů naznačilo rozšíření genových rodin a změny v alternativní sestřih být zodpovědný za důsledek zvýšení kognitivních schopností a kooperativního chování u lidí.[60][61] Musíme však ještě určit přesné fenotypové důsledky všech těchto změn. Jedním z problémů je, že pouze primáti si vyvinuli dělení v mozkové kůře, takže je obtížné napodobit modelování specifických neurologických problémů u člověka. hlodavci.[58][62][63]
Data sekvence se používají k pochopení evolučních genetických změn, které vedly k vývoji lidského CNS. Pak můžeme pochopit, jak se neurologické fenotypy liší mezi druhy. Srovnávací genomika znamená srovnání sekvenčních dat napříč a fylogeneze určit genotypové změny, ke kterým dochází v konkrétních liniích, a pochopit, jak tyto změny mohly vzniknout. Obecně dochází ke zvýšení vysoce kvalitních referenčních sekvencí savců srovnávací analýza lepší, jak se zvyšuje statistická síla. Nárůst počtu druhů v a fylogeneze riskuje přidání zbytečného šumu jako zarovnání ortologický sekvence obvykle snižují kvalitu. Kromě toho různé třídy druhů budou mít významné rozdíly ve svých fenotypech.[64]
Navzdory tomu nám komparativní genomika umožnila propojit genetické změny nalezené ve fylogenezi se specifickými cestami. Abychom to mohli určit, jsou linie testovány na funkční změny, které se časem hromadí. To se často měří jako poměr nesynonymní substituce na synonymní substituce nebo poměr dN / dS (někdy dále zkráceno na ω). Pokud je poměr dN / dS větší než 1, znamená to pozitivní výběr. Poměr dN / dS rovný 1 je důkazem, že neexistují žádné selektivní tlaky. Poměr dN / dS menší než 1 označuje negativní výběr. Například konzervované oblasti genomu budou mít obecně poměr dN / dS menší než 1, protože jakékoli změny těchto pozic budou pravděpodobně škodlivé.[65] Z genů exprimovaných v lidském mozku se odhaduje, že 342 z nich má poměr dN / dS vyšší než 1 v lidské linii ve srovnání s jinými liniemi primátů.[64] To naznačuje pozitivní selekci na lidské linii pro fenotypy mozku. Pochopení významu pozitivní výběr je obecně dalším krokem. Například, ASPM, CDK5RAP2 a NIN jsou geny, které jsou pozitivně vybrány pro lidskou linii a byly přímo korelovány s velikostí mozku. Toto zjištění může pomoci objasnit, proč jsou lidské mozky větší než jiné mozky savců.[65]
Rozdíly v expresi na úrovni sítě mezi druhy
Předpokládá se, že změny genové exprese, které jsou konečnou odpovědí na jakékoli genetické změny, jsou dobrým zástupcem pro porozumění fenotypový rozdíly v biologických vzorcích. Srovnávací studie odhalily řadu rozdílů v EU transkripční kontroly mezi primáti a hlodavci. Například gen CNTNAP2 je specificky obohacen pro prefrontální kůra. Myší homolog CNTNAP2 není exprimován v mozku myši. CNTNAP2 byl zapojen do kognitivních funkcí jazyka stejně jako neurodevelopmentální poruchy například porucha autistického spektra. To naznačuje, že kontrola exprese hraje významnou roli ve vývoji jedinečné kognitivní funkce člověka. V důsledku toho řada studií zkoumala mozkové specifické enhancery. Transkripční faktory jako SOX5 bylo zjištěno, že jsou pozitivně vybrány pro lidskou linii. Studie genové exprese u lidí, šimpanzi a makaků rhesus, identifikovali lidské specifické koexpresní sítě a zvýšení genové exprese v lidské kůře ve srovnání s primáty.[66]
Poruchy
Neurogenomické poruchy se projevují jako neurologické poruchy se složitou genetickou architekturou a non-Mendelian -jako vzor dědičnosti.[18] Některé příklady těchto poruch zahrnují Bipolární porucha a Schizofrenie.[15] Na projevu poruchy se může podílet několik genů a mutace v těchto poruchách jsou obecně vzácné a de novo. Proto je extrémně nepravděpodobné, že u dvou nepříbuzných jedinců postižených stejnou neurogenomickou poruchou bude pozorována stejná (potenciálně příčinná) varianta.[15] Probíhající výzkum zahrnoval několik de novo exonické variace a strukturální variace v Poruchou autistického spektra (ASD), například.[15] The alelické spektrum vzácných a běžných variant u neurogenomických poruch proto vyžaduje potřebu velkých kohortních studií, aby bylo možné účinně vyloučit varianty s nízkým účinkem a identifikovat zastřešující cesty často mutované v různých poruchách, spíše než specifické geny a specifické vysoká penetrace mutace.
Sekvenování celého genomu (WGS) a celé exome sekvenování (WES) byl použit v Studie asociace pro genom (GWAS) charakterizovat genetické varianty spojené s neurogenomickými poruchami. Dopad těchto variant však nelze vždy ověřit kvůli nemendelovským vzorům dědičnosti pozorovaným u několika z těchto poruch.[15] Další překážkou v síťové analýze je nedostatek rozsáhlých datových souborů pro mnoho psychiatrických (neurogenomických) onemocnění. Jelikož několik nemocí s neurogenomickými základy má tendenci mít a polygenní základ, několik nespecifických, vzácných a částečně pronikavých de novo mutace u různých pacientů mohou přispívat ke stejnému pozorovanému rozsahu fenotypů, jako je tomu u poruchy autistického spektra a schizofrenie.[67] Rozsáhlý výzkum v závislost na alkoholu (ALC) rovněž zdůraznila potřebu vysoce kvalitního genomického profilování velkých sad vzorků[68][69] při studiu polygenní, poruchy spektra.
The Projekt 1000 genomů byla úspěšnou ukázkou toho, jak společné úsilí o získání reprezentativních genomických údajů od širokého spektra lidí může vést k identifikaci použitelných biologických poznatků pro různé nemoci.[70] Takováto rozsáhlá iniciativa však stále konkrétně v oblasti neurogenomických poruch chybí.
Modelování psychiatrických poruch ve výzkumu neurogenomiky - problémy
Jeden hlavní GWAS studie identifikovala 13 nových rizikových lokusů pro schizofrenie.[71] Studium dopadu těchto kandidátů by v ideálním případě prokázalo fenotyp schizofrenie na zvířecích modelech, který je obvykle obtížné pozorovat kvůli jeho projevu jako latentní osobnosti. Tento přístup je schopen určit molekulární dopad kandidátský gen. V ideálním případě by kandidátské geny měly neurologický dopad, což by zase naznačovalo, že hraje roli v neurologické poruše. Například ve výše uvedené studii schizofrenie GWAS, Ripke a kolegové[71] určil, že všechny tyto kandidátské geny byly všechny zapojeny do vápníkové signalizace. Alternativně lze studovat tyto varianty na modelových organismech v kontextu ovlivněné neurologické funkce. Je důležité si uvědomit, že vysoká penetrace varianty těchto poruch bývají de novo mutace.
Další komplikací ke studiu neurogenomických poruch je heterogenní podstata poruchy. U mnoha z těchto poruch mutace pozorované případ od případu nezůstávají konzistentní. U autismu může postižený jedinec pociťovat velké množství škodlivých mutací v genu X. Jiný postižený jedinec nemusí mít žádné významné mutace v genu X, ale může mít velké množství mutací v genu Y. Alternativou je určit, zda gen X a gen Y ovlivňují stejnou biochemickou cestu - takovou, která ovlivňuje neurologickou funkci. A bioinformatics network analysis is one approach to this problem. Network analyses methodologies provide a generalized, systems overview of a molecular pathway.
One final complication to consider is the comorbidity of neurogenomic genes. Several disorders, especially at the more severe ends of the spectrum tend to be comorbid with each other. For example, more severe cases of ASD tend to be associated with mentální postižení (ID). This raises the question of whether or not there are true, unique ASD genes and unique ID genes or if there are just genes just associated with neurological function that can be mutated into an abnormal phenotype. One confounding factor may be the actual diagnostic category and methods of the spectrum disorders as symptoms between severe disorders may be similar. One study investigated the comorbid symptoms between groups of ID and ASD, and found no significant difference between the symptoms of ID children, ASD children with ID and ASD children without ID. Future research may help establish a more stringent genetic basis for the diagnoses of these disorders.
Síťová analýza

The main goal of network analysis in neurogenomics is to identify statistically significant nonrandom associations between genes that contain risk variants.[15] While several algorithm implementations of this approach already exist,[72][73] the general steps for network analysis remain the same.
- The analytical process starts out with the identification of a biological network based on experimental validation. To může být gene co-expression network nebo interakce protein-protein (PPI) network. The nodes of the network will be clustered.
- Subsequently, a specific list of genes with known associations to a particular phenotype of interest is generated. This list could be determined by experimental data, agnostic of genetic studies in psychiatric disorders.[15] This is referred to as a 'hit list'.
- Genes that belong to the hit list as well as the biological network selected in the first step are marked as such.
- This is followed by a guilt-by-association (GBA) step. This means that clusters within the biological network that have a significant amount of genes from the hit list are investigated further using functional enrichment tools and database querying for the pathways in which these high scoring cluster genes participate[74]
- Thus the biological associations of the high-scoring, experimentally implicated cluster members are investigated, expanding the search area from beyond the initial hit list to include gene members of additional pathways that may have significant association with the initial biological network under consideration. This results in a set of candidate genes.[15]
The underlying principle of this approach is that the genes that cluster together, will also jointly affect the same molecular pathway. Again, they would ideally be part of a neurological function. The candidate genes can then be used to prioritize variants for wet lab validation.
Neurofarmakologie
Historically, due to the behavioural stimulation manifested as a symptom in several the neurogenomic disorders, the therapies would rely mostly on antipsychotika or antidepressents. These classes of medications would suppress common symptoms of the disorders, but with questionable efficacy. The biggest barrier to neruopharmacogenomic research was the cohort sizes. Given newly available large-cohort sequencing data, there has been a recent push to expand therapeutic options. The heterogenous nature of neurological diseases is the key motivation for personalized medicine approaches to their therapies. It is rare to find single high penetrance causative genes in neurological diseases. The genomic profiles understandably vary between cases, and logically, the therapies would need to vary between cases. Further complicating the issue is that many of these disorders are spectrum disorders. Their genetic etiology will vary within this spectrum. For example, severe ASD is associated with high penetrance de novo mutations. Milder forms of ASD is usually associated with a mixture of common variants.
The key issue then is the translation of these newly identified genetic variants (from Copy Number Variant studies, candidate gene sequencing and high throughput sequencing technologies) into an intervention for patients with neurogenomic disorders. One aspect will be if the neurological disorder are medically actionable (i.e. is there a simple metabolic pathway that a therapy can target). For example, specific cases of ASD have been associated with microdeletions on TMLHE gen. This gene codes for the enzyme of biosyntéza karnitinu. Supplements to elevate carnitine levels appeared to alleviate certain ASD symptoms but the study was confounded by many influencing factors. As mentioned earlier, using a gene network approach will help identify relevant pathways of interest. Many neuropharmacogenomic approaches have focused on targeting the downstream products of these pathways.[75][76]
Krevní mozková bariéra
Studies in animal models for several brain diseases has shown that the hematoencefalická bariéra (BBB) undergoes modification at many levels; for example, the surface glycoprotein composition can influence the types of HIV-1 strains transported by the BBB. The BBB has been found to be key in the onset of Alzheimerova choroba choroba.[77] It is extremely difficult, however, to be able to study this in humans due to obvious restrictions with accessing the brain and retrieving biological specimens for sequencing or morphological analysis. Mice models of the BBB and models of disease states have served well in conceptualizing the BBB as a regulatory interface between disease and good health in the brain.
Personalized neurobiology
The heterogenous nature of neurological diseases is the key motivation for personalized medicine approaches to their therapies.[75] Genomic samples of individual patients could be used to identify predictive factors, or to better understand the specific prognosis of a neurogenomic disease, and use this information to guide treatment options.[78] While there is a clear clinical utility to this approach, the adaptation of this approach is still nonexistent.
There are various issues prohibiting the application of personalized genomics to the assessment, diagnosis, and treatment of psychiatric disorders.
- Firstly, the causative network biology of several spectrum disorders with neurogenomic underpinnings is not fully understood yet, in spite of extensive studies conducted with disorders like Autism Spectrum[12][42] a schizofrenie.[10] Thus, the analytical validity of standing hypotheses concerning the etiology of neurogenomic disorders has still not been fully established and is subject to debate and controversy.
- The clinical validity of genetic variants that have shown to be highly correlated with specific neurogenomic disorders is often a major cause of concern.[78] The interpretation of these test results, and subsequent decision making, are a complicated undertaking given the polygenic nature of many of these disorders. Complicating things further, it has been shown that pre-emptive intervention in major psychiatric disorders does not always reduce the risk for the disorder.[79] Such intervention might not even be available for at-risk offspring of affected adults, thereby limiting the 'medical actionability' of the data.[78]
- Ethical concerns have also been raised regarding the safeguarding of personal genomic information, and how best to approach the burden of incidental findings and family risk assessment.
- Consanguinity and in-breeding can lead to selective enrichment of rare, otherwise low penetrance genetic mutations attributed to various symptoms of neurogenomic disorders. Thus, the interpretation of family-specific genetic mutations and/or network-level disruptions in the onset of a rare psychiatric disorder requires careful consideration of the motivations of participants included in the study.[78]
- That said, these issues can be addressed by effective education and counseling, and collection of genomic data from patients with psychiatric disorders should not be disqualified solely on this basis. The data itself serves as a dynamic health resource and can significantly further our understanding of the genomic basis of several psychiatric disorders.
Viz také
Reference
- ^ Boguski, Mark S.; Jones, Allan R. (2004-05-01). "Neurogenomics: at the intersection of neurobiology and genome sciences". Přírodní neurovědy. 7 (5): 429–433. doi:10.1038/nn1232. ISSN 1097-6256. PMID 15114353.
- ^ A b Jain, Kewal K. (2013-01-01). "Neurogenetics and Neurogenomics". Applications of Biotechnology in Neurology. Humana Press. s. 7–16. doi:10.1007/978-1-62703-272-8_2. ISBN 9781627032711.
- ^ Cirelli, Chiara; Tononi, Giulio (1999). "Differences in gene expression during sleep and wakefulness". Annals of Medicine. 31 (2): 117–124. doi:10.3109/07853899908998787. PMID 10344584.
- ^ Matthews, Douglas B.; Bhave, Sanjiv V.; Belknap, John K.; Brittingham, Cynthia; Chesler, Elissa J.; Hitzemann, Robert J.; Hoffmann, Paula L.; Svůdná žena; McWeeney, Shannon (2005-09-01). "Complex genetics of interactions of alcohol and CNS function and behavior". Alkoholismus, klinický a experimentální výzkum. 29 (9): 1706–1719. doi:10.1097/01.alc.0000179209.44407.df. ISSN 0145-6008. PMID 16205371.
- ^ Hoffman, Paula L.; Miles, Michael; Edenberg, Howard J.; Sommer, Wolfgang; Tabakoff, Boris; Wehner, Jeanne M.; Lewohl, Joanne (2003-02-01). "Gene expression in brain: a window on ethanol dependence, neuroadaptation, and preference". Alkoholismus, klinický a experimentální výzkum. 27 (2): 155–168. doi:10.1097/01.ALC.0000060101.89334.11. ISSN 0145-6008. PMID 12605065.
- ^ Farris, Sean P.; Miles, Michael F. (2012-01-01). "Ethanol modulation of gene networks: implications for alcoholism". Neurobiologie nemocí. 45 (1): 115–121. doi:10.1016/j.nbd.2011.04.013. ISSN 1095-953X. PMC 3158275. PMID 21536129.
- ^ Pozhitkov, Alex E.; Boube, Idrissa; Brouwer, Marius H.; Noble, Peter A. (2010-03-01). "Beyond Affymetrix arrays: expanding the set of known hybridization isotherms and observing pre-wash signal intensities". Výzkum nukleových kyselin. 38 (5): e28. doi:10.1093/nar/gkp1122. ISSN 0305-1048. PMC 2836560. PMID 19969547.
- ^ Walter, Nicole A. R.; McWeeney, Shannon K.; Peters, Sandra T.; Belknap, John K.; Hitzemann, Robert; Buck, Kari J. (2007-09-01). "SNPs matter: impact on detection of differential expression". Přírodní metody. 4 (9): 679–680. doi:10.1038/nmeth0907-679. ISSN 1548-7091. PMC 3410665. PMID 17762873.
- ^ Walter, Nicole A. R.; Bottomly, Daniel; Laderas, Ted; Mooney, Michael A.; Darakjian, Priscila; Searles, Robert P.; Harrington, Christina A.; McWeeney, Shannon K.; Hitzemann, Robert (2009-01-01). "High throughput sequencing in mice: a platform comparison identifies a preponderance of cryptic SNPs". BMC Genomics. 10: 379. doi:10.1186/1471-2164-10-379. ISSN 1471-2164. PMC 2743714. PMID 19686600.
- ^ A b Sullivan PF; Kendler KS; Neale MC (2003-12-01). "Schizophrenia as a complex trait: Evidence from a meta-analysis of twin studies". Archiv obecné psychiatrie. 60 (12): 1187–1192. doi:10.1001/archpsyc.60.12.1187. ISSN 0003-990X. PMID 14662550.
- ^ Smoller, Jordan W .; Finn, Christine T. (2003-11-15). "Family, twin, and adoption studies of bipolar disorder". American Journal of Medical Genetics Part C. 123C (1): 48–58. CiteSeerX 10.1.1.456.6790. doi:10.1002/ajmg.c.20013. ISSN 1552-4868. PMID 14601036.
- ^ A b Rosenberg, Rebecca E.; Law, J. Kiely; Yenokyan, Gayane; McGready, John; Kaufmann, Walter E.; Law, Paul A. (2009-10-01). "Characteristics and concordance of autism spectrum disorders among 277 twin pairs". Archivy pediatrie a adolescentní medicíny. 163 (10): 907–914. doi:10.1001/archpediatrics.2009.98. ISSN 1538-3628. PMID 19805709.
- ^ Frazier, Thomas W .; Thompson, Lee; Youngstrom, Eric A .; Law, Paul; Hardan, Antonio Y.; Eng, Charis; Morris, Nathan (2014-08-01). "A twin study of heritable and shared environmental contributions to autism". Journal of Autism and Developmental Disorders. 44 (8): 2013–2025. doi:10.1007/s10803-014-2081-2. ISSN 1573-3432. PMC 4104233. PMID 24604525.
- ^ Boomsma, Dorret; Busjahn, Andreas; Peltonen, Leena (2002-11-01). "Classical twin studies and beyond" (PDF). Genetika hodnocení přírody. 3 (11): 872–882. doi:10.1038/nrg932. ISSN 1471-0056. PMID 12415317.
- ^ A b C d E F G h Sullivan, Patrick F.; Daly, Mark J .; O'Donovan, Michael (2012-08-01). "Genetic architectures of psychiatric disorders: the emerging picture and its implications". Genetika hodnocení přírody. 13 (8): 537–551. doi:10.1038/nrg3240. ISSN 1471-0056. PMC 4110909. PMID 22777127.
- ^ A b C d E Johnson, Keith A.; Fox, Nick C .; Sperling, Reisa A.; Klunk, William E. (2012-04-01). "Brain Imaging in Alzheimer Disease". Perspektivy Cold Spring Harbor v medicíně. 2 (4): a006213. doi:10.1101/cshperspect.a006213. ISSN 2157-1422. PMC 3312396. PMID 22474610.
- ^ A b McCarroll, Steven A.; Feng, Guoping; Hyman, Steven E. (2014-06-01). "Genome-scale neurogenetics: methodology and meaning". Přírodní neurovědy. 17 (6): 756–763. doi:10.1038/nn.3716. ISSN 1546-1726. PMC 4912829. PMID 24866041.
- ^ A b "Opinion: The Present and Future of Neurogenomics | The Scientist Magazine®". Vědec. Citováno 2016-02-23.
- ^ Malhotra, Dheeraj; Sebat, Jonathan (2012-03-16). "CNVs: harbingers of a rare variant revolution in psychiatric genetics". Buňka. 148 (6): 1223–1241. doi:10.1016/j.cell.2012.02.039. ISSN 1097-4172. PMC 3351385. PMID 22424231.
- ^ McClellan, Jon; King, Mary-Claire (2010-06-23). "Genomic analysis of mental illness: a changing landscape". JAMA. 303 (24): 2523–2524. doi:10.1001/jama.2010.869. ISSN 1538-3598. PMID 20571020.
- ^ Courchesne, E.; Yeung-Courchesne, R.; Press, G. A.; Hesselink, J. R.; Jernigan, T. L. (1988-05-26). "Hypoplasia of cerebellar vermal lobules VI and VII in autism". The New England Journal of Medicine. 318 (21): 1349–1354. doi:10.1056/NEJM198805263182102. ISSN 0028-4793. PMID 3367935.
- ^ Courchesne, E.; Karns, C. M.; Davis, H. R.; Ziccardi, R.; Carper, R. A.; Tigue, Z. D.; Chisum, H. J.; Moses, P.; Pierce, K. (2001-07-24). "Unusual brain growth patterns in early life in patients with autistic disorder: an MRI study". Neurologie. 57 (2): 245–254. doi:10.1212/wnl.57.2.245. ISSN 0028-3878. PMID 11468308.
- ^ Quiroz, Yakeel T.; Schultz, Aaron P.; Chen, Kewei; Protas, Hillary D.; Brickhouse, Michael; Fleisher, Adam S.; Langbaum, Jessica B.; Thiyyagura, Pradeep; Fagan, Anne M. (2015-08-01). "Brain Imaging and Blood Biomarker Abnormalities in Children With Autosomal Dominant Alzheimer Disease: A Cross-Sectional Study". JAMA Neurology. 72 (8): 912–919. doi:10.1001/jamaneurol.2015.1099. ISSN 2168-6157. PMC 4625544. PMID 26121081.
- ^ "UC San Diego Autism Center of Excellence". autism-center.ucsd.edu. Citováno 2016-02-24.
- ^ Ray, Mohana; Goldstein, Steve; Zhou, Shiguo; Potamousis, Konstantinos; Sarkar, Deepayan; Newton, Michael A; Esterberg, Elizabeth; Kendziorski, Christina; Bogler, Oliver (2013-07-26). "Discovery of structural alterations in solid tumor oligodendroglioma by single molecule analysis". BMC Genomics. 14 (1): 505. doi:10.1186/1471-2164-14-505. PMC 3727977. PMID 23885787.
- ^ Colen, Rivka R.; Vangel, Mark; Wang, Jixin; Gutman, David A.; Hwang, Scott N.; Wintermark, Max; Jain, Rajan; Jilwan-Nicolas, Manal; Chen, James Y. (2014-01-01). "Imaging genomic mapping of an invasive MRI phenotype predicts patient outcome and metabolic dysfunction: a TCGA glioma phenotype research group project". BMC Medical Genomics. 7: 30. doi:10.1186/1755-8794-7-30. ISSN 1755-8794. PMC 4057583. PMID 24889866.
- ^ Lipska, Barbara K.; Deep-Soboslay, Amy; Weickert, Cynthia Shannon; Hyde, Thomas M.; Martin, Catherine E.; Herman, Mary M.; Kleinman, Joel E. (2006-09-15). "Critical Factors in Gene Expression in Postmortem Human Brain: Focus on Studies in Schizophrenia". Biologická psychiatrie. 60 (6): 650–658. doi:10.1016/j.biopsych.2006.06.019. PMID 16997002.
- ^ Stan, Ana D.; Ghose, Subroto; Gao, Xue-Min; Roberts, Rosalinda C.; Lewis-Amezcua, Kelly; Hatanpaa, Kimmo J.; Tamminga, Carol A. (2006-12-06). "Human postmortem tissue: What quality markers matter?". Výzkum mozku. 1123 (1): 1–11. doi:10.1016/j.brainres.2006.09.025. PMC 1995236. PMID 17045977.
- ^ Duric, Vanja; Banasr, Mounira; Stockmeier, Craig A.; Simen, Arthur A.; Newton, Samuel S.; Overholser, James C.; Jurjus, George J.; Dieter, Lesa; Duman, Ronald S. (2013-02-01). "Altered expression of synapse and glutamate related genes in post-mortem hippocampus of depressed subjects". International Journal of Neuropsychopharmacology. 16 (1): 69–82. doi:10.1017/S1461145712000016. ISSN 1461-1457. PMC 3414647. PMID 22339950.
- ^ Nagy, Corina; Maheu, Marissa; Lopez, Juan Pablo; Vaillancourt, Kathryn; Cruceanu, Cristiana; Gross, Jeffrey A.; Arnovitz, Mitchell; Mechawar, Naguib; Turecki, Gustavo (2015-05-01). "Effects of Postmortem Interval on Biomolecule Integrity in the Brain". Journal of Neuropathology & Experimental Neurology. 74 (5): 459–469. doi:10.1097/NEN.0000000000000190. ISSN 0022-3069. PMID 25868148.
- ^ Darmanis, Spyros; Sloan, Steven A .; Zhang, Ye; Enge, Martin; Caneda, Christine; Shuer, Lawrence M.; Gephart, Melanie G. Hayden; Barres, Ben A .; Quake, Stephen R. (2015-06-09). "A survey of human brain transcriptome diversity at the single cell level". Sborník Národní akademie věd. 112 (23): 7285–7290. doi:10.1073/pnas.1507125112. ISSN 0027-8424. PMC 4466750. PMID 26060301.
- ^ Cicognola, Claudia; Chiasserini, Davide; Parnetti, Lucilla (2015-06-29). "Preanalytical Confounding Factors in the Analysis of Cerebrospinal Fluid Biomarkers for Alzheimer's Disease: The Issue of Diurnal Variation". Hranice v neurologii. 6: 143. doi:10.3389/fneur.2015.00143. ISSN 1664-2295. PMC 4483516. PMID 26175714.
- ^ Rinkwitz, Silke; Mourrain, Philippe; Becker, Thomas S. (2011-02-01). "Zebrafish: an integrative system for neurogenomics and neurosciences". Pokrok v neurobiologii. 93 (2): 231–243. doi:10.1016/j.pneurobio.2010.11.003. ISSN 1873-5118. PMID 21130139.
- ^ Cañestro, Cristian; Postlethwait, John H. (2007-05-15). "Development of a chordate anterior-posterior axis without classical retinoic acid signaling". Vývojová biologie. 305 (2): 522–538. doi:10.1016/j.ydbio.2007.02.032. ISSN 0012-1606. PMID 17397819.
- ^ Tallafuss, Alexandra; Trepman, Alissa; Eisen, Judith S. (2009-12-01). "DeltaA mRNA and protein distribution in the zebrafish nervous system". Dynamika vývoje. 238 (12): 3226–3236. doi:10.1002/dvdy.22136. ISSN 1097-0177. PMC 2882441. PMID 19924821.
- ^ Russek-Blum, Niva; Gutnick, Amos; Nabel-Rosen, Helit; Blechman, Janna; Staudt, Nicole; Dorsky, Richard I.; Houart, Corinne; Levkowitz, Gil (2008-10-01). "Dopaminergic neuronal cluster size is determined during early forebrain patterning". Rozvoj. 135 (20): 3401–3413. doi:10.1242/dev.024232. ISSN 0950-1991. PMC 2692842. PMID 18799544.
- ^ Reimer, Michell M.; Sörensen, Inga; Kuscha, Veronika; Frank, Rebecca E.; Liu, Chong; Becker, Catherina G .; Becker, Thomas (2008-08-20). "Motor neuron regeneration in adult zebrafish". The Journal of Neuroscience. 28 (34): 8510–8516. doi:10.1523/JNEUROSCI.1189-08.2008. ISSN 1529-2401. PMC 6671064. PMID 18716209.
- ^ White, Richard; Rose, Kristin; Zon, Leonard (2013-09-01). "Zebrafish cancer: the state of the art and the path forward". Nature Reviews Cancer. 13 (9): 624–636. doi:10.1038/nrc3589. ISSN 1474-175X. PMC 6040891. PMID 23969693.
- ^ Darland, T.; Dowling, J. E. (2001). "Behavioral screening for cocaine sensitivity in mutagenized zebrafish". Proc. Natl. Acad. Sci. USA. 98 (20): 11691–11696. doi:10.1073/pnas.191380698. PMC 58791. PMID 11553778.
- ^ ; Lockwood, B., Bjerke, S., Kobayashi, K. & Guo, S. "Acute effects of alcohol on larval zebrafish: a genetic system for large-scale screening" Pharmacol. Biochem. Chovat se 2004; 77, 647–654
- ^ Bourgeron, Thomas (2015-09-01). "From the genetic architecture to synaptic plasticity in autism spectrum disorder". Recenze přírody Neurovědy. 16 (9): 551–563. doi:10.1038/nrn3992. ISSN 1471-003X. PMID 26289574.
- ^ A b Just, Marcel Adam; Cherkassky, Vladimir L.; Keller, Timothy A.; Kana, Rajesh K.; Minshew, Nancy J. (2007-04-01). "Functional and Anatomical Cortical Underconnectivity in Autism: Evidence from an fMRI Study of an Executive Function Task and Corpus Callosum Morphometry". Mozková kůra. 17 (4): 951–961. doi:10.1093 / cercor / bhl006. ISSN 1047-3211. PMC 4500121. PMID 16772313.
- ^ Oddi, D.; Crusio, W. E.; D’Amato, F. R.; Pietropaolo, S. (2013-08-15). "Monogenic mouse models of social dysfunction: Implications for autism". Behaviorální výzkum mozku. SI:Neurobiology of Autism. 251: 75–84. doi:10.1016/j.bbr.2013.01.002. PMID 23327738.
- ^ Gould, Stephen E.; Junttila, Melissa R.; de Sauvage, Frederic J. (2015-05-01). "Translational value of mouse models in oncology drug development". Přírodní medicína. 21 (5): 431–439. doi:10.1038/nm.3853. ISSN 1078-8956. PMID 25951530.
- ^ Jones, CA; Watson, DJG; Fone, KCF (2011-10-01). "Animal models of schizophrenia". British Journal of Pharmacology. 164 (4): 1162–1194. doi:10.1111/j.1476-5381.2011.01386.x. ISSN 0007-1188. PMC 3229756. PMID 21449915.
- ^ Mortazavi, Ali; Williams, Brian A.; McCue, Kenneth; Schaeffer, Lorian; Wold, Barbara (2008-07-01). "Mapping and quantifying mammalian transcriptomes by RNA-Seq". Přírodní metody. 5 (7): 621–628. doi:10.1038/nmeth.1226. ISSN 1548-7105. PMID 18516045.
- ^ A b C d Muhie, Seid; Gautam, Aarti; Meyerhoff, James; Chakraborty, Nabarun; Hammamieh, Rasha; Jett, Marti (2015-02-28). "Brain transcriptome profiles in mouse model simulating features of post-traumatic stress disorder". Molecular Brain. 8 (1): 14. doi:10.1186/s13041-015-0104-3. PMC 4359441. PMID 25888136.
- ^ Nutt, David J.; Malizia, Andrea L. (2004-01-01). "Structural and functional brain changes in posttraumatic stress disorder". The Journal of Clinical Psychiatry. 65 Suppl 1: 11–17. ISSN 0160-6689. PMID 14728092.
- ^ Lazic, Stanley E; Essioux, Laurent (2013-03-22). "Improving basic and translational science by accounting for litter-to-litter variation in animal models". BMC Neuroscience. 14: 37. doi:10.1186/1471-2202-14-37. ISSN 1471-2202. PMC 3661356. PMID 23522086.
- ^ Crawley, Jacqueline N. (2012-09-01). "Translational animal models of autism and neurodevelopmental disorders". Dialogy v klinické neurovědě. 14 (3): 293–305. ISSN 1294-8322. PMC 3513683. PMID 23226954.
- ^ Gotham, Katherine; Bishop, Somer L.; Hus, Vanessa; Huerta, Marisela; Lund, Sabata; Buja, Andreas; Krieger, Abba; Lord, Catherine (2013-02-01). "Exploring the Relationship Between Anxiety and Insistence on Sameness in Autism Spectrum Disorders". Výzkum autismu. 6 (1): 33–41. doi:10.1002/aur.1263. ISSN 1939-3806. PMC 4373663. PMID 23258569.
- ^ Ramasamy, Adaikalavan; Trabzuni, Daniah; Guelfi, Sebastian; Varghese, Vibin; Smith, Colin; Walker, Robert; De, Tisham; UK Brain Expression Consortium; North American Brain Expression Consortium (2014-10-01). "Genetic variability in the regulation of gene expression in ten regions of the human brain". Přírodní neurovědy. 17 (10): 1418–1428. doi:10.1038/nn.3801. ISSN 1097-6256. PMC 4208299. PMID 25174004.
- ^ A b Naumova, Oksana Yu.; Lee, Maria; Rychkov, Sergei Yu.; Vlasova, Natalia V.; Grigorenko, Elena L. (2013-01-01). "Gene Expression in the Human Brain: The Current State of the Study of Specificity and Spatiotemporal Dynamics". Vývoj dítěte. 84 (1): 76–88. doi:10.1111/cdev.12014. ISSN 1467-8624. PMC 3557706. PMID 23145569.
- ^ A b Lodato, Michael A.; Woodworth, Mollie B.; Lee, Semin; Evrony, Gilad D.; Mehta, Bhaven K.; Karger, Amir; Lee, Soohyun; Chittenden, Thomas W.; D'Gama, Alissa M. (2015-10-02). "Somatic mutation in single human neurons tracks developmental and transcriptional history". Věda. 350 (6256): 94–98. doi:10.1126/science.aab1785. ISSN 1095-9203. PMC 4664477. PMID 26430121.
- ^ Miller, Jeremy A .; Ding, Song-Lin; Sunkin, Susan M.; Smith, Kimberly A.; Ng, Lydia; Szafer, Aaron; Ebbert, Amanda; Riley, Zackery L.; Royall, Joshua J. (2014-04-10). "Transcriptional landscape of the prenatal human brain". Příroda. 508 (7495): 199–206. doi:10.1038/nature13185. ISSN 0028-0836. PMC 4105188. PMID 24695229.
- ^ Carroll, Sean B. (April 2003). "Genetics and the making of Homo sapiens". Příroda. 422 (6934): 849–857. doi:10.1038/nature01495. PMID 12712196.
- ^ Hill, Robert Sean; Walsh, Christopher A. (2005-09-01). "Molecular insights into human brain evolution". Příroda. 437 (7055): 64–67. doi:10.1038/nature04103. ISSN 1476-4687. PMID 16136130.
- ^ A b Rakic, Pasko (2009-10-01). „Evoluce neokortexu: perspektiva z vývojové biologie“. Recenze přírody Neurovědy. 10 (10): 724–735. doi:10.1038/nrn2719. ISSN 1471-003X. PMC 2913577. PMID 19763105.
- ^ Geschwind, Daniel H.; Rakic, Pasko (2013-10-30). "Cortical evolution: judge the brain by its cover". Neuron. 80 (3): 633–647. doi:10.1016/j.neuron.2013.10.045. ISSN 1097-4199. PMC 3922239. PMID 24183016.
- ^ Calarco, John A.; Xing, Yi; Cáceres, Mario; Calarco, Joseph P.; Xiao, Xinshu; Pan, Qun; Lee, Christopher; Preuss, Todd M.; Blencowe, Benjamin J. (2007-11-15). "Global analysis of alternative splicing differences between humans and chimpanzees". Geny a vývoj. 21 (22): 2963–2975. doi:10.1101/gad.1606907. ISSN 0890-9369. PMC 2049197. PMID 17978102.
- ^ Zhang, Xiao-Ou; Yin, Qing-Fei; Wang, Hai-Bin; Zhang, Yang; Chen, Tian; Zheng, Ping; Lu, Xuhua; Chen, Ling-Ling; Yang, Li (2014-01-01). "Species-specific alternative splicing leads to unique expression of sno-lncRNAs". BMC Genomics. 15: 287. doi:10.1186/1471-2164-15-287. ISSN 1471-2164. PMC 4234469. PMID 24734784.
- ^ Somel, Mehmet; Liu, Xiling; Khaitovich, Philipp (2013-02-01). "Human brain evolution: transcripts, metabolites and their regulators". Recenze přírody Neurovědy. 14 (2): 112–127. doi:10.1038/nrn3372. ISSN 1471-003X. PMID 23324662.
- ^ Qureshi, Irfan A.; Mehler, Mark F. (2012-08-01). "Emerging roles of non-coding RNAs in brain evolution, development, plasticity and disease". Recenze přírody Neurovědy. 13 (8): 528–541. doi:10.1038/nrn3234. ISSN 1471-003X. PMC 3478095. PMID 22814587.
- ^ A b Geschwind, Daniel H.; Rakic, Pasko (2013-10-30). "Cortical Evolution: Judge the Brain by Its Cover". Neuron. 80 (3): 633–647. doi:10.1016/j.neuron.2013.10.045. ISSN 0896-6273. PMC 3922239. PMID 24183016.
- ^ A b Enard, Wolfgang (2014-01-01). "Comparative genomics of brain size evolution". Frontiers in Human Neuroscience. 8: 345. doi:10.3389/fnhum.2014.00345. PMC 4033227. PMID 24904382.
- ^ Wang, Guang-Zhong; Konopka, Genevieve (2013-06-01). "Decoding human gene expression signatures in the brain". Transkripce. 4 (3): 102–108. doi:10.4161/trns.24885. ISSN 2154-1272. PMC 4042582. PMID 23665540.
- ^ Kirov, G .; Pocklington, A. J.; Holmans, P.; Ivanov, D.; Ikeda, M .; Ruderfer, D.; Moran, J.; Chambert, K.; Toncheva, D. (2012-02-01). "De novo CNV analysis implicates specific abnormalities of postsynaptic signalling complexes in the pathogenesis of schizophrenia". Molekulární psychiatrie. 17 (2): 142–153. doi:10.1038/mp.2011.154. ISSN 1476-5578. PMC 3603134. PMID 22083728.
- ^ Bierut, Laura J.; Agrawal, Arpana; Bucholz, Kathleen K.; Doheny, Kimberly F.; Laurie, Cathy; Pugh, Elizabeth; Fisher, Sherri; Fox, Louis; Howells, William (2010-03-16). "A genome-wide association study of alcohol dependence". Sborník Národní akademie věd. 107 (11): 5082–5087. doi:10.1073/pnas.0911109107. ISSN 0027-8424. PMC 2841942. PMID 20202923.
- ^ Juraeva, Dilafruz; Treutlein, Jens; Scholz, Henrike; Frank, Josef; Degenhardt, Franziska; Cichon, Sven; Ridinger, Monika; Mattheisen, Manuel; Witt, Stephanie H. (2015-01-01). "XRCC5 as a risk gene for alcohol dependence: evidence from a genome-wide gene-set-based analysis and follow-up studies in Drosophila and humans". Neuropsychofarmakologie. 40 (2): 361–371. doi:10.1038/npp.2014.178. ISSN 1740-634X. PMC 4443948. PMID 25035082.
- ^ The 1000 Genomes Project Consortium (2015-10-01). "A global reference for human genetic variation". Příroda. 526 (7571): 68–74. doi:10.1038/nature15393. ISSN 0028-0836. PMC 4750478. PMID 26432245.
- ^ A b Ripke, Stephan; O'Dushlaine, Colm; Chambert, Kimberly; Moran, Jennifer L.; Kähler, Anna K.; Akterin, Susanne; Bergen, Sarah E.; Collins, Ann L.; Crowley, James J. (2013-10-01). "Genome-wide association analysis identifies 13 new risk loci for schizophrenia". Genetika přírody. 45 (10): 1150–1159. doi:10.1038/ng.2742. ISSN 1546-1718. PMC 3827979. PMID 23974872.
- ^ Lee, Phil H.; O'Dushlaine, Colm; Thomas, Brett; Purcell, Shaun M. (2012-07-01). "INRICH: interval-based enrichment analysis for genome-wide association studies". Bioinformatika. 28 (13): 1797–1799. doi:10.1093/bioinformatics/bts191. ISSN 1367-4811. PMC 3381960. PMID 22513993.
- ^ Morris, Andrew P; Voight, Benjamin F; Teslovich, Tanya M; Ferreira, Teresa; Segrè, Ayellet V; Steinthorsdottir, Valgerdur; Strawbridge, Rona J; Khan, Hassan; Grallert, Harald (2012-09-01). "Large-scale association analysis provides insights into the genetic architecture and pathophysiology of type 2 diabetes". Genetika přírody. 44 (9): 981–990. doi:10.1038/ng.2383. ISSN 1061-4036. PMC 3442244. PMID 22885922.
- ^ Gillis, Jesse; Pavlidis, Paul (2012). ""Guilt by Association" Is the Exception Rather Than the Rule in Gene Networks". PLOS výpočetní biologie. 8 (3): e1002444. doi:10.1371/journal.pcbi.1002444. PMC 3315453. PMID 22479173.
- ^ A b McMahon, Francis J.; Insel, Thomas R. (2012-06-07). "Pharmacogenomics and Personalized Medicine in Neuropsychiatry". Neuron. 74 (5): 773–776. doi:10.1016/j.neuron.2012.05.004. PMC 3407812. PMID 22681682.
- ^ Brandler, William M.; Sebat, Jonathan (2015-01-01). "From De Novo Mutations to Personalized Therapeutic Interventions in Autism". Roční přehled medicíny. 66 (1): 487–507. doi:10.1146/annurev-med-091113-024550. PMID 25587659.
- ^ Banks, William A. (2010-10-01). "Mouse models of neurological disorders: a view from the blood-brain barrier". Biochimica et Biophysica Acta (BBA) - Molekulární základ choroby. 1802 (10): 881–888. doi:10.1016/j.bbadis.2009.10.011. ISSN 0006-3002. PMC 2891624. PMID 19879356.
- ^ A b C d Biesecker, Barbara Bowles; Peay, Holly Landrum (2013-08-01). "Genomic sequencing for psychiatric disorders: Promise and challenge". International Journal of Neuropsychopharmacology. 16 (7): 1667–1672. doi:10.1017/S146114571300014X. ISSN 1461-1457. PMC 3703499. PMID 23575420.
- ^ Bunnik, Eline M; Schermer, Maartje HN; Janssens, A Cecile JW (2012-01-19). "The role of disease characteristics in the ethical debate on personal genome testing". BMC Medical Genomics. 5 (1): 4. doi:10.1186/1755-8794-5-4. PMC 3293088. PMID 22260407.

