Ethylendiamin - Ethylenediamine - Wikipedia
 | |||
| |||
| Jména | |||
|---|---|---|---|
| Preferovaný název IUPAC Ethan-1,2-diamin | |||
| Systematický název IUPAC Ethan-1,2-diamin[2] | |||
| Ostatní jména Edamin[1] 1,2-diaminoethan, 'en' když je ligand | |||
| Identifikátory | |||
3D model (JSmol ) | |||
| Zkratky | en | ||
| 605263 | |||
| ChEBI | |||
| ChEMBL | |||
| ChemSpider | |||
| Informační karta ECHA | 100.003.154 | ||
| Číslo ES |
| ||
| 1098 | |||
| KEGG | |||
| Pletivo | ethylendiamin | ||
PubChem CID | |||
| Číslo RTECS |
| ||
| UNII | |||
| UN číslo | 1604 | ||
Řídicí panel CompTox (EPA) | |||
| |||
| |||
| Vlastnosti | |||
| C2H8N2 | |||
| Molární hmotnost | 60.100 g · mol−1 | ||
| Vzhled | Bezbarvá kapalina[3] | ||
| Zápach | Amoniakální[3] | ||
| Hustota | 0,90 g / cm3[3] | ||
| Bod tání | 8 ° C (46 ° F; 281 K)[3] | ||
| Bod varu | 116 ° C (241 ° F; 389 K)[3] | ||
| mísitelný | |||
| log P | −2.057 | ||
| Tlak páry | 1,3 kPa (při 20 ° C) | ||
| 5,8 mol Pa−1 kg−1 | |||
| |||
Index lomu (nD) | 1.4565 | ||
| Termochemie | |||
Tepelná kapacita (C) | 172,59 J K.−1 mol−1 | ||
Std molární entropie (S | 202,42 J K.−1 mol−1 | ||
Std entalpie of formace (ΔFH⦵298) | −63,55–−62,47 kJ mol−1 | ||
Std entalpie of spalování (ΔCH⦵298) | −1,8678–1,8668 MJ mol−1 | ||
| Nebezpečí | |||
| Piktogramy GHS |     | ||
| Signální slovo GHS | Nebezpečí | ||
| H226, H302, H312, H314, H317, H334 | |||
| P261, P280, P305 + 351 + 338, P310 | |||
| NFPA 704 (ohnivý diamant) | |||
| Bod vzplanutí | 34 ° C (93 ° F; 307 K)[3] | ||
| 385 ° C (725 ° F; 658 K)[3] | |||
| Výbušné limity | 2.7–16% | ||
| Smrtelná dávka nebo koncentrace (LD, LC): | |||
LD50 (střední dávka ) | 500 mg / kg (orálně, potkan) 470 mg / kg (orálně, morče) 1160 mg / kg (orálně, potkan)[5] | ||
| NIOSH (Limity expozice USA pro zdraví): | |||
PEL (Dovolený) | PEL 10 ppm (25 mg / m3)[4] | ||
REL (Doporučeno) | PEL 10 ppm (25 mg / m3)[4] | ||
IDLH (Okamžité nebezpečí) | 1000 ppm[4] | ||
| Související sloučeniny | |||
Související alkanaminy | 1,2-diaminopropan, 1,3-diaminopropan | ||
Související sloučeniny | Ethylamin, Ethylendinitramin | ||
Pokud není uvedeno jinak, jsou uvedeny údaje o materiálech v nich standardní stav (při 25 ° C [77 ° F], 100 kPa). | |||
| Reference Infoboxu | |||
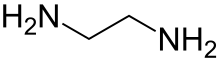
Ethylendiamin (ve zkratce en když ligand ) je organická sloučenina s vzorec C2H4(NH2)2. Tato bezbarvá kapalina s amoniak - podobný zápach je silně základní amin. Jedná se o široce používaný stavební kámen v chemické syntéze s přibližně 500 000 tun vyrobeno v roce 1998.[6] Ethylendiamin snadno reaguje s vlhkostí ve vlhkém vzduchu za vzniku leptavé, toxické a dráždivé mlhy, které může i při krátké expozici způsobit vážné poškození zdraví (viz bezpečnost). Ethylenediamin je prvním členem tzv polyethylenaminy.
Syntéza
Ethylendiamin se průmyslově vyrábí zpracováním 1,2-dichlorethan s amoniak pod tlakem při 180 ° C ve vodném prostředí:[6][7]
V této reakci chlorovodík je generován, který tvoří sůl s aminem. Amin se uvolní přidáním hydroxid sodný a poté je lze obnovit náprava. Diethylenetriamin (DETA) a triethylenetetramin (TETA) se tvoří jako vedlejší produkty.
Další průmyslová cesta k ethylendiaminu zahrnuje reakci ethanolamin a čpavek:[8]
Tento proces zahrnuje průchod plynných reaktantů přes vrstvu niklu heterogenní katalyzátory.
Ethylendiamin lze čistit zpracováním s hydroxidem sodným za účelem odstranění vody a následnou destilací.[9]
Aplikace
Ethylendiamin se používá ve velkém množství k výrobě mnoha průmyslových chemikálií. Tvoří deriváty s karboxylové kyseliny (počítaje v to mastné kyseliny ), nitrily, alkoholy (při zvýšených teplotách), alkylační činidla, sirouhlík, a aldehydy a ketony. Díky své bifunkční povaze, která má dva aminy, snadno tvoří heterocykly, jako je imidazolidiny.
Předchůdce chelatačních činidel, léků a agrochemikálií
Nejvýznamnějším derivátem ethylendiaminu je chelátování činidlo EDTA, který je odvozen od ethylendiaminu prostřednictvím a Streckerova syntéza zahrnující kyanid a formaldehyd. Hydroxyethylethylendiamin je další komerčně významné chelatační činidlo.[6] Řada biologicky aktivních sloučenin a léčiv obsahuje N-CH2-CH2-N propojení, včetně některých antihistaminika.[10] Soli ethylenbisdithiokarbamátu jsou komerčně významné fungicidy pod obchodními názvy Maneb, Mancozeb, Zineb a Metiram. Nějaký imidazolin - fungicidy obsahující fungicidy jsou odvozeny od ethylendiaminu.[6]
Farmaceutická složka
Ethylenediamin je přísada ve společném bronchodilatátor lék aminofylin, kde slouží k solubilizaci účinné látky theofylin. Ethylendiamin se také používá v dermatologických přípravcích, ale z některých byl odstraněn kvůli kontaktní dermatitidě.[11] Při použití jako farmaceutická pomocná látka po perorálním podání biologická dostupnost je asi 0,34, kvůli podstatné efekt prvního průchodu. Méně než 20% je eliminováno ledvin vylučování.[12]
Odvozeno od ethylendiaminu antihistaminika jsou nejstarší z pěti tříd antihistaminika první generace, počínaje piperoxan aka benodain, objeven v roce 1933 na Pasteurově institutu ve Francii a také včetně mepyramin, tripelennamine, a antazolin. Ostatní třídy jsou deriváty ethanolaminu, alkylamin, piperazin a další (zejména tricyklické a tetracyklické sloučeniny související s fenothiaziny, tricyklická antidepresiva, stejně jako cyproheptadin -fenindamin rodina)
Role v polymerech
Ethylendiamin, protože obsahuje dvě aminové skupiny, je široce používaným prekurzorem různých polymerů. Kondenzáty odvozené od formaldehydu jsou změkčovadla. Je široce používán při výrobě polyuretanových vláken. Třída PAMAM dendrimery jsou odvozeny od ethylendiaminu.[6]
Tetraacetylethylendiamin
The bělení aktivátor tetraacetylethylendiamin je generován z ethylendiaminu. Derivát N,N-ethylenebis (stearamid) (EBS) je komerčně významná formauvolňovací prostředek a a povrchově aktivní látka v benzinu a motorovém oleji.
Další aplikace
- jako solventní, to je mísitelný s polárními rozpouštědly a používá se k solubilizaci bílkoviny jako albuminy a kasein. Určitě se také používá galvanické pokovování koupele.
- jako inhibitor koroze v barvách a chladiva.
- ethylendiamin dihydrojodid (EDDI) se přidává do krmiv pro zvířata jako zdroj jodidu.
- chemikálie pro barevná fotografie rozvíjející se, pojiva, lepidla, aviváže, vytvrzování agenti pro epoxidy, a barviva.
- jako sloučenina pro senzibilizaci nitromethan do výbušniny. Tato směs byla použita při Picatinny Arsenal během druhé světové války, což dalo směsi nitromethanu a ethylendiaminu přezdívku PLX nebo Picatinny Liquid Explosive.
Koordinační chemie
Ethylendiamin je dobře známý bidentate chelátování ligand pro koordinační sloučeniny, přičemž dva atomy dusíku darují své osamocené páry elektronů, když ethylendiamin působí jako ligand. V anorganické chemii je často zkrácen „en“. Komplex [Co (ethylendiamin)3]3+ je archetypický chirální komplex tris-chelát. The salen ligandy, z nichž některé se používají při katalýze, jsou odvozeny z kondenzace salicylaldehydy a ethylendiamin.
Související ligandy
Mezi související deriváty ethylendiaminu patří kyselina ethylendiamintetraoctová (EDTA), tetramethylethylendiamin (TMEDA) a tetraethylethylendiamin (TEEDA). Chirál analogy ethylendiamin zahrnují 1,2-diaminopropan a trans-diaminocyklohexan.
Bezpečnost
Ethylendiamin, jako amoniak a další nízkomolekulární aminy, dráždí kůži a dýchací orgány. Pokud není těsně obsažen, kapalný ethylendiamin uvolňuje toxické a dráždivé páry do svého okolí, zejména při zahřívání. Páry reagují s vlhkostí ve vlhkém vzduchu a vytvářejí charakteristickou bílou mlhu, která extrémně dráždí pokožku, oči, plíce a sliznice.
Reference
- ^ „32007R0129“. Evropská unie. 12. února 2007. Příloha II. Citováno 3. května 2012.
- ^ "ethylendiamin - shrnutí sloučeniny". PubChem Compound. USA: Národní centrum pro biotechnologické informace. 16. září 2004. Identifikace a související záznamy. Citováno 3. května 2012.
- ^ A b C d E F G Záznam v databázi látek GESTIS Institut pro bezpečnost a ochranu zdraví při práci
- ^ A b C NIOSH Kapesní průvodce chemickými nebezpečími. "#0269". Národní institut pro bezpečnost a ochranu zdraví při práci (NIOSH).
- ^ "Ethylendiamin". Koncentrace bezprostředně nebezpečné pro život a zdraví (IDLH). Národní institut pro bezpečnost a ochranu zdraví při práci (NIOSH).
- ^ A b C d E Karsten Eller, Erhard Henkes, Roland Rossbacher, Hartmut Höke „Amines, Aliphatic“ v Ullmann's Encyclopedia of Industrial Chemistry, 2005 Wiley-VCH Verlag, Weinheim. doi:10.1002 / 14356007.a02_001
- ^ Hans-Jürgen Arpe, Industrielle Organische Chemie, 6. Auflage (2007), strana 245, Wiley VCH
- ^ Hans-Jürgen Arpe, Industrielle Organische Chemie, 6. Auflage (2007), strana 275, Wiley VCH
- ^ Rollinson, Carl L .; Bailar, Jr., John C. (1946). "Tris (ethylendiamin) chrom (III) soli". Anorganické syntézy. Anorganické syntézy. 2. str. 196–200. doi:10.1002 / 9780470132333.ch60. ISBN 9780470132333.
- ^ Kotti, S. R. S. S .; Timmons, C. & Li, G. (2006). "Vicinal diamino funkční skupiny jako privilegované strukturní prvky v biologicky aktivních sloučeninách a využití jejich syntetické chemie". Chemická biologie a design léčiv. 67 (2): 101–114. doi:10.1111 / j.1747-0285.2006.00347.x. PMID 16492158.
- ^ Hogan DJ (leden 1990). „Alergická kontaktní dermatitida na ethylendiamin. Trvalý problém“. Dermatol Clin. 8 (1): 133–6. doi:10.1016 / S0733-8635 (18) 30536-9. PMID 2137392.
- ^ Zuidema J. (1985-08-23). "Ethylendiamin, profil senzibilizující pomocné látky". Svět lékáren a věda. 7 (4): 134–40. doi:10.1007 / BF02097249. PMID 3900925.
externí odkazy
![]() Média související s Ethylendiamin na Wikimedia Commons
Média související s Ethylendiamin na Wikimedia Commons



