Rossmann fold - Rossmann fold
| Rossmannův sendvičový záhyb alfa / beta / alfa | |
|---|---|
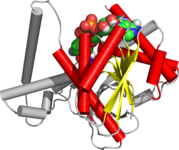
 Vazby NAD / NADP na rossmannovy skládací domény. Obrázek znázorňuje skládání beta-alfa v alkohol dehydrogenáze. | |
| Identifikátory | |
| Symbol | Rossmann-like_a / b / a_fold |
| Pfam klan | CL0039 |
| InterPro | IPR014729 |
The Rossmann fold je terciární záhyb nalezený v bílkoviny které se vážou nukleotidy jako je enzym kofaktory FAD, NAD+, a NADP+. Tento záhyb se skládá ze střídání beta vlákna a alfa šroubovice segmenty, kde jsou beta řetězce vodíkově vázány navzájem a tvoří prodloužený beta list a alfa šroubovice obklopují obě strany listu a vytvářejí třívrstvý sendvič. Klasický Rossmann fold obsahuje šest beta řetězců, zatímco Rossmann-like foldy, někdy označované jako Rossmannoid záhyby, obsahují pouze pět pramenů. Počáteční záhyb beta-alfa-beta (bab) je nejzachovalejším segmentem Rossmannova záhybu.[1] Motiv je pojmenován po Michael Rossmann kdo si nejprve všiml tohoto strukturního motivu v enzymu laktátdehydrogenáza v roce 1970 a který později zjistil, že se jedná o často se vyskytující motiv v proteinech vázajících nukleotidy.[2]
Dějiny
Rossmannův fold byl poprvé popsán Dr. Michael Rossmann a spolupracovníky v roce 1974.[3] Byl prvním, kdo odvodil strukturu laktátdehydrogenázy a charakterizoval strukturní motiv v tomto enzymu, který by se později nazýval Rossmannův záhyb. Následně bylo zjištěno, že většina dehydrogenáz, které využívají NAD nebo NADP, obsahuje stejný strukturně konzervovaný Rossmannův skladací motiv.[3][4]
V roce 1989 Izrael Hanukoglu z Weizmann Institute of Science objevil, že konsensuální sekvence pro NADP+ vazebné místo v některých enzymech, které využívají NADP+ se liší od NAD+ vazba motiv.[5] Tento objev byl použit k novému inženýrství koenzymových specificit enzymů.[6]
Struktura

Rossmann fold se skládá ze šesti paralel beta vlákna které tvoří prodlouženou beta list. První tři prameny jsou spojeny α- šroubovice což má za následek strukturu beta-alfa-beta-alfa-beta. Tento vzor se jednou duplikuje, aby se vytvořila invertovaná tandemová repetice obsahující šest řetězců. Celkově jsou prameny uspořádány v pořadí 321456 (1 = N-terminál, 6 = C-terminál).[7] Pět pletených Rossmannových záhybů je uspořádáno v pořadí 32145.[8] Celková terciární struktura přehybu připomíná třívrstvý sendvič, přičemž náplň je složena z prodlouženého beta plátu a dva plátky chleba jsou tvořeny spojovacími paralelními alfa-šroubovicemi.[1]
Jednou z vlastností Rossmannova skladu je jeho kofaktor závazná specificita. Analýzou čtyř NADH-vázajících enzymů bylo zjištěno, že ve všech čtyřech enzymech nukleotidový kofaktor má stejnou konformaci a orientaci vzhledem k polypeptidovému řetězci.[1]
Přehyb může obsahovat další prameny spojené krátkými šroubovicemi nebo cívkami.[1] Nejzachovalejším segmentem Rossmannových záhybů je první segment beta-alfa-beta. Protože je tento segment v kontaktu s ADP část dinukleotidů, jako je FAD, NAD a NADP nazývá se také jako „skládací beta-beta vázající ADP.
Funkce
Funkce Rossmannovy vazby v enzymech je vázat nukleotidové kofaktory. Často také přispívá k vázání substrátu.
Metabolické enzymy mají obvykle jednu specifickou funkci, a to v případě UDP-glukóza-6-dehydrogenáza, primární funkcí je katalyzovat dvoustupňovou NAD (+) - závislou oxidaci UDP-glukóza do Kyselina UDP-glukuronová.[9] N- a C-terminální domény UgdG sdílejí strukturní rysy se starými mitochondriálními ribonukleázami s názvem MAR. MAR jsou přítomny v nižších eukaryotických mikroorganismech, mají Rossmannoidní složení a patří do nadčeleď isochorismatázy. Toto pozorování posiluje, že Rossmannovy strukturní motivy nalezené v NAD (+) - závislých dehydrogenázách mohou mít dvojí funkci fungující jako vazebná doména nukleotidového kofaktoru a jako ribonukleáza.
Vývoj
Evoluční vztah mezi Rossmannovým záhybem a Rossmannovými záhyby je nejasný. Tyto záhyby se označují jako Rossmannoids. Předpokládala se hypotéza, že všechny tyto záhyby, včetně Rossmannova záhybu, pocházejí z jediného společného záhybu předků, který kromě nespecifické katalytické aktivity měl schopnost vázat nukleotidy.[3]
Fylogenetická analýza vazebného enzymu NADP adrenodoxin reduktáza odhalili, že od prokaryot, přes metazoa až po primáty je rozdíl v sekvenčním motivu od většiny FAD a NAD-vazebných míst přísně zachován.[10]
V mnoha článcích a učebnicích je Rossmannův záhyb definován jako přísná opakovaná řada struktury βαβ. Přesto komplexní zkoumání Rossmannových záhybů v mnoha vazebných místech NAD (P) a FAD odhalilo, že je přísně zachována pouze první βα struktura. V některých enzymech může být mezi smyčkami beta, které tvoří beta-vrstvu, mnoho smyček a několik šroubovic (tj. Ani jedna šroubovice).[1][10] Navzdory této odlišnosti konzervativní sekvence a strukturní rysy implikují společný evoluční původ Rossmannových záhybů.[10]
Reference
- ^ A b C d E Hanukoglu I (2015). „Proteopedia: Rossmann fold: Beta-alfa-beta fold na vazebných místech dinukleotidů“. Výuka biochemie a molekulární biologie. 43 (3): 206–9. doi:10,1002 / bmb.20849. PMID 25704928.
- ^ Cox MM, Nelson DL (2013). Lehningerovy principy biochemie (6. vydání). New York: W.H. Freemane. ISBN 978-1-4292-3414-6.
- ^ A b C Kessel A (2010). Úvod do proteinů: struktura, funkce a pohyb. Florida: CRC Press. p. 143. ISBN 978-1-4398-1071-2.
- ^ Rao ST, Rossmann MG (květen 1973). "Porovnání super-sekundárních struktur v proteinech". Journal of Molecular Biology. 76 (2): 241–56. doi:10.1016/0022-2836(73)90388-4. PMID 4737475.
- ^ Hanukoglu I, Gutfinger T (březen 1989). "cDNA sekvence adrenodoxin reduktázy. Identifikace vazebných míst NADP v oxidoreduktázách" (PDF). European Journal of Biochemistry. 180 (2): 479–84. doi:10.1111 / j.1432-1033.1989.tb14671.x. PMID 2924777.
- ^ Scrutton NS, Berry A, Perham RN (leden 1990). "Redesign koenzymové specificity dehydrogenázy proteinovým inženýrstvím". Příroda. 343 (6253): 38–43. doi:10.1038 / 343038a0. PMID 2296288.
- ^ „NAD (P) vázající Rossmann-násobné domény“. SCOP: Strukturální klasifikace proteinů.
- ^ „Doména vázající nukleotidy“. SCOP: Strukturální klasifikace proteinů.
- ^ Bhattacharyya M, Upadhyay R, Vishveshwara S (2012). „Interakční podpisy stabilizující Rossmannův záhyb vázající NAD (P): přístup strukturální sítě“. PLOS ONE. 7 (12): e51676. doi:10.1371 / journal.pone.0051676. PMC 3524241. PMID 23284738.
- ^ A b C Hanukoglu I (2017). „Zachování rozhraní enzym-koenzym ve vazbě FAD a NADP na všudypřítomný enzym reduktázy reduktázy-A“. Journal of Molecular Evolution. 85 (5): 205–218. doi:10.1007 / s00239-017-9821-9. PMID 29177972.