Biosyntéza kobalaminu - Cobalamin biosynthesis
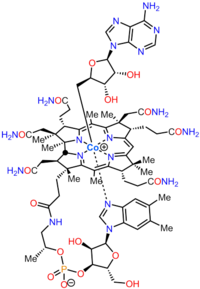

Biosyntéza kobalaminu je proces, kterým bakterie a archea udělat kobalamin, vitamin B12. Konverze zahrnuje mnoho kroků kyselina aminolevulinová přes uroporphyrinogen III a kyselinu adenosylcobyrovou do konečných forem, ve kterých se používá enzymy jak v produkujících organismech, tak v jiných druzích, včetně lidí, kteří ji získávají stravou.
Kobalamin
Cobalamin (vitamin B12) je největší a strukturálně nejsložitější vitamín. Skládá se z upraveného tetrapyrrol, a corrin, s centrálně chelátovaný kobalt a obvykle se nachází v jedné ze dvou biologicky aktivních forem: methylkobalamin a adenosylkobalamin. Většina prokaryoty stejně jako zvířata mají enzymy závislé na kobalaminu, které jej používají jako a kofaktor, zatímco rostliny a houby nepoužívejte to. v bakterie a archaea, tyto enzymy zahrnují methionin syntáza, ribonukleotid reduktáza, glutamát a methylmalonyl-CoA mutázy, ethanolamin amoniak-lyáza, a diol dehydratáza.[1] U některých savců se kobalamin získává stravou a je nezbytný pro methionin syntázu a methylmalonyl-CoA mutáza.[2] U lidí hraje zásadní roli folát metabolismu a při syntéze cyklus kyseliny citronové středně pokročilí, sukcinyl-CoA.[3]
Přehled biosyntézy kobalaminu
Existují alespoň dvě odlišné cesty biosyntézy kobalaminu bakterie:[4]
 Biosyntetické cesty k vitaminu B12 z kyseliny aminolevulinové (ALA) v bakteriích a archeaách | 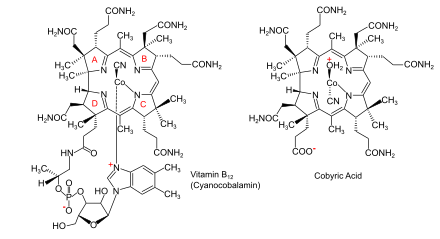 Vitamin B12 (jako kyanokobalamin) a jeho mateřská kyselina cobyrová |
- Aerobní cesta, která vyžaduje kyslík a ve kterém je kobalt vložen pozdě v cestě;[5][6] nalezen v Pseudomonas denitrificans a Rhodobacter capsulatus.
- Anaerobní cesta, ve které je vložení kobaltu prvním závazným krokem k syntéze kobalaminu;[7][8][9] nalezen v Salmonella typhimurium, Bacillus megaterium, a Propionibacterium freudenreichii subsp. shermanii.
Obě cesty lze rozdělit na dvě části:
- Corrin kruhová syntéza vedoucí ke kyselině cobyrinové, se sedmi karboxylát skupiny. V anaerobní cestě to již obsahuje kobalt, ale v aerobní cestě je materiálem vytvořeným v tomto stadiu kyselina hydrogenobyrinová, bez vázaného kobaltu.[10][11][12]
- Vložení kobaltu, pokud již není přítomen; vznik amidy na všech karboxylátových skupinách kromě jedné, čímž se získá kyselina cobyrová; připevnění adenosyl seskupit jako ligand na kobalt; připojení postranního řetězce aminopropanolu k jedné volné karboxylové skupině a sestavení nukleotid smyčka, která poskytne druhý ligand kobaltu.[12][13]
Další typ syntézy probíhá prostřednictvím a záchranná cesta, kde venku korinoidy jsou absorbovány, aby se B.12.[12]Druhy z následujících rody a je známo, že následující jednotlivé druhy syntetizují kobalamin: Propionibacterium shermanii, Pseudomonas denitrifikani, Streptomyces griseus, Acetobacterium, Aerobacter, Agrobacterium, Alkaligeny, Azotobacter, Bacil, Clostridium, Corynebacterium, Flavobacterium, Lactobacillus, Micromonospora, Mycobacterium, Nocardia, Proteus,Rhizobium, Salmonella, Serratia, Streptococcus a Xanthomonas.[14][15]
Detail kroků k tvorbě uroporfyrinogenu III
V raných fázích biosyntézy, a tetrapyrrolický strukturální rámec je tvořen enzymy deamináza a cosynthetase které se transformují kyselina aminolevulinová přes porfobilinogen a hydroxymethylbilan na uroporphyrinogen III. Ten je první makrocyklický společný pro haem, chlorofyl, sirohaem a samotný kobalamin.[6][16][17]
Detail kroků od uroporfyrinogenu III k cob (II) kyselině yrinové a, c-diamidu v aerobních organismech
Biosyntéza kobalaminu se liší od biosyntézy hemu a chlorofylu v uroporfrinogenu III: jeho transformace zahrnuje postupné přidávání methylu (CH3) skupiny za vzniku meziproduktů, které byly uvedeny triviální jména podle počtu těchto skupin, které byly začleněny. První meziprodukt je tedy precorrin-1, další je precorrin-2 a tak dále. Začlenění všech osmi dalších methylových skupin, které se vyskytují v kyselině cobyrické, bylo zkoumáno pomocí 13C značeno methylem S-adenosyl methionin. To nebylo až do vědci v Rhône-Poulenc Rorer použitý a geneticky upravené kmen Pseudomonas denitrificans, ve kterém osm z klas geny podílející se na biosyntéze vitaminu byly nadměrně vyjádřený že lze určit úplnou sekvenci methylace a dalších kroků, čímž se plně vytvoří všechny meziprodukty v cestě.[18][19]
Od uroporphyrinogenu III po precorrin-2
Enzym CobA katalýzy dva chemické reakce ES 2.1.1.107[20]

- (1a) uroporfyrinogen III + S-adenosyl methionin precorrin-1 + S-adenosyl-L-homocystein
- (Lb) precorrin-1 + S-adenosylmethionin precorrin-2 + S-adenosyl-L-homocystein
Od precorrinu-2 do precorrinu-3A
Enzym CobI katalyzuje reakci ES 2.1.1.130[18]
- precorrin-2 + S-adenosyl methionin precorrin-3A + S-adenosyl-L-homocystein
Od precorrin-3A po precorrin-3B
Enzym CobG katalyzuje reakci ES 1.14.13.83[18]
- precorrin-3A + NADH + H+ + O.2 precorrin-3B + NAD+ + H2Ó
Tento enzym je oxidoreduktáza který vyžaduje kyslík, a proto reakce může fungovat pouze za aerobních podmínek. Pojmenování těchto prekorinů jako 3A a 3B odráží skutečnost, že každá obsahuje tři další methylové skupiny než uroporfyrinogen III, ale s odlišnou strukturou: zejména precorrin-3B má vnitřní y-lakton kruh vytvořený z kruhu postranní řetězec kyseliny octové uzavírající zpět do makrocyklu.
Od precorrin-3B po precorrin-4
Enzym CobJ pokračuje v tématu inzerce methylové skupiny katalyzováním reakce ES 2.1.1.131[18]
- precorrin-3B + S-adenosyl methionin precorrin-4 + S-adenosyl-L-homocystein

Důležité je, že během tohoto kroku makrocyklus prstenové smlouvy aby produkt poprvé obsahoval corrin jádro, které charakterizuje kobalamin.
Od precorrin-4 po precorrin-5
Inzerce methylové skupiny pokračuje, když je enzym CobM katalyzuje reakci ES 2.1.1.133[21]
- precorrin-4 + S-adenosyl methionin precorrin-5 + S-adenosyl-L-homocystein
Nově vložená methylová skupina se přidá do kruhu C na uhlí připojeném k methylenu (CH2) můstek ke kruhu B. Toto není jeho konečné umístění na kobalaminu, protože pozdější krok zahrnuje jeho přeskupení na sousední uhlík kruhu.
Od precorrin-5 do precorrin-6A
Enzym CobF katalyzuje reakci ES 2.1.1.152[21]
- precorrin-5 + S-adenosyl methionin + H2Ó precorrin-6A + S-adenosyl-L-homocystein + acetát

Tato přeměna odstraní acetylovou skupinu umístěnou v poloze 1 kruhového systému v precorrinu-4 a nahradí ji nově zavedenou methylovou skupinou. Název produktu, precorrin-6A, odráží skutečnost, že do uroporphyrinogenu III bylo do tohoto bodu přidáno celkem šest methylových skupin. Protože však jeden z nich byl extrudován s acetátovou skupinou, obsahuje struktura precorrin-6A jen zbývajících pět.
Od precorrin-6A po precorrin-6B
Enzym CobK nyní redukuje dvojnou vazbu v kruhu D katalyzováním reakce ES 1.3.1.54[21]
- precorrin-6A + NADPH + H+ precorrin-6B + NADP+
Precorrin-6B se proto liší ve struktuře od precorrin-6A pouze tím, že má další dva atomy vodíku.
Od precorrin-6B po precorrin-8
Enzym CobL má dvě aktivní místa, jedno katalyzující dvě adice methylové skupiny a druhé druhé dekarboxylace CH2COOH skupina na kruhu D, takže se tento substituent stává jednoduchou methylovou skupinou ES 2.1.1.132[21]
- precorrin-6B + 2 S-adenosyl methionin precorrin-8X + 2 S-adenosyl-L-homocystein + CO2

Od precorrinu-8 po kyselinu hydrogenobyrinovou
Enzym CobH katalyzuje přesmykovou reakci ES 5.4.99.61[22]
- precorrin-8X hydrogenobyrinát
Výsledkem je, že methylová skupina, která byla přidána do kruhu C, je izomerizována na své konečné místo, příklad intramolekulární přenos.
Od kyseliny hydrogenobyrinové po a, c-diamid kyseliny hydrogenobyrinové
Další enzym v cestě, CobB, převádí při reakci dvě z osmi skupin karboxylových kyselin na své primární amidy ES 6.3.5.9[23]
- kyselina hydrogenobyrinová + 2 ATP + 2 glutamin + 2 H2Ó a, c-diamid kyseliny hydrogenobyrinové a 2 ADP + 2 fosfát + 2 kyselina glutamová
Od a, c-diamidu kyseliny bromovodíkové po a, c-diamid kyseliny yrinové cob (II)
Kobalt (II) inzerce do makrocyklu je katalyzována enzymem Kobaltová chelatáza (CobNST) v reakci ES 6.6.1.2[24]
- a, c-diamid kyseliny hydrogenobyrinové a Co.2+ + ATP + H2Ó cob (II) kyselina yrinová a, c-diamid + ADP + fosfát + H+
V této fázi dochází ke sloučení aerobní dráhy a anaerobní dráhy, přičemž další kroky jsou chemicky identické.
Detail kroků od uroporfyrinogenu III k cob (II) kyselině yrinové a, c-diamidu v anaerobních organismech
Mnoho kroků přesahujících uroporphyrinogen III v anaerobních organismech, jako je Bacillus megaterium zahrnovat chemicky podobné, ale geneticky odlišné transformace k těm v aerobní dráze.[9][25]
Od precorrinu-2 po kobalt-sirohydrochlorin
Klíčovým rozdílem v dráhách je to, že kobalt je do anaerobních organismů vložen brzy tím, že nejprve oxiduje precorrin-2 na jeho plně aromatizovaná forma sirohydrochlorin a pak k té sloučenině kobaltový (II) komplex.[26] Reakce jsou katalyzovány CysG ES 1.3.1.76 a Sirohydrochlorin kobaltochelatáza ES 4.99.1.3.[27]
Od kobalt-sirohydrochlorinu po kobalt-faktor III
Stejně jako v aerobní dráze je třetí methylová skupina zavedena enzymem methyltransferázou, CbiL v reakci ES 2.1.1.151[26]
- kobalt-sirohydrochlorin + S-adenosylmethionin kobaltový faktor III + S-adenosyl-L-homocystein
Od kobaltového faktoru III po kobalt-precorrin-4
Dále dochází k methylaci a kontrakci prstence za vzniku corrinového makrocyklu ES 2.1.1.272, katalyzovaný enzymem kobalt-faktor III methyltransferáza (CbiH)[28]
- kobalt-faktor III + S-adenosyl methionin kobalt-precorrin-4 + S-adenosyl-L-homocystein

V této dráze obsahuje výsledný materiál δ-lakton, šestičlenný kruh, spíše než y-lakton (pětičlenný kruh) prekorrinu-3B.
Od kobaltu-precorrin-4 po kobalt-precorrin-5A
Zavedení methylové skupiny na C-11 v dalším kroku je katalyzováno kobalt-precorrin-4 methyltransferázou (CbiF) v reakci ES 2.1.1.271[29]
- kobalt-precorrin-4 + S-adenosyl methionin kobalt-precorrin-5 + S-adenosyl-L-homocystein
Od kobaltu-precorrin-5A po kobalt-precorrin-5B
Nyní je připravena scéna pro vytlačování fragmentu se dvěma uhlíky, který odpovídá acetátu uvolněnému při tvorbě precorrinu-6A v aerobní dráze. V tomto případě je uvolněný fragment acetaldehyd a to je katalyzováno CbiG v reakci ES 3.7.1.12[29]
- kobalt-precorrin-5A + H2Ó kobalt-precorrin-5B + acetaldehyd + 2 H+
Od kobaltu-precorrinu-5B po kobalt (II) kyselinu yrinovou a, c-diamid
Kroky od kobaltu-precorrinu-5B po kobalt (II) a, c-diamidu kyseliny yrinové v anaerobní cestě jsou v podstatě chemicky identické s kroky v aerobní sekvenci. Meziprodukty se nazývají kobalt-precorrin-6A, kobalt-precorrin-6B, kobalt-precorrin-8 a kyselina cobyrinová a zúčastněné enzymy / reakce jsou Kobalt-precorrin-5B (C1) -methyltransferáza (CbiD / ES 2.1.1.195 );[30] Kobalt-prekorrin-6A reduktáza (CbiJ / ES 1.3.1.106 );[31] Kobalt-precorrin-7 (C15) -methyltransferáza (dekarboxylační) (CbiET / ES 2.1.1.196 ), Kobalt-precorrin-8 methylmutáza (CbiC / ES 5.4.99.60 ) a CbiA / ES 6.3.5.11. Konečný enzym vytváří cob (II) kyselinu yrinovou a, c-diamid, jak se tyto dvě cesty sbíhají.[12]
Detail kroků od cob (II) yrinové kyseliny a, c-diamidu po adenosylkobalamin
Aerobní a anaerobní organismy sdílejí stejnou chemickou cestu za kyselinou cob (II) yrinovou a, c-diamidem a je to ilustrováno pro klas genové produkty.
Od cob (II) kyseliny yrinové a, c-diamidu po kyselinu adenosylcobyrickou
Kobalt (II) se enzymem redukuje na kobalt (I) Cob (II) kyselina yrinová a, c-diamid-reduktáza (CobR, reakce ES 1.16.8.1 ) a poté enzym Cob (I) kyselina yrinová a, c-diamid adenosyltransferáza (CobO) připojí adenosyl ligand ke kovu v reakci ES 2.5.1.17. Dále enzym CobQ (reakce ES 6.3.5.10 ) převádí všechny karboxylové kyseliny, kromě kyselina propionová na kruhu D, na jejich primární amidy.[6][21]
Od adenosylcobyric kyseliny k adenosylcobinamide phosphate
V aerobních organismech enzym CobCD (reakce ES 6.3.1.10 ) nyní připojuje (R) -1-amino-2-propanol (odvozený od threonin ) na kyselinu propionovou za vzniku adenosylcobinamidu a enzymu CobU (reakce ES 2.7.1.156 ) fosforyláty terminální hydroxyskupinu za vzniku adenosylcobinamid fosfátu.[21] Stejný konečný produkt vzniká v anaerobních organismech přímou reakcí kyseliny adenosylkobyrové s (R) -1-amino-2-propanol O-2-fosfátem (odvozeným od threonin-O-fosfátu enzymem CobD v reakci ES 4.1.1.81 ) katalyzovaný enzymem CbiB.[12]
Od adenosylcobinamid fosfátu po adenosylcobalamin
V samostatné větvi cesty 5,6-dimethylbenzimidazol je biosyntetizován z flavin mononukleotid enzymem 5,6-dimethylbenzimidazol syntáza (reakce ES 1.13.11.79 ) a převedeny CobT v reakci ES 2.4.2.21 na alfa-ribazol 5 'fosfát. Pak enzym CobU (reakce ES 2.7.7.62 ) aktivuje adenosylcobinamid fosfát tvorbou adenosylcobinamid-GDP a CobV (reakce ES 2.7.8.26 ) spojuje dva substráty za vzniku adenosylkobalamin-5'-fosfátu. v posledním kroku ke koenzymu CobC odstraní 5 'fosfátovou skupinu v reakci ES 3.1.3.73[32][33]
- Adenosylkobalamin-5'-fosfát + H2Ó adenosylkobalamin + fosfát
Kompletní biosyntetická cesta zahrnuje dlouhou lineární cestu, která vyžaduje přibližně 25 přispívajících enzymových kroků.
Další cesty metabolismu kobalaminu
Záchranné cesty u prokaryot
Mnoho prokaryotické druhy nemůže biosyntetizovat adenosylkobalamin, ale může ho vyrábět z kobalaminu. Tyto organismy jsou schopné transportu kobalaminu do buňky a jeho přeměny na požadovanou formu koenzymu.[34] Dokonce i organismy jako Salmonella typhimurium díky nimž může kobalamin asimilovat také z externích zdrojů, jsou-li k dispozici.[12][35][36][37] Příjem do buněk usnadňuje Přepravníky ABC které absorbují kobalamin buněčnou membránou.[38]
Metabolismus kobalaminu u lidí
U lidí jsou dietní zdroje kobalaminu po požití vázány jako transkobalaminy.[39] Poté se převádějí na formy koenzymu, ve kterých se používají. Protein methylmalonové acidurie a homocystinurie typu C. je enzym, který katalyzuje decyanace z kyanokobalamin stejně jako dealkylace alkylkobalaminů včetně methylkobalaminu a adenosylkobalaminu.[40][41][42]
Reference
- ^ Rodionov, Dmitrij A .; Vitreschak, Alexey G .; Mironov, Andrey A .; Gelfand, Michail S. (2003). „Srovnávací genomika metabolismu a regulace vitaminu B12 u prokaryot“. Journal of Biological Chemistry. 278 (42): 41148–41159. doi:10,1074 / jbc.M305837200. PMID 12869542.
- ^ Banerjee, Ruma (2006). „Obchodování s zvířaty B12: případ pro doprovod koenzymu“. ACS Chemická biologie. 1 (3): 149–159. doi:10.1021 / cb6001174. PMID 17163662.
- ^ "Vitamin B12". Informační centrum o mikroživinách, Institut Linuse Paulinga, Oregonská státní univerzita, Corvallis, OR. 4. června 2015. Citováno 20. dubna 2020.
- ^ Roessner, Charles A .; Santander, Patricio J .; Scott, A.Ian (2001). "Více biosyntetických drah pro vitamin B12: Variace na ústřední téma". Biosyntéza kofaktorů. Vitamíny a hormony. 61. 267–297. doi:10.1016 / s0083-6729 (01) 61009-4. ISBN 9780127098616. PMID 11153269.
- ^ Heldt, D .; Lawrence, A.D .; Lindenmeyer, M .; Deery, E .; Heathcote, P .; Rigby, S.E .; Warren, M. J. (2005). „Aerobní syntéza vitaminu B12: kontrakce prstence a chelatace kobaltu“. Transakce s biochemickou společností. 33 (4): 815–819. doi:10.1042 / BST0330815. PMID 16042605. S2CID 37362827.
- ^ A b C R. Caspi (2013-09-25). "Cesta: biosyntéza adenosylkobalaminu II (aerobní)". Databáze metabolických cest MetaCyc. Citováno 2020-04-24.
- ^ Roessner CA, Huang KX, Warren MJ, Raux E, Scott AI (červen 2002). "Izolace a charakterizace dalších 14 genů specifikujících anaerobní biosyntézu kobalaminu (vitamin B12) v Propionibacterium freudenreichii (P. shermanii)". Mikrobiologie. 148 (Pt 6): 1845–1853. doi:10.1099/00221287-148-6-1845. PMID 12055304.
- ^ Frank, S .; Brindley, A.A .; Deery, E .; Heathcote, P .; Lawrence, A.D .; Leech, H. K.; Pickersgill, R.W .; Warren, M. J. (2005). "Anaerobní syntéza vitaminu B12: Charakterizace prvních kroků v cestě". Transakce s biochemickou společností. 33 (4): 811–814. doi:10.1042 / BST0330811. PMID 16042604.
- ^ A b R. Caspi (2013-09-25). „Cesta: biosyntéza adenosylkobalaminu I (anaerobní)“. Databáze metabolických cest MetaCyc. Citováno 2020-04-24.
- ^ Battersby, A. R. (1993). „Jak příroda vytváří pigmenty života“ (PDF). Čistá a aplikovaná chemie. 65 (6): 1113–1122. doi:10.1351 / pac199365061113. S2CID 83942303.
- ^ Battersby, A. R. (2000). „Tetrapyrroly: Pigmenty života. Millennium review“. Nat. Prod. Rep. 17 (6): 507–526. doi:10.1039 / B002635M. PMID 11152419.
- ^ A b C d E F Fang, H; Kang, J; Zhang, D (30. ledna 2017). „Mikrobiální produkce vitaminu B12: recenze a budoucí perspektivy “. Továrny na mikrobiální buňky. 16 (1): 15. doi:10.1186 / s12934-017-0631-r. PMC 5282855. PMID 28137297.
- ^ Raux E, Schubert HL, Warren MJ (prosinec 2000). „Biosyntéza kobalaminu (vitamin B12): bakteriální hádanka“. Buňka. Mol. Life Sci. 57 (13–14): 1880–93. doi:10.1007 / PL00000670. PMID 11215515. S2CID 583311.
- ^ Perlman D (1959). "Mikrobiální syntéza kobamidů". Pokroky v aplikované mikrobiologii. 1: 87–122. doi:10.1016 / S0065-2164 (08) 70476-3. ISBN 9780120026012. PMID 13854292.
- ^ Martens JH, Barg H, Warren MJ, Jahn D (březen 2002). „Mikrobiální produkce vitaminu B12“. Aplikovaná mikrobiologie a biotechnologie. 58 (3): 275–85. doi:10.1007 / s00253-001-0902-7. PMID 11935176. S2CID 22232461.
- ^ Battersby AR, Fookes CJ, Matcham GW, McDonald E (květen 1980). "Biosyntéza pigmentů života: tvorba makrocyklu". Příroda. 285 (5759): 17–21. Bibcode:1980 Natur.285 ... 17B. doi:10.1038 / 285017a0. PMID 6769048. S2CID 9070849.
- ^ Frank S, Brindley AA, Deery E, Heathcote P, Lawrence AD, Leech HK a kol. (Srpen 2005). „Anaerobní syntéza vitaminu B12: charakterizace prvních kroků v cestě“. Transakce s biochemickou společností. 33 (Pt 4): 811–4. doi:10.1042 / BST0330811. PMID 16042604.
- ^ A b C d Debussche, L .; Thibaut, D .; Cameron, B .; Crouzet, J .; Blanche, F. (1993). "Biosyntéza corrinového makrocyklu koenzymu B12 u Pseudomonas denitrificans". Journal of Bacteriology. 175 (22): 7430–7440. doi:10.1128 / jb.175.22.7430-7440.1993. PMC 206888. PMID 8226690.
- ^ Battersby A (2005). „Kapitola 11: Objevování divu, jak příroda buduje své molekuly“. V Archer MD, Haley CD (eds.). 1702 předseda chemie v Cambridge: transformace a změna. Cambridge University Press. str. xvi, 257–82. ISBN 0521828732.
- ^ Warren, M. J .; Roessner, C. A .; Santander, P. J .; Scott, A. I. (1990). „Gen cysG Escherichia coli kóduje methylázu uroporphyrinogenu III závislou na S-adenosylmethioninu“. Biochemical Journal. 265 (3): 725–729. doi:10.1042 / bj2650725. PMC 1133693. PMID 2407234.
- ^ A b C d E F Warren, Martin J .; Raux, Evelyne; Schubert, Heidi L .; Escalante-Semerena, Jorge C. (2002). "Biosyntéza adenosylkobalaminu (vitamin B12)". Zprávy o přírodních produktech. 19 (4): 390–412. doi:10.1039 / b108967f. PMID 12195810.
- ^ Thibaut, D .; Couder, M .; Famechon, A .; Debussche, L .; Cameron, B .; Crouzet, J .; Blanche, F. (1992). „Poslední krok v biosyntéze kyseliny hydrogenobyrinové je katalyzován produktem genu cobH s precorrinem-8x jako substrátem“. Journal of Bacteriology. 174 (3): 1043–1049. doi:10.1128 / jb.174.3.1043-1049.1992. PMC 206186. PMID 1732194.
- ^ Debussche, L .; Thibaut, D .; Cameron, B .; Crouzet, J .; Blanche, F. (1990). "Čištění a charakterizace a, c-diamidové syntázy kyseliny kobyrinové z Pseudomonas denitrificans". Journal of Bacteriology. 172 (11): 6239–6244. doi:10.1128 / jb.172.11.6239-6244.1990. PMC 526805. PMID 2172209.
- ^ Debussche, L .; Couder, M .; Thibaut, D .; Cameron, B .; Crouzet, J .; Blanche, F. (1992). „Test, čištění a charakterizace kobaltochelatázy, jedinečného komplexního enzymu katalyzujícího inzerci kobaltu v a, c-diamidu kyseliny hydrogenobyrinové a během biosyntézy koenzymu B12 u Pseudomonas denitrificans“. Journal of Bacteriology. 174 (22): 7445–7451. doi:10.1128 / JB.174.22.7445-7451.1992. PMC 207441. PMID 1429466.
- ^ Roessner, Charles A .; Scott, A. Ian (2006). „Jemné doladění našich znalostí o anaerobní cestě k kobalaminu (vitamin B12)“. Journal of Bacteriology. 188 (21): 7331–7334. doi:10.1128 / JB.00918-06. PMC 1636268. PMID 16936030.
- ^ A b Moore, Simon J .; Warren, Martin J. (2012). „Anaerobní biosyntéza vitaminu B12“. Transakce s biochemickou společností. 40 (3): 581–586. doi:10.1042 / BST20120066. PMID 22616870.
- ^ Yin, Jiang; Xu, Linda X .; Cherney, Maia M .; Raux-Deery, Evelyne; Bindley, Amanda A .; Savchenko, Alexej; Walker, John R .; Cuff, Marianne E .; Warren, Martin J .; James, Michael N. G. (2006). "Krystalová struktura biosyntetické kobaltochelatázy vitaminu B12, CbiXS, od Archaeoglobus Fulgidus". Journal of Structural and Functional Genomics. 7 (1): 37–50. doi:10.1007 / s10969-006-9008-x. PMID 16835730. S2CID 6613060.
- ^ Moore, Simon J .; Biedendieck, Rebekka; Lawrence, Andrew D .; Deery, Evelyne; Howard, Mark J .; Rigby, Stephen E. J .; Warren, Martin J. (2013). "Charakterizace enzymu CbiH60 podílí se na anaerobní prstencové kontrakci biosyntetické dráhy kobalaminu (vitamin B12)". Journal of Biological Chemistry. 288 (1): 297–305. doi:10,1074 / jbc.M112.422535. PMC 3537027. PMID 23155054.
- ^ A b Kajiwara, Yasuhiro; Santander, Patricio J .; Roessner, Charles A .; Pérez, Lisa M .; Scott, A. Ian (2006). „Geneticky konstruovaná syntéza a strukturní charakterizace kobaltu - precorrinu 5A a - 5B, dvou nových meziproduktů na anaerobní cestě k vitaminu B12: definice rolí enzymů CbiF a CbiG“. Journal of the American Chemical Society. 128 (30): 9971–9978. doi:10.1021 / ja062940a. PMID 16866557.
- ^ Roessner, Charles A .; Williams, Howard J .; Scott, A. Ian (2005). „Geneticky konstruovaná výroba kyseliny 1-desmethylcobyrinové, kyseliny 1-desmethylcobyrinové, c-diamidu a kyseliny kyryrinové, c-diamantu v Escherichia coli Naznačuje role CbiD v methylaci C-1 v anaerobní cestě k kobalaminu ". Journal of Biological Chemistry. 280 (17): 16748–16753. doi:10,1074 / jbc.M501805200. PMID 15741157.
- ^ Kim, Wonduck; Major, Tiffany A .; Whitman, William B. (2005). "Úloha genu precorrin 6-X reduktázy v biosyntéze kobamidu v Methanococcus maripaludis ". Archaea. 1 (6): 375–384. doi:10.1155/2005/903614. PMC 2685584. PMID 16243778.
- ^ R. Caspi (2007-04-23). "Cesta: biosyntéza adenosylkobalaminu z adenosylcobinamid-GDP I". Databáze metabolických cest MetaCyc. Citováno 2020-04-24.
- ^ Zayas, Carmen L .; Escalante-Semerena, Jorge C. (2007). „Přehodnocení pozdních kroků syntézy koenzymu B12 u Salmonella enterica: Důkazy, že defosforylace adenosylkobalamin-5′-fosfátu pomocí fosfatázy CobC je posledním krokem cesty“. Journal of Bacteriology. 189 (6): 2210–2218. doi:10.1128 / jb.01665-06. PMC 1899380. PMID 17209023.
- ^ R. Caspi (2013-09-25). „Cesta: záchrana adenosylkobalaminu z kobalaminu“. Databáze metabolických cest MetaCyc. Citováno 2020-04-24.
- ^ Escalante-Semerena, J. C .; Suh, S. J .; Roth, J. R. (1990). „Funkce CobA je vyžadována jak pro biosyntézu kobalinu de novo, tak pro asimilaci exogenních korinoidů v Salmonella typhimurium.“. Journal of Bacteriology. 172 (1): 273–280. doi:10.1128 / jb.172.1.273-280.1990. PMC 208428. PMID 2403541.
- ^ Woodson, Jesse D .; Zayas, Carmen L .; Escalante-Semerena, Jorge C. (2003). „Nová cesta pro záchranu prekurzoru koenzymu B12 kobinamidu v Archea vyžaduje KobinamidEnzym fosfát syntázy (CbiB) Aktivita". Journal of Bacteriology. 185 (24): 7193–7201. doi:10.1128 / jb.185.24.7193-7201.2003. PMC 296239. PMID 14645280.
- ^ Woodson, J. D .; Escalante-Semerena, J. C. (2004). „CbiZ, enzym amidohydrolázy potřebný pro záchranu prekurzoru koenzymu B12 cobinamidu v archaei“. Sborník Národní akademie věd. 101 (10): 3591–3596. Bibcode:2004PNAS..101,3591W. doi:10.1073 / pnas.0305939101. PMC 373507. PMID 14990804.
- ^ Woodson, Jesse D .; Reynolds, duben A .; Escalante-Semerena, Jorge C. (2005). „ABC Transporter for Corrinoids in Halobacterium sp. Strain NRC-1“. Journal of Bacteriology. 187 (17): 5901–5909. doi:10.1128 / JB.187.17.5901-5909.2005. PMC 1196138. PMID 16109931.
- ^ R. Caspi (2013-09-25). „Cesta: záchrana kobalaminu (eukaryotická)“. Databáze metabolických cest MetaCyc. Citováno 2020-04-24.
- ^ Hannibal, Luciana; Kim, Jihoe; Brasch, Nicola E .; Wang, Sihe; Rosenblatt, David S .; Banerjee, Ruma; Jacobsen, Donald W. (2009). „Zpracování alkylkobalaminů v savčích buňkách: role genového produktu MMACHC (CBLC)“. Molekulární genetika a metabolismus. 97 (4): 260–266. doi:10.1016 / j.ymgme.2009.04.005. PMC 2709701. PMID 19447654.
- ^ Banerjee, Ruma; Gherasim, Carmen; Padovani, Dominique (2009). „Drotář, krejčí, voják v intracelulárním obchodování s B12“. Aktuální názor na chemickou biologii. 13 (4): 484–491. doi:10.1016 / j.cbpa.2009.07.007. PMC 5750051. PMID 19665918.
- ^ Quadros, Edward V. (2010). „Pokrok v porozumění asimilaci a metabolismu kobalaminu“. British Journal of Hematology. 148 (2): 195–204. doi:10.1111 / j.1365-2141.2009.07937.x. PMC 2809139. PMID 19832808.
Další čtení
- Layer, Gunhild; Jahn, Dieter; Deery, Evelyne; Lawrence, Andrew D .; Warren, Martin J. (2010). "Biosyntéza hemu a vitaminu B12". Komplexní přírodní produkty II. 445–499. doi:10.1016 / B978-008045382-8.00144-1. ISBN 9780080453828.
externí odkazy
- Prof Sir Alan Battersby: biosyntéza vitaminu B.12 St. Catharine's College, Cambridge, video

