CRAL-TRIO doména - CRAL-TRIO domain
| CRAL / TRIO doména | |||||||||
|---|---|---|---|---|---|---|---|---|---|
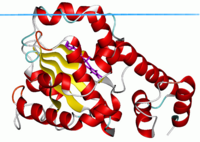 Přenosový protein alfa-tokoferol, uzavřený stav s ligandem.[1] | |||||||||
| Identifikátory | |||||||||
| Symbol | CRAL_TRIO | ||||||||
| Pfam | PF00650 | ||||||||
| InterPro | IPR001251 | ||||||||
| CHYTRÝ | 14. díl | ||||||||
| SCOP2 | 1aua / Rozsah / SUPFAM | ||||||||
| OPM nadčeleď | 121 | ||||||||
| OPM protein | 1r5l | ||||||||
| CDD | cd00170 | ||||||||
| Membranome | 576 | ||||||||
| |||||||||
CRAL-TRIO doména je protein strukturální doména který váže malé lipofilní molekuly.[2] Tato doména je pojmenována po buněčný protein vázající retinaldehyd (CRALBP) a TRIO guaninový směnný faktor.
CRALB protein nese 11-cis-retinol nebo 11-cis-retinaldehyd. Moduluje interakci retinoidů s enzymy vizuálního cyklu. TRIO se podílí na koordinaci aktinová přestavba, což je nezbytné pro migraci a růst buněk.
Ostatní členové rodiny jsou alfa-tokoferol přenos bílkovin a fosfatidylinositol -transferový protein (Sec14). Přepravují své substráty (alfa-tokoferol a fosfatidylinositol nebo fosfatidylcholin mezi různými intracelulárními membránami. Rodina také zahrnuje guanin nukleotidový výměnný faktor který může fungovat jako efektor RAC1 malý G-protein.
Bylo identifikováno, že N-koncová doména kvasinkového proteinu ECM25 obsahuje doménu CRAL-TRIO vázající lipidy.[3]
Struktura
The 14. díl protein byl první doménou CRAL-TRIO, pro kterou byla stanovena struktura.[4] Struktura obsahuje několik alfa helixy stejně jako a beta list složený ze 6 pramenů. Prameny 2, 3, 4, 5 a 5 tvoří paralelní beta fólii, přičemž prameny 1 a 6 jsou antiparalelní. Struktura také identifikovala hydrofobní vazebnou kapsu pro lipid vazba.
Lidské proteiny obsahující tuto doménu
C20orf121; MOSPD2; PTPN9; RLBP1; RLBP1L1; RLBP1L2; SEC14L1; SEC14L2;SEC14L3; SEC14L4; TTPA;
Reference
- ^ Min KC, Kovall RA, Hendrickson WA (prosinec 2003). „Krystalová struktura lidského proteinu pro přenos alfa-tokoferolu vázaného na jeho ligand: důsledky pro ataxii s nedostatkem vitaminu E“. Proc. Natl. Acad. Sci. USA. 100 (25): 14713–8. doi:10.1073 / pnas.2136684100. PMC 299775. PMID 14657365.
- ^ Panagabko C, Morley S, Hernandez M, et al. (Červen 2003). "Specifičnost ligandu v rodině proteinů CRAL-TRIO". Biochemie. 42 (21): 6467–74. doi:10.1021 / bi034086v. PMID 12767229.
- ^ Gallego O, Betts MJ, Gvozdenovic-Jeremic J, et al. (Listopad 2010). „Systematický screening na interakce proteinů a lipidů v Saccharomyces cerevisiae“. Mol. Syst. Biol. 6 (1): 430. doi:10.1038 / msb.2010.87. PMC 3010107. PMID 21119626.
- ^ Sha B, Phillips SE, Bankaitis VA, Luo M (leden 1998). "Krystalová struktura proteinu přenosu fosfatidylinositolu Saccharomyces cerevisiae". Příroda. 391 (6666): 506–10. doi:10.1038/35179. PMID 9461221. S2CID 4416317.
externí odkazy
- UMich Orientace proteinů v membránách rodiny / nadčeleď-129 - Vypočítané prostorové polohy domén CRAL-TRIO v membráně
| Tento membránový protein –Vztahující se článek je pahýl. Wikipedii můžete pomoci pomocí rozšiřovat to. |
