CBS doména - CBS domain
| CBS doména | |||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|
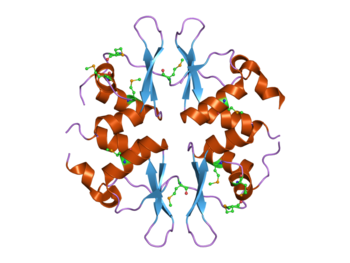 Struktura kvasinkového proteinu SNF4, který obsahuje čtyři CBS domény.[1] Tento protein je součástí komplexu AMPK aktivované proteinové kinázy (AMPK). | |||||||||||
| Identifikátory | |||||||||||
| Symbol | CBS | ||||||||||
| Pfam | PF00571 | ||||||||||
| InterPro | IPR000644 | ||||||||||
| CHYTRÝ | CBS | ||||||||||
| STRÁNKA | PS51371 | ||||||||||
| SCOP2 | 1zfj / Rozsah / SUPFAM | ||||||||||
| CDD | cd02205 | ||||||||||
| |||||||||||
V molekulární biologii se CBS doména je proteinová doména nachází se v řadě proteinů u všech druhů od bakterií po člověka. Poprvé byl identifikován jako konzervovaná sekvence region v roce 1997 a pojmenovaný po cystathionin beta syntáza, jeden z proteinů, ve kterém se nachází.[2] CBS domény se také nacházejí v celé řadě dalších proteinů, jako jsou inosinmonofosfátdehydrogenáza,[3] napěťově řízené chloridové kanály[4][5][6][7][8] a AMP-aktivovaná protein kináza (AMPK).[9][10] CBS domény regulují aktivitu asociovaných enzymatických a transportních domén v reakci na vazebné molekuly s adenosylovými skupinami, jako jsou AMP a ATP nebo s-adenosylmethionin.[11]
Struktura
Doména CBS se skládá z beta-alfa-beta-beta-alfa sekundární struktura vzor, který je složený do kulovité koule terciární struktura který obsahuje třívláknovou antiparalelní β-list se dvěma α-šroubovice na jedné straně. CBS domény se vždy nacházejí v párech v proteinových sekvencích a každý pár těchto domén se úzce sdružuje v pseudo dimerním uspořádání prostřednictvím svých β-listů tvořících takzvaný CBS pár nebo Bateman doména.[12][13] Tyto páry domén CBS se mohou sdružovat v přímém přenosu (tj. Kódy PDB 3KPC, 1PVM, 2OOX) Nebo head-to-tail (tj. Kódy PDB 1O50, 1PBJ) Způsobem, který vytváří diskovou kompaktní strukturu. Tímto způsobem vytvářejí rozštěpy, které tvoří kanonické oblasti vázající ligand.[14][15][16][17][18] V zásadě počet kanonických vazebných míst odpovídá počtu domén CBS v molekule a jsou tradičně číslovány podle domény CBS, která obsahuje každý ze konzervovaných aspartátových zbytků, které potenciálně interagují s ribózou nukleotidů.[19] Ne všechny tyto dutiny však mohou nutně vázat nukleotidy nebo být funkční. Nedávno bylo také popsáno nekanonické místo pro AMP v proteinu MJ1225 z M. jannaschii, ačkoli jeho funkční role je stále neznámá.[20]

Ligandová vazba
Ukázalo se, že CBS domény se vážou na adenosylové skupiny v molekulách, jako jsou AMP a ATP,[11] nebo s-adenosylmethionin,[21] ale mohou také vázat kovové ionty, jako je Mg2+.[22][23] Po navázání těchto různých ligandů regulují CBS domény aktivitu asociovaných enzymatických domén.[24] Molekulární mechanismy, které jsou základem této regulace, se teprve začínají objasňovat.[16][17][21][22][25] V tuto chvíli byly navrženy dva různé typy mechanismů. První tvrdí, že nukleotidová část ligandu neindukuje v podstatě žádnou změnu ve struktuře proteinu, elektrostatický potenciál na vazebném místě je nejvýznamnější vlastnost vazby adenosin nukleotidů.[17][26] Tato „statická“ odezva by se podílela na procesech, ve kterých by regulace pomocí energetického náboje byla výhodná.[17][26] Naopak, druhý typ mechanismu (označovaný jako „dynamický“) zahrnuje dramatické konformační změny ve struktuře proteinu po navázání ligandu a byl popsán pro cytosolickou doménu Mg2+ transportér MgtE z Thermus thermophilus,[22] neznámý funkční protein MJ0100 z M. jannaschii [21][27] a regulační oblast Clostridium perfringens pyrofosfatáza.[28]
Přidružené domény
CBS domény se často nacházejí v proteinech, které obsahují jiné domény. Tyto domény jsou obvykle enzymatický, membránové transportéry nebo domény vázající DNA. Často se však také nacházejí proteiny, které obsahují pouze domény CBS, zejména u prokaryot. Tyto samostatné proteiny domény CBS mohou po navázání na jiné proteiny, jako jsou kinázy, se kterými interagují a regulují, vytvářet komplexy.

Mutace vedoucí k nemoci
Mutace v některých lidských proteinech obsahujících doménu CBS vedou ke genetickým chorobám.[3] Například mutace v cystathionin-beta-syntáza protein vede k dědičné poruše metabolismu tzv homocystinurie (OMIM: 236200 ).[29] Ukázalo se, že mutace v gama podjednotce enzymu AMPK vedou k familiárním Hypertrofické kardiomyopatie s Wolff-Parkinson-White syndrom (OMIM: 600858 ). Mutace v CBS doménách enzymu IMPDH vedou k očnímu stavu retinitis pigmentosa (OMIM: 180105 ).
Lidé mají řadu napěťově řízených chloridový kanál geny a mutace v CBS doménách několika z nich byly identifikovány jako příčina genetických onemocnění. Mutace v CLCN1 vést k myotonie (OMIM: 160800 ),[30] mutace v CLCN2 může vést k idiopatická generalizovaná epilepsie (OMIM: 600699 ), mutace v CLCN5 může vést k Dentova nemoc (OMIM: 300009 ), mutace v CLCN7 může vést k osteopetróza (OMIM: 259700 ),[31] a mutace v CLCNKB může vést k Bartterův syndrom (OMIM: 241200 ).
Reference
- ^ PDB: 2nye; Rudolph MJ, Amodeo GA, Iram SH, Hong SP, Pirino G, Carlson M, Tong L (leden 2007). "Struktura domény Bateman2 kvasinek Snf4: dimerní asociace a význam pro vazbu AMP". Struktura. 15 (1): 65–74. doi:10.1016 / j.str.2006.11.014. PMID 17223533.
- ^ Bateman A (leden 1997). "Struktura domény společné pro archaebakterie a protein choroby homocystinurie". Trends Biochem. Sci. 22 (1): 12–3. doi:10.1016 / S0968-0004 (96) 30046-7. PMID 9020585.
- ^ A b Ignoul S, Eggermont J (prosinec 2005). „Domény CBS: struktura, funkce a patologie v lidských proteinech“. Dopoledne. J. Physiol., Cell Physiol. 289 (6): C1369–78. doi:10.1152 / ajpcell.00282.2005. PMID 16275737.
- ^ Ponting CP (březen 1997). "CBS domény v CIC chloridových kanálech zapojených do myotonie a nefrolitiázy (ledvinové kameny)". J. Mol. Med. 75 (3): 160–3. PMID 9106071.
- ^ Meyer S, Dutzler R (únor 2006). "Krystalová struktura cytoplazmatické domény chloridového kanálu ClC-0". Struktura. 14 (2): 299–307. doi:10.1016 / j.str.2005.10.008. PMID 16472749.
- ^ Yusef YR, Zúñiga L, Catalán M, Niemeyer MI, Cid LP, Sepúlveda FV (duben 2006). "Odstranění hradlování v napěťově závislém chloridovém kanálu ClC-2 bodovými mutacemi ovlivňujícími póry a C-koncovou doménu CBS-2". J. Physiol. 572 (Pt 1): 173–81. doi:10.1113 / jphysiol.2005.102392. PMC 1779660. PMID 16469788.
- ^ Markovic S, Dutzler R (červen 2007). „Struktura cytoplazmatické domény chloridového kanálu ClC-Ka odhaluje konzervované interakční rozhraní“. Struktura. 15 (6): 715–25. doi:10.1016 / j.str.2007.04.013. PMID 17562318.
- ^ Meyer S, Savaresi S, Forster IC, Dutzler R (leden 2007). „Rozpoznávání nukleotidů cytoplazmatickou doménou lidského transportéru chloridů ClC-5“. Nat. Struct. Mol. Biol. 14 (1): 60–7. doi:10.1038 / nsmb1188. PMID 17195847. S2CID 20733119.
- ^ Den P, Sharff A, Parra L a kol. (Květen 2007). "Struktura páru CBS-doména z regulační podjednotky gama 1 lidské AMPK v komplexu s AMP a ZMP". Acta Crystallogr. D. 63 (Pt 5): 587–96. doi:10.1107 / S0907444907009110. PMID 17452784.
- ^ Rudolph MJ, Amodeo GA, Iram SH a kol. (Leden 2007). "Struktura domény Bateman2 kvasinek Snf4: dimerní asociace a význam pro vazbu AMP". Struktura. 15 (1): 65–74. doi:10.1016 / j.str.2006.11.014. PMID 17223533.
- ^ A b Kemp BE (leden 2004). „Batemanovy domény a deriváty adenosinu tvoří závaznou smlouvu“. J. Clin. Investovat. 113 (2): 182–4. doi:10.1172 / JCI20846. PMC 311445. PMID 14722609.
- ^ Kemp BE (leden 2004). „Batemanovy domény a deriváty adenosinu tvoří závaznou smlouvu“. J. Clin. Investovat. 113 (2): 182–4. doi:10.1172 / JCI20846. PMC 311445. PMID 14722609.
- ^ Zhang R, Evans G, Rotella FJ, Westbrook EM, Beno D, Huberman E, Joachimiak A, Collart FR (duben 1999). "Charakteristiky a krystalová struktura bakteriální inosin-5'-monofosfátdehydrogenázy". Biochemie. 38 (15): 4691–700. CiteSeerX 10.1.1.488.2542. doi:10.1021 / bi982858v. PMID 10200156.
- ^ Rudolph MJ, Amodeo GA, Iram SH, Hong SP, Pirino G, Carlson M, Tong L (leden 2007). "Struktura domény Bateman2 kvasinek Snf4: dimerní asociace a význam pro vazbu AMP". Struktura. 15 (1): 65–74. doi:10.1016 / j.str.2006.11.014. PMID 17223533.
- ^ Meyer S, Savaresi S, Forster IC, Dutzler R (leden 2007). „Rozpoznávání nukleotidů cytoplazmatickou doménou lidského transportéru chloridů ClC-5“. Nat. Struct. Mol. Biol. 14 (1): 60–7. doi:10.1038 / nsmb1188. PMID 17195847. S2CID 20733119.
- ^ A b Amodeo GA, Rudolph MJ, Tong L (září 2007). "Krystalová struktura heterotrimerového jádra Saccharomyces cerevisiae AMPK homolog SNF1". Příroda. 449 (7161): 492–5. doi:10.1038 / nature06127. PMID 17851534. S2CID 4342092.
- ^ A b C d Townley R, Shapiro L (březen 2007). "Krystalové struktury adenylátového senzoru z štěpné kvasinkové AMP-aktivované proteinové kinázy". Věda. 315 (5819): 1726–9. doi:10.1126 / science.1137503. PMID 17289942. S2CID 38983201.
- ^ Jin X, Townley R, Shapiro L (říjen 2007). „Strukturální pohled na regulaci AMPK: vstupuje do hry ADP“. Struktura. 15 (10): 1285–95. doi:10.1016 / j.str.2007.07.017. PMID 17937917.
- ^ Kemp BE, Oakhill JS, Scott JW (říjen 2007). "Struktura a regulace AMPK ze tří úhlů". Struktura. 15 (10): 1161–3. doi:10.1016 / j.str.2007.09.006. PMID 17937905.
- ^ Gómez-García I, Oyenarte I, Martínez-Cruz LA (květen 2010). „Krystalová struktura proteinu MJ1225 z Methanocaldococcus jannaschii vykazuje silné zachování klíčových strukturních rysů pozorovaných v Eukaryal gama-AMPK“. J Mol Biol. 399 (1): 53–70. doi:10.1016 / j.jmb.2010.03.045. PMID 20382158.
- ^ A b C Lucas M, Encinar JA, Arribas EA, Oyenarte I, García IG, Kortazar D, Fernández JA, Mato JM, Martínez-Chantar ML, Martínez-Cruz LA (únor 2010). „Vazba S-methyl-5'-thioadenosinu a S-adenosyl-L-methioninu na protein MJ0100 spouští konformační změnu otevřeného k uzavřenému páru motivů CBS.“. J. Mol. Biol. 396 (3): 800–20. doi:10.1016 / j.jmb.2009.12.012. PMID 20026078.
- ^ A b C Ishitani R, Sugita Y, Dohmae N, Furuya N, Hattori M, Nureki O (říjen 2008). „Mechanismus snímání Mg2 + transportéru Mg2 + MgtE sondovaný studiem molekulární dynamiky“. Proc. Natl. Acad. Sci. USA. 105 (40): 15393–8. doi:10.1073 / pnas.0802991105. PMC 2563093. PMID 18832160.
- ^ Hattori M, Nureki O (březen 2008). "[Strukturální základ mechanismu homeostázy Mg2 transportérem MgtE]". Tanpakushitsu Kakusan Koso (v japonštině). 53 (3): 242–8. PMID 18326297.
- ^ Scott JW, Hawley SA, Green KA a kol. (Leden 2004). „Domény CBS tvoří moduly snímající energii, jejichž vazba adenosinových ligandů je narušena mutacemi onemocnění“. J. Clin. Investovat. 113 (2): 274–84. doi:10,1172 / JCI19874. PMC 311435. PMID 14722619.
- ^ Tuominen H, Salminen A, Oksanen E, Jämsen J, Heikkilä O, Lehtiö L, Magretova NN, Goldman A, Baykov AA, Lahti R (květen 2010). „Krystalové struktury domén CBS a DRTGG regulační oblasti pyrofosfatázy Clostridiumperfringens v komplexu s inhibitorem, AMP a aktivátorem, diadenosintetrafosfátem“. J. Mol. Biol. 398 (3): 400–13. doi:10.1016 / j.jmb.2010.03.019. PMID 20303981.
- ^ A b Xiao B, Heath R, Saiu P, Leiper FC, Leone P, Jing C, Walker PA, Haire L, Eccleston JF, Davis CT, Martin SR, Carling D, Gamblin SJ (září 2007). "Strukturální základ pro vazbu AMP na savčí AMP-aktivovanou proteinovou kinázu". Příroda. 449 (7161): 496–500. doi:10.1038 / nature06161. PMID 17851531. S2CID 4345919.
- ^ Lucas M, Kortazar D, Astigarraga E a kol. (Říjen 2008). „Čištění, krystalizace a předběžná rentgenová difrakční analýza páru domén CBS z proteinu MJ0100 Methanococcus jannaschii“. Acta Crystallographica oddíl F. 64 (Pt 10): 936–41. doi:10.1107 / S1744309108027930. PMC 2564890. PMID 18931440.
- ^ Tuominen H, Salminen A, Oksanen E a kol. (Květen 2010). "Krystalové struktury domén CBS a DRTGG v regulační oblasti Clostridium perfringens Pyrophosphatase Complexed with the Inhibitor, AMP, and Activator, Diadenosine Tetraphosphate". J Mol Biol. 398 (3): 400–413. doi:10.1016 / j.jmb.2010.03.019. PMID 20303981.
- ^ Shan X, Dunbrack RL, Christopher SA, Kruger WD (březen 2001). „Mutace v regulační doméně cystathionin beta syntázy mohou funkčně potlačit mutace odvozené od pacienta v cis“. Hučení. Mol. Genet. 10 (6): 635–43. doi:10,1093 / hmg / 10,6,635. PMID 11230183.
- ^ Pusch M (duben 2002). "Myotonie způsobená mutacemi v genu CLCN1 ve svalovém chloridovém kanálu". Hučení. Mutat. 19 (4): 423–34. doi:10.1002 / humu.10063. PMID 11933197.
- ^ Cleiren E, Bénichou O, Van Hul E a kol. (Prosinec 2001). „Albers-Schönbergova choroba (autozomálně dominantní osteopetróza, typ II) je výsledkem mutací v genu pro chloridový kanál ClCN7“. Hučení. Mol. Genet. 10 (25): 2861–7. doi:10,1093 / hmg / 10,25,2861. PMID 11741829.
