Fosfol - Phosphole
| |||
| Jména | |||
|---|---|---|---|
| Preferovaný název IUPAC 1H-Fosfol[1] | |||
| Identifikátory | |||
3D model (JSmol ) | |||
| ChemSpider | |||
PubChem CID | |||
Řídicí panel CompTox (EPA) | |||
| |||
| |||
| Vlastnosti | |||
| C4H5P | |||
| Molární hmotnost | 84.058 g · mol−1 | ||
| Související sloučeniny | |||
Související sloučeniny | Pyrrol, bismole, podešev, stibole | ||
Pokud není uvedeno jinak, jsou uvedeny údaje o materiálech v nich standardní stav (při 25 ° C [77 ° F], 100 kPa). | |||
| Reference Infoboxu | |||
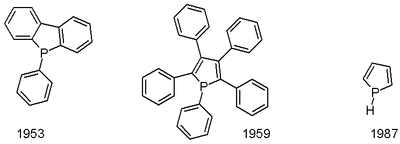
Fosfol je organická sloučenina s chemický vzorec C4H4PH; to je fosfor analog pyrrol. Termín fosfol také označuje substituované deriváty mateřské látky heterocyklus. Tyto sloučeniny jsou teoreticky zajímavé, ale slouží také jako ligandy pro přechodové kovy a jako prekurzory složitějších organofosforové sloučeniny.
Struktura a lepení
Na rozdíl od souvisejících 5členných heterocyklů pyrrol, thiofen, a furan, aromatičnost fosforu je sníženo, což odráží neochotu fosforu k přemístit své osamělý pár.[2] Hlavním ukazatelem tohoto rozdílu je pyramidalizace fosforu. Absence aromatičnosti je také indikována reaktivitou fosforů.[3] Fosfoly podstupují různé cykloadiční reakce, koordinační vlastnosti fosforů jsou také dobře studovány.[4].
Příprava
Původní fosfol byl poprvé popsán v roce 1983. Byl připraven protonací fosforečnanu lithného za nízké teploty.[5] Pentafenylfosfol byl hlášen v roce 1953.[6] Jedna cesta k fosforům je přes McCormackova reakce, zahrnující přidání 1,3-dien na chlorid fosfonový (RPCI2) následován dehydrohalogenace.[7] Fenylfosfoly lze připravit zirkonacyklopentadieny reakcí s PhPCl2.[8]
Reaktivita
Chování sekundárních fosforů, těch s P-H vazbou, je ovládáno reaktivitou této skupiny.[5] Výchozí fosfol se snadno přeskupí migrací H z P na uhlík-2, následovanou dimerizací.
Většina fosfolů je terciární, typicky P-methyl nebo P-fenyl. Nenaromatičnost těchto fosforů se projevuje v jejich reaktivitě, ale vazby P-C zůstávají nedotčené. Například podstoupí Diels-Alderovy reakce s elektrofilní alkyny. Jsou základní v P a slouží jako ligandy.[5]
2,5-Difenylfosfoly mohou být funkcionalizovány deprotonací s následnou P-acylací a poté rovnováhou 1H, 2H, 3H fosfolidu, což vede k posunu acylové skupiny v poměru 1: 3.[9]Fosfoly lze také přeměnit na β-funkční fosfabenzeny (fosfininy, nebo fosfor ) prostřednictvím funkcionalizace imidoylchlorid a vložení.[10]
Viz také
Reference
- ^ Nomenklatura organické chemie: Doporučení IUPAC a preferovaná jména 2013 (modrá kniha). Cambridge: Královská společnost chemie. 2014. s. 146. doi:10.1039/9781849733069-00130. ISBN 978-0-85404-182-4.
- ^ D. B. Chesnut; L. D. Quin (2007). „Důležitá role osamělého páru fosforu v aromatičnosti fosfolu“. Heteroatomová chemie. 18: 754. doi:10,1002 / hc.20364.
- ^ Philip Hindenberg; Carlos Romero-Nieto (2016). „Phosphaphenalenes: Evolution of the Phosphorus Heterocycles“. Synlett. 27: 2293–2300. doi:10.1055 / s-0035-1562506.
- ^ Almaz Zagidullin; Vasily A. Milujkov (2013). "Fosfoly - vývoj a nedávné pokroky". Mendeleev Communications. 23: 117–130. doi:10.1016 / j.mencom.2013.05.001.
- ^ A b C Claude Charrier; Hubert Bonnard; Guillaume De Lauzon; Francois Mathey (1983). „Proton [1,5] posunuje P-nesubstituované 1H-fosfoly. Syntéza a chemie dimerů 2H-fosfolu“. J. Am. Chem. Soc. 105: 6871–6877. doi:10.1021 / ja00361a022.
- ^ Průvodce chemií organofosforu Louis D. Quin 2000 John Wiley & Sons ISBN 0-471-31824-8
- ^ W. B. McCormack (1973). „3-methyl-1-fenylfosfenolenoxid“. Organické syntézy.; Kolektivní objem, 5, str. 787
- ^ Paul J. Fagan a William A. Nugent (1998). „1-Fenyl-2,3,4,5-tetramethylfosfol“. Organické syntézy.; Kolektivní objem, 9, str. 653
- ^ Magali Clochard; Joanna Grundy; Bruno Donnadieu a François Mathey (2005). "Přímá syntéza 3-acylfosfálů". Organické dopisy. 7 (20): 4511–4513. doi:10.1021 / ol051816d. PMID 16178571.
- ^ Grundy, J. & Mathey, F. (2005). „Konverze fosfolidových iontů v jedné nádobě na β-funkční fosfininy“. Angewandte Chemie International Edition. 44: 1082–1084. doi:10.1002 / anie.200462020. PMID 15662672.