Podešev - Arsole - Wikipedia
| |||
| Jména | |||
|---|---|---|---|
| Preferovaný název IUPAC 1H- Podešev | |||
| Ostatní jména Arsenol Arsacyklopentadien | |||
| Identifikátory | |||
3D model (JSmol ) | |||
| ChEBI | |||
| ChemSpider | |||
PubChem CID | |||
Řídicí panel CompTox (EPA) | |||
| |||
| |||
| Vlastnosti | |||
| C4H4Popel | |||
| Molární hmotnost | 128,00 g mol−1 | ||
| Související sloučeniny | |||
Související sloučeniny | Pyrrol, fosfol, bismole, stibole | ||
Pokud není uvedeno jinak, jsou uvedeny údaje o materiálech v nich standardní stav (při 25 ° C [77 ° F], 100 kPa). | |||
| Reference Infoboxu | |||
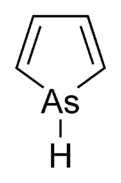
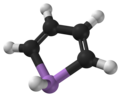
Podešev, také zvaný arsenol[1] nebo arsacyklopentadien, je organoarsenická sloučenina s vzorec C4H4Popel. Je klasifikován jako a metalole a je izoelektronický a související s pyrrol kromě toho, že arsen atom je nahrazen dusík atom. Zatímco molekula pyrrolu je rovinná, molekula arsole není, a atom vodíku navázaný na arsen vyčnívá z molekulární roviny. Arsole je jen mírně aromatický, s asi 40% aromatičnosti pyrrolu.[2] Samotná Arsole nebyla hlášena v čisté formě, ale v několika nahrazeno volané analogy arsoles existovat. Arsoly a složitější deriváty arsole mají podobnou strukturu a chemické vlastnosti jako fosfol deriváty. Když je podešev spojena s a benzen kruhu, tato molekula se nazývá arsindolenebo benzarsole.[3]
Nomenklatura
Arsole patří do řady heterocyklických pnictogen sloučeniny. Pojmenování cyklické organoarsenické sloučeniny například arsole je založen na rozšíření Hantzsch – Widmanova nomenklatura Systém[4] schváleno IUPAC, jak je shrnuto níže:[5]
| Velikost prstenu | Nenasycený kruh | Nasycený prsten |
|---|---|---|
| 3 | Arsirene | Arsirane |
| 4 | Arsete | Arsetane |
| 5 | Podešev | Arsolane |
| 6 | Arsinin | Arsinane |
| 7 | Arsepine | Arsepane |
| 8 | Arsocine | Arsocane |
| 9 | Arsonin | Arsonane |
| 10 | Arsecine | Arsecane |
Vzhledem k podobnosti s anglickým slangovým slovem „kretén „(běžně se používá mimo Severní Ameriku), název„ arsole “byl považován za cíl zábavy,„ hloupé jméno “,[6][7] a jeden z několika chemické sloučeniny s neobvyklým názvem. Tato náhoda „hloupého jména“ však také podnítila podrobné vědecké studie.[2][ověření se nezdařilo ][pochybný ]
Vlastnosti
| M | d (M-C), A | d (M-H), A | α (C-M-C), ° | E, kJ / mol |
|---|---|---|---|---|
| N | 1.37 | 1.01 | 110 | 0 |
| P | 1.81 | 1.425 | 90.5 | 67 |
| Tak jako | 1.94 | 1.53 | 86 | 125 |
| Sb | 2.14 | 1.725 | 80.5 | 160 |
| Bi | 2.24 | 1.82 | 78 | 220 |
Samotná konzola nebyla dosud experimentálně izolována, ale molekulární geometrie a elektronická konfigurace konzoly byly studovány teoreticky. Výpočty se také zabývaly vlastnostmi jednoduchých derivátů arsole, kde jsou atomy vodíku nahrazeny jinými atomy nebo malými uhlovodíkovými skupinami, a existují experimentální zprávy o chemických vlastnostech složitějších derivátů arsole. Podobná situace je iu ostatních C.4H4MH metaloly kde M = P, As, Sb a Bi.
Rovinnost
Výpočty naznačují, že zatímco pyrrol (C4H4NH) molekula je planární, fosfol (C4H4PH) a těžší metaloly nejsou a jejich pnictogen vázaný atom vodíku vyčnívá z roviny.[9] Podobná tendence se předpokládá pro fluorovaný C4F4MH deriváty (M = N, P, As, ..), ale inverzní bariéry jsou asi o 50–100% vyšší. Rovinnost se ztrácí i v pyrrolu, když je jeho atom vodíku vázaný na dusík substituován, např fluor. Rovinnost se však při výpočtu hodnotí energií potřebnou k převodu mezi dvěma konfiguracemi, kde vazba M-H se rozprostírá vlevo nebo vpravo od molekulární roviny. Nenulová (malá) hodnota této energie však nemusí nutně znamenat, že molekula má nízkou symetrii z důvodu možnosti tepelného nebo kvantové tunelování mezi těmito dvěma konfiguracemi.[8]
Aromatičnost
Aromatičnost podešve se projeví delokalizace a rezonance jeho kruhových elektronů. Úzce souvisí s rovinností v tom, že čím rovinnější je molekula, tím silnější je její aromatičnost.[10] O aromatičnosti arsole a jejích derivátů se již roky diskutuje jak z experimentálního, tak z teoretického hlediska. Přezkoumání z roku 2005 v kombinaci s kvantově chemickými výpočty dospělo k závěru, že samotná arsole je „mírně“ aromatická, protože její kruhový proud je 40% proudu pyrrolu, o kterém je známo, že je aromatický. Srovnatelný kruhový proud však byl vypočítán pro cyklopentadien, který je již dlouho považován za nearomatický.[2] Další zprávy naznačují, že aromatičnost (a rovinnost) se může u derivátů arsole lišit.[9]
Chemické vlastnosti (deriváty arsole)
Chemické vlastnosti derivátů arsole byly studovány experimentálně; jsou podobné těm z fosfol a jeho deriváty.[1] Substituce všech atomů vodíku v arsole za fenyl Skupiny poskytují žluté krystalické jehly pentaphenylarsole, který má teplotu tání 215 ° C. Tento komplex lze připravit s výtěžkem 50–93% reakcí 1,4-dijod-1,2,3,4-tetrafenylbutadienu[11] nebo 1,4-dilithio-l, 2,3,4-tetrafenylbutadien s fenylarsenózním dichloridem (C.6H5AsCl2) v éter.
Nahrazení v této reakci chlorid arsenitý pro fenylarsenichlorid se získá 1-chlor-2,3,4,5-tetrafenylarsole, která také tvoří žluté jehly, ale s nižší teplotou tání 182–184 ° C. Pentaphenylarsole lze dále oxidovat peroxid vodíku výsledkem jsou žluté krystaly s teplotou tání 252 ° C. Může také reagovat s pentakarbonyl železa (Fe (CO)5) v isooktan při 150 ° C, čímž se získá pevná organoarsenická sloučenina vzorce C34H25As, Fe (CO)3.[1] Reakce pentafenylarsole s výtěžkem kovového lithia nebo draslíku 1,2,3-trifenylnaftalen.[12]
Reakce fenylarenózního dichloridu s lineárními difenyly vede k 1,2,5-trifenylarsole (viz níže), pevné látce s teplotou tání asi 170 ° C.[13] Tato sloučenina tvoří různé anionty po zpracování alkalickými kovy.[14]
Viz také
- Pyrrol, a dusík analogový.
- Furan, an kyslík analogový.
- Thiofen, a síra analogový.
- Jednoduché aromatické kruhy
- Varsol, a ropa destilát s rozmezí bodu varu 150–200 ° C.
Reference
- ^ A b C Frederick George Mann (1970). Heterocyklické deriváty fosforu, arsenu, antimonu a vizmutu. John Wiley and Sons. str. 357–360. ISBN 978-0-471-37489-3. Citováno 21. března 2011.
V angličtině tento kruhový systém často pojmenoval arsenole „pro eufonii“
- ^ A b C M. P. Johansson; J. Juselius (2005). Msgstr "Revoluce aromatiky konzoly". Lett. Org. Chem. 2: 469–474. doi:10.2174/1570178054405968.
Pomocí kvantové chemické metodiky znovu prozkoumáme aromatičnost tolik diskutované arsole pomocí nově vyvinuté metody měřidla včetně magneticky indukovaných proudů (GIMIC). GIMIC poskytuje kvantitativní měřítko indukované síly proudu prstence, což ukazuje, že arsole je mírně aromatická.
- ^ A. Muranaka; S. Yasuike; C-Y. Liu; J. Kurita; N. Kakusawa; T. Tsuchiya; M. Okuda; N. Kobayashi; Y. Matsumoto; K. Yoshida; D. Hashizume; M. Uchiyama (2009). "Vliv periodické náhrady heteroatomu na spektroskopické vlastnosti derivátů indolu a benzofuranu". J. Phys. Chem. A. 113 (2): 464–473. doi:10.1021 / jp8079843. PMID 19099440.
- ^ "Revize rozšířeného Hantzsch-Widmanova systému nomenklatury pro heteromonocykly „na IUPAC, vyvoláno 29. září 2008
- ^ Nicholas C. Norman (1998). Chemie arsenu, antimonu a vizmutu. Springer. str. 235. ISBN 978-0-7514-0389-3. Citováno 15. března 2011.
- ^ Richard Watson Todd (25. května 2007). Hodně povyku o angličtině: nahoru a dolů bizarní odbočky fascinujícího jazyka. Nakladatelství Nicholas Brealey. str. 138. ISBN 978-1-85788-372-5. Citováno 15. března 2011.
- ^ Paul W May, Molekuly se hloupými nebo neobvyklými jménypubl. 2008 Imperial College Press, ISBN 978-1-84816-207-5(pbk). Viz také webová stránka "Molekuly se hloupými nebo neobvyklými jmény „na School of Chemistry, University of Bristol, (vyvoláno 29. září 2008)
- ^ A b Pelzer, Silke; Wichmann, Karin; Wesendrup, Ralf; Schwerdtfeger, Peter (2002). „Trendy v inverzních bariérách IV. Skupina 15 Analogicky jako pyrrol“. The Journal of Physical Chemistry A. 106: 6387. doi:10.1021 / jp0203494.
- ^ A b Tadeusz Marek Krygowski; Michal K. Cyrański; M. Agostinha R. Matos (2009). Aromaticita v heterocyklických sloučeninách. Springer. str. 47–. ISBN 978-3-540-68329-2. Citováno 21. března 2011.
- ^ Pelloni, Stefano; Lazzeretti, Paolo (2007). "Magnetotropicita fosfolu a jeho analogu arsenu". Účty teoretické chemie. 118: 89. doi:10.1007 / s00214-007-0247-0.
- ^ Braye, E. H .; Hubel, W .; Caplier, I. (1961). „Nové nenasycené heterocyklické systémy. Journal of the American Chemical Society. 83: 4406. doi:10.1021 / ja01482a026.
- ^ C. W. Bird; Gordon William Henry Cheeseman (31. prosince 1973). Aromatická a heteroatomová chemie. Royal Society of Chemistry. str. 23–. ISBN 978-0-85186-753-3. Citováno 23. března 2011.
- ^ Gottfried Märkl a Hagen Hauptmann (1972). „Neobvyklá náhrada v prstenu Arsole“ (PDF). Angewandte Chemie International Edition v angličtině. 11: 441. doi:10,1002 / anie.197204411.
- ^ Märkl, G (1983). "Synthese von 1-fenyl-2,5-diaryl (dialkyl) -arsol; umsetzung der arsole mit alkalimetallen und lithiumorganylen". Journal of Organometallic Chemistry. 249: 335. doi:10.1016 / S0022-328X (00) 99433-6.