Proteinový O-GlcNAcase - Protein O-GlcNAcase
| OGA | |||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
 | |||||||||||||||||||||||||
| |||||||||||||||||||||||||
| Identifikátory | |||||||||||||||||||||||||
| Aliasy | OGA, MEA5, NCOAT, meningiom exprimovaný antigen 5 (hyaluronidáza), MGEA5, O-GlcNAcase | ||||||||||||||||||||||||
| Externí ID | OMIM: 604039 MGI: 1932139 HomoloGene: 8154 Genové karty: OGA | ||||||||||||||||||||||||
| |||||||||||||||||||||||||
| |||||||||||||||||||||||||
| |||||||||||||||||||||||||
| |||||||||||||||||||||||||
| Ortology | |||||||||||||||||||||||||
| Druh | Člověk | Myš | |||||||||||||||||||||||
| Entrez | |||||||||||||||||||||||||
| Ensembl | |||||||||||||||||||||||||
| UniProt | |||||||||||||||||||||||||
| RefSeq (mRNA) | |||||||||||||||||||||||||
| RefSeq (protein) | |||||||||||||||||||||||||
| Místo (UCSC) | Chr 10: 101,78 - 101,82 Mb | Chr 19: 45,75 - 45,78 Mb | |||||||||||||||||||||||
| PubMed Vyhledávání | [3] | [4] | |||||||||||||||||||||||
| Wikidata | |||||||||||||||||||||||||
| |||||||||||||||||||||||||
Protein Ó-GlcNAcase (ES 3.2.1.169, OGA, glykosid hydroláza Ó-GlcNAcase, Ó-GlcNAcase, BtGH84, Ó-GlcNAc hydroláza) je enzym s systematické jméno (protein) -3-Ó-(N-acetyl-D-glukosaminyl) -L-serin / threonin N-acetylglukosaminylhydroláza.[5][6][7][8][9] OGA je kódován MGEA5 gen. Tento enzym katalýzy odstranění Ó-GlcNAc posttranslační modifikace v následujícím chemická reakce:
- [protein] -3-Ó-(N-acetyl-β-D-glukosaminyl) -L-serin + H2O ⇌ [protein] -L-serin + N-acetyl-D-glukosamin
- [protein] -3-Ó-(N-acetyl-β-D-glukosaminyl) -L-threonin + H2O ⇌ [protein] -L-treonin + N-acetyl-D-glukosamin
Nomenklatura
| Protein Ó-GlcNAcase | |||||||||
|---|---|---|---|---|---|---|---|---|---|
 | |||||||||
| Identifikátory | |||||||||
| EC číslo | 3.2.1.169 | ||||||||
| Databáze | |||||||||
| IntEnz | IntEnz pohled | ||||||||
| BRENDA | Vstup BRENDA | ||||||||
| EXPASY | Pohled NiceZyme | ||||||||
| KEGG | Vstup KEGG | ||||||||
| MetaCyc | metabolická cesta | ||||||||
| PRIAM | profil | ||||||||
| PDB struktur | RCSB PDB PDBe PDBsum | ||||||||
| |||||||||
Jiná jména zahrnují:
- Jaderná cytoplazmatická Ó-GlcNAcase a acetyltransferáza
Izoformy
Tam jsou tři izoformy z Ó-GlcNAcase u lidí, kteří byli identifikováni. Plná délka Ó-GlcNAcase (fOGA), nejkratší Ó-GlcNAcase (sOGA) a varianta OGA (vOGA). Lidský gen OGA je schopen produkovat dvě oddělené transkripce, z nichž každá je schopná kódovat jinou izoformu OGA. Dlouhý izoformový gen kóduje fOGA, bifunkční enzym, který primárně sídlí v cytoplazmě. Naproti tomu vOGA sídlí v jádru. Všechny tři izoformy však vykazují glykosid hydroláza aktivita.[10]
Homology
Protein Ó-GlcNAcases patří do rodiny glykosidhydrolázy 84 klasifikace sacharidů na aktivní enzymy.[11] Homology existují u jiných druhů jako Ó-GlcNAcase je konzervován u vyšších eukaryotických druhů. Při párovém vyrovnání mají lidé 55% homologii Drosophilia a 43% s C. elegans. Drosophilia a C. elegans sdílet 43% homologie. U savců je OGA sekvence ještě více konzervovaná. Myš a člověk mají 97,8% homologii. OGA však nesdílí významnou homologii s jinými proteiny. Krátké úseky přibližně 200 aminokyselin v OGA však mají homologii s některými proteiny, jako je hyaluronidáza, domnělá acetyltransferáza, eukaryotický translační faktor 1γ a polypeptid 11-1.[12]
Reakce
Protein Ó-GlcNAcylace
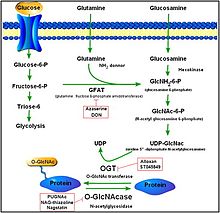
Ó-GlcNAcylace je forma glykosylace, místně specifické enzymatické přidání sacharidů k proteinům a lipidům. Tato forma glykosylace je s Ó-vázaný β-N-acetylglukosamin nebo β-Óvázaný 2-acetamido-2-deoxy-D-glykopyranóza (Ó-GlcNAc). V této formě je jediný cukr (β-N-acetylglukosamin) se přidává k serinovým a threoninovým zbytkům jaderných nebo cytoplazmatických proteinů. Tuto glykosylaci serinu a threoninu řídí dva konzervované enzymy: Ó-GlcNAc transferáza (OGT) a Ó-GlcNAcase (OGA). Zatímco OGT katalyzuje přidání Ó-GlcNAc na serin a threonin, OGA katalyzuje hydrolytické štěpení Ó-GlcNAc z post-přechodně modifikovaných proteinů.[13]
OGA je členem rodiny hexosaminidázy. Na rozdíl od lysozomálních hexosaminidáz je však aktivita OGA nejvyšší při neutrálním pH (přibližně 7) a lokalizuje se hlavně na cytosol. OGA a OGT jsou syntetizovány ze dvou konzervovaných genů (OGA je kódován pomocí MGEA5) a jsou exprimovány v celém lidském těle s vysokými hladinami v mozku a slinivce břišní. Výrobky z Ó-GlcNAc a samotný proces hraje roli v embryonálním vývoji, mozkové aktivitě, produkci hormonů a mnoha dalších aktivitách.[14][15]
Více než 600 proteinů je cílem Ó-GlcNAcylace. Zatímco funkční účinky Ó-GlcNAc modifikace není zcela známa, je známo, že Ó-GlcNAc modifikace ovlivňuje mnoho buněčných aktivit, jako je metabolismus lipidů / sacharidů a biosyntéza hexosaminu. Modifikované proteiny mohou modulovat různé následné signální dráhy ovlivněním transkripce a proteomických aktivit.[16]
Mechanismus a inhibice
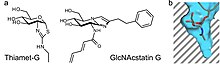
OGA katalyzuje ÓHydrolýza GlcNAc pomocí oxazolin reakční meziprodukt.[17] Stabilní sloučeniny, které napodobují reakční meziprodukt, mohou působit jako selektivní inhibitory enzymů. Thiazolin deriváty GlcNAc lze použít jako reakční meziprodukt. Příkladem je Thiamet-G, jak je znázorněno vpravo. Druhá forma inhibice může nastat z mimikry přechodového stavu. Rodina inhibitorů GlcNAcstatin využívá tento mechanismus k inhibici aktivity OGA. U obou typů inhibitorů lze OGA vybrat kromě obecných lysozomálních hexosaminidáz prodloužením C2 substituentu v jejich chemické struktuře. To využívá výhod hluboké kapsy v aktivním místě OGA, které jí umožňují vázat analogy GlcNAc.[18]
Existuje potenciál pro regulaci Ó-GlcNAcase pro léčbu Alzheimerova choroba. Když tau protein v mozku je hyperfosforylovaný, neurofibrilární spleti formy, které jsou patologickým znakem neurodegenerativních onemocnění, jako je Alzheimerova choroba. Za účelem léčby tohoto stavu je OGA zaměřen na inhibitory, jako je Thiamet-G, aby se zabránilo Ó-GlcNAc před odstraněním z tau, což pomáhá zabránit fosforylaci tau.[19]
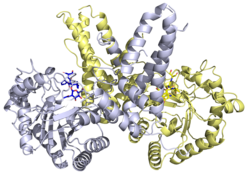
Struktura
Rentgenové struktury jsou k dispozici pro řadu Ó-GlcNAcase proteiny. Rentgenová struktura člověka Ó-GlcNAcase v komplexu s Thiamet-G identifikoval strukturní základ inhibice enzymu.[20]
Viz také
Reference
- ^ A b C GRCh38: Vydání souboru 89: ENSG00000198408 - Ensembl, Květen 2017
- ^ A b C GRCm38: Vydání souboru 89: ENSMUSG00000025220 - Ensembl, Květen 2017
- ^ „Human PubMed Reference:“. Národní centrum pro biotechnologické informace, Americká národní lékařská knihovna.
- ^ „Myš PubMed Reference:“. Národní centrum pro biotechnologické informace, Americká národní lékařská knihovna.
- ^ Wells L, Gao Y, Mahoney JA, Vosseller K, Chen C, Rosen A, Hart GW (leden 2002). „Dynamická O-glykosylace jaderných a cytosolických proteinů: další charakterizace nukleocytoplazmatické beta-N-acetylglukosaminidázy, případ O-GlcNA“. The Journal of Biological Chemistry. 277 (3): 1755–61. doi:10,1074 / jbc.M109656200. PMID 11788610.
- ^ Cetinbaş N, Macauley MS, Stubbs KA, Drapala R, Vocadlo DJ (březen 2006). „Identifikace Asp174 a Asp175 jako klíčových katalytických zbytků lidské O-GlcNAcase funkční analýzou místně zaměřených mutantů“. Biochemie. 45 (11): 3835–44. doi:10.1021 / bi052370b. PMID 16533067.
- ^ Dennis RJ, Taylor EJ, Macauley MS, Stubbs KA, Turkenburg JP, Hart SJ a kol. (Duben 2006). "Struktura a mechanismus bakteriální beta-glukosaminidázy s aktivitou O-GlcNAcase". Přírodní strukturní a molekulární biologie. 13 (4): 365–71. doi:10.1038 / nsmb1079. PMID 16565725. S2CID 9239755.
- ^ Kim EJ, Kang DO, Love DC, Hanover JA (červen 2006). „Enzymatická charakterizace izoforem O-GlcNAcase s použitím fluorogenního GlcNAc substrátu“. Výzkum sacharidů. 341 (8): 971–82. doi:10.1016 / j.carres.2006.03.004. PMID 16584714.
- ^ Dong DL, Hart GW (červenec 1994). „Čištění a charakterizace O-GlcNAc selektivní N-acetyl-beta-D-glukosaminidázy z cytosolu potkaní sleziny“. The Journal of Biological Chemistry. 269 (30): 19321–30. PMID 8034696.
- ^ Li J, Huang CL, Zhang LW, Lin L, Li ZH, Zhang FW, Wang P (červenec 2010). "Isoformy lidského O-GlcNAcase vykazují výrazné katalytické účinnosti". Biochemie. Biokhimiia. 75 (7): 938–43. doi:10.1134 / S0006297910070175. PMID 20673219. S2CID 2414800.
- ^ Greig, Ian; Vocadlo, Davide. "Glykosid Hydroláza Rodina 84". Cazypedia. Citováno 28. března 2017.
- ^ Gao Y, Wells L, Comer FI, Parker GJ, Hart GW (březen 2001). „Dynamická O-glykosylace jaderných a cytosolických proteinů: klonování a charakterizace neutrální cytosolické beta-N-acetylglukosaminidázy z lidského mozku“. The Journal of Biological Chemistry. 276 (13): 9838–45. doi:10,1074 / jbc.M010420200. PMID 11148210.
- ^ Lima VV, Rigsby CS, Hardy DM, Webb RC, Tostes RC (2009). „O-GlcNAcylace: nový posttranslační mechanismus ke změně vaskulární buněčné signalizace ve zdraví a nemoci: zaměření na hypertenzi“. Journal of the American Society of Hypertension. 3 (6): 374–87. doi:10.1016 / j.jash.2009.09.004. PMC 3022480. PMID 20409980.
- ^ Förster S, Welleford AS, Triplett JC, Sultana R, Schmitz B, Butterfield DA (září 2014). „Zvýšené hladiny O-GlcNAc korelují se sníženými hladinami O-GlcNAc v mozku Alzheimerovy choroby“. Biochimica et Biophysica Acta (BBA) - Molekulární základ choroby. 1842 (9): 1333–9. doi:10.1016 / j.bbadis.2014.05.014. PMC 4140188. PMID 24859566.
- ^ Shafi R, Iyer SP, Ellies LG, O'Donnell N, Marek KW, Chui D a kol. (Květen 2000). „Gen O-GlcNAc transferázy spočívá na chromozomu X a je nezbytný pro životaschopnost embryonálních kmenových buněk a myší ontogenezi“. Sborník Národní akademie věd Spojených států amerických. 97 (11): 5735–9. doi:10.1073 / pnas.100471497. PMC 18502. PMID 10801981.
- ^ Love DC, Ghosh S, Mondoux MA, Fukushige T, Wang P, Wilson MA a kol. (Duben 2010). „Dynamické cyklování O-GlcNAc u promotorů genů Caenorhabditis elegans regulujících dlouhověkost, stres a imunitu“. Sborník Národní akademie věd Spojených států amerických. 107 (16): 7413–8. doi:10.1073 / pnas.0911857107. PMC 2867743. PMID 20368426.
- ^ Dennis RJ, Taylor EJ, Macauley MS, Stubbs KA, Turkenburg JP, Hart SJ a kol. (Duben 2006). "Struktura a mechanismus bakteriální beta-glukosaminidázy s aktivitou O-GlcNAcase". Přírodní strukturní a molekulární biologie. 13 (4): 365–71. doi:10.1038 / nsmb1079. PMID 16565725. S2CID 9239755.
- ^ Alonso J, Schimpl M, van Aalten DM (prosinec 2014). „O-GlcNAcase: promiskuitní hexosaminidáza nebo klíčový regulátor signalizace O-GlcNAc?“. The Journal of Biological Chemistry. 289 (50): 34433–9. doi:10,1074 / jbc.R114,609198. PMC 4263850. PMID 25336650.
- ^ Lim S, Haque MM, Nam G, Ryoo N, Rhim H, Kim YK (srpen 2015). "Monitorování agregace intracelulárního Tau regulované inhibitory OGA / OGT". International Journal of Molecular Sciences. 16 (9): 20212–24. doi:10,3390 / ijms160920212. PMC 4613198. PMID 26343633.
- ^ Roth C, Chan S, Offen WA, Hemsworth GR, Willems LI, King DT a kol. (Červen 2017). „Strukturální a funkční vhled do lidské O-GlcNAcase“. Přírodní chemická biologie. 13 (6): 610–612. doi:10.1038 / nchembio.2358. PMC 5438047. PMID 28346405.
Další čtení
- Nakajima D, Okazaki N, Yamakawa H, Kikuno R, Ohara O, Nagase T (červen 2002). „Konstrukce klonů cDNA připravených na expresi pro geny KIAA: ruční kurace 330 klonů cDNA KIAA“. Výzkum DNA. 9 (3): 99–106. doi:10.1093 / dnares / 9.3.99. PMID 12168954.
- Ishikawa K, Nagase T, Suyama M, Miyajima N, Tanaka A, Kotani H a kol. (Červen 1998). „Predikce kódujících sekvencí neidentifikovaných lidských genů. X. Kompletní sekvence 100 nových klonů cDNA z mozku, které mohou kódovat velké proteiny in vitro“. Výzkum DNA. 5 (3): 169–76. doi:10.1093 / dnares / 5.3.169. PMID 9734811.
- Gao Y, Wells L, Comer FI, Parker GJ, Hart GW (březen 2001). „Dynamická O-glykosylace jaderných a cytosolických proteinů: klonování a charakterizace neutrální cytosolické beta-N-acetylglukosaminidázy z lidského mozku“. The Journal of Biological Chemistry. 276 (13): 9838–45. doi:10,1074 / jbc.M010420200. PMID 11148210.
- Comtesse N, Maldener E, Meese E (květen 2001). „Identifikace jaderné varianty MGEA5, cytoplazmatické hyaluronidázy a beta-N-acetylglukosaminidázy“. Sdělení o biochemickém a biofyzikálním výzkumu. 283 (3): 634–40. doi:10.1006 / bbrc.2001.4815. PMID 11341771.
- Wells L, Gao Y, Mahoney JA, Vosseller K, Chen C, Rosen A, Hart GW (leden 2002). „Dynamická O-glykosylace jaderných a cytosolických proteinů: další charakterizace nukleocytoplazmatické beta-N-acetylglukosaminidázy, případ O-GlcNA“. The Journal of Biological Chemistry. 277 (3): 1755–61. doi:10,1074 / jbc.M109656200. PMID 11788610.
- Farook VS, Bogardus C, Prochazka M (2003). „Analýza MGEA5 na 10q24.1-q24.3 kódující N-acetylglukosaminidázu vázanou na beta-O jako kandidátský gen pro diabetes mellitus 2. typu u indiánů Pima“. Molekulární genetika a metabolismus. 77 (1–2): 189–93. doi:10.1016 / S1096-7192 (02) 00127-0. PMID 12359146.
- Beausoleil SA, Jedrychowski M, Schwartz D, Elias JE, Villén J, Li J a kol. (Srpen 2004). „Rozsáhlá charakterizace jaderných fosfoproteinů z buněk HeLa“. Sborník Národní akademie věd Spojených států amerických. 101 (33): 12130–5. doi:10.1073 / pnas.0404720101. PMC 514446. PMID 15302935.
- Ballif BA, Villén J, Beausoleil SA, Schwartz D, Gygi SP (listopad 2004). „Fosfoproteomická analýza vyvíjejícího se myšího mozku“. Molekulární a buněčná proteomika. 3 (11): 1093–101. doi:10,1074 / mcp.M400085-MCP200. PMID 15345747.
- Toleman C, Paterson AJ, Whisenhunt TR, Kudlow JE (prosinec 2004). „Charakterizace domény histon acetyltransferázy (HAT) bifunkčního proteinu s aktivovatelnými O-GlcNAcase a HAT aktivitami“. The Journal of Biological Chemistry. 279 (51): 53665–73. doi:10,1074 / jbc.M410406200. PMID 15485860.
- Whisenhunt TR, Yang X, Bowe DB, Paterson AJ, Van Tine BA, Kudlow JE (červen 2006). „Narušení komplexu enzymů regulujících O-GlcNAcylaci blokuje signalizaci a vývoj“. Glykobiologie. 16 (6): 551–63. doi:10.1093 / glycob / cwj096. PMID 16505006.
- Toleman C, Paterson AJ, Kudlow JE (květen 2006). Msgstr "Umístění a charakterizace aktivního místa O-GlcNAcase". Biochimica et Biophysica Acta (BBA) - Obecné předměty. 1760 (5): 829–39. doi:10.1016 / j.bbagen.2006.01.017. PMID 16517082.
- Cameron EA, Martinez-Marignac VL, Chan A, Valladares A, Simmonds LV, Wacher N a kol. (2007). „Polymorfismus MGEA5-14 a diabetes typu 2 v Mexico City“. American Journal of Human Biology. 19 (4): 593–6. doi:10.1002 / ajhb.20639. PMID 17546623. S2CID 13712358.
externí odkazy
- Protein + O-GlcNAcase v americké národní lékařské knihovně Lékařské předměty (Pletivo)