Neproteinogenní aminokyseliny - Non-proteinogenic amino acids

v biochemie, nekódovaný nebo neproteinogenní aminokyseliny jsou ty, které nejsou přirozeně kódovány nebo se nenacházejí v genetickém kódu žádného organismu. Přes použití pouze 22 aminokyselin (21 u eukaryot[poznámka 1]) translačním aparátem k sestavení proteinů ( proteinogenní aminokyseliny ) je známo, že se v bílkovinách přirozeně vyskytuje více než 140 aminokyselin a tisíce dalších se mohou vyskytovat v přírodě nebo mohou být syntetizovány v laboratoři.[1]Mnoho neproteinogenních aminokyselin je pozoruhodné, protože jsou;
- meziprodukty v biosyntéze,
- posttranslačně vytvořený v proteinech,
- mají fyziologickou roli (např. složky bakteriální buněčné stěny, neurotransmitery a toxiny ),
- přírodní nebo člověkem vyrobené farmakologické sloučeniny,
- přítomné v meteoritech a v prebiotických experimentech (např. Miller – Ureyův experiment ).
Definice negací
Technicky každá organická sloučenina s amin (-NH2) a a karboxylová kyselina (-COOH) funkční skupina je aminokyselina. Proteinogenní aminokyseliny jsou malou podskupinou této skupiny, která má centrální atom uhlíku (α- nebo 2-) nesoucí aminoskupinu, karboxylovou skupinu, boční řetěz a a-vodík levo konformace, s výjimkou glycin, který je achirál, a prolin, jehož aminová skupina je sekundární amin, a je proto často označována jako imino kyselina z tradičních důvodů, i když ne imino.
Genetický kód kóduje 20 standardních aminokyselin pro začlenění do proteinů během překlad. Existují však dvě extra proteinogenní aminokyseliny: selenocystein a pyrrolysin. Tyto nestandardní aminokyseliny nemají vyhrazený kodon, ale přidávají se místo stop kodonu, pokud je přítomna specifická sekvence, kodon UGA a Prvek SECIS pro selenocystein,[2] UAG PYLIS downstream sekvence pro pyrrolysin.[3]Všechny ostatní aminokyseliny se označují jako „neproteinogenní“.

Selenocystein. Tato aminokyselina obsahuje na svém β-uhlíku selenolovou skupinu

Pyrrolysin. Tato aminokyselina vzniká spojením s e-aminoskupinou lysinu a karboxylovaným pyrrolinovým kruhem
Existuje několik skupin aminokyselin:[4]
- 20 standardních aminokyselin
- 22 proteinogenních aminokyselin
- více než 80 aminokyselin vytvořených abioticky ve vysokých koncentracích
- asi 900 je produkováno přirozenými cestami
- více než 118 upravených aminokyselin bylo vloženo do proteinu
Tyto skupiny se překrývají, ale nejsou totožné. Všech 22 proteinogenních aminokyselin je biosyntetizováno organismy a některé, ale ne všechny, jsou také abiotické (nacházejí se v prebiotických experimentech a meteoritech). Některé přírodní aminokyseliny, jako např norleucin, jsou nesprávně začleněny translačně do proteinů kvůli nevěře v proces syntézy proteinů. Mnoho aminokyselin, jako např ornitin, jsou metabolické meziprodukty produkované biosynteticky, ale nejsou translačně inkorporovány do proteinů. Posttranslační modifikace aminokyselinových zbytků v proteinech vede k tvorbě mnoha bílkovinných, ale neproteinogenních aminokyselin. Další aminokyseliny se nacházejí pouze v abiotických směsích (např. A-methylnorvalin). Více než 30 nepřirozených aminokyselin bylo vloženo translačně do proteinu v inženýrských systémech, přesto nejsou biosyntetické.[4]
Nomenklatura
Navíc k Systém číslování IUPAC k rozlišení různých uhlíků v organické molekule postupným přiřazením čísla každému uhlíku, včetně uhlíku tvořícího karboxylovou skupinu, mohou být uhlíky podél postranního řetězce aminokyselin také označeny řeckými písmeny, kde α-uhlík je centrální chirální uhlík s karboxylovou skupinou, postranním řetězcem a v a-aminokyselinách s aminoskupinou - uhlík v karboxylových skupinách se nepočítá.[5] (V důsledku toho názvy IUPAC mnoha neproteinogenních α-aminokyselin začínají 2-amino- a končí v -kyselina kyselina.)
Přírodní, ale ne L-α-aminokyseliny
Většina přírodních aminokyselin jsou α-aminokyseliny v L konformaci, ale existují určité výjimky.
Ne-alfa

Některé ne-α aminokyseliny existují v organismech. V těchto strukturách se aminová skupina vytěsnila dále od konce karboxylové kyseliny v molekule aminokyseliny. Tak má β aminokyselina aminoskupinu navázanou na druhý uhlík a γ aminokyselina ji má na třetím. Mezi příklady patří β-alanin, GABA, a δ-kyselina aminolevulinová.

β-alanin: aminokyselina produkovaná aspartát 1-dekarboxyláza a předchůdce koenzym A[6] a peptidy karnosin a anserin.
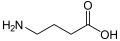
Kyselina y-aminomáselná (GABA): neurotransmiter u zvířat.

Kyselina 4-aminobenzoová (PABA): meziprodukt v folát biosyntéza
Důvod, proč se α-aminokyseliny používají v bílkovinách, souvisí s jejich frekvencí v meteoritech a prebiotických experimentech.[7][původní výzkum? ] Počáteční spekulace o škodlivých vlastnostech β-aminokyselin z hlediska sekundární struktury[7] se ukázalo jako nesprávné.[8]
D-aminokyseliny
Některé aminokyseliny obsahují opačnou absolutní chiralitu, chemikálie, které nejsou dostupné z normálních ribozomálních translačních / transkripčních strojů. Většina stěn bakteriálních buněk je tvořena peptidoglykan, polymer složený z amino cukrů zesítěných krátkými oligopeptidy přemostěnými mezi sebou. Oligopeptid není syntetizován ribozomálně a obsahuje několik zvláštností D-aminokyseliny, obecně D-alanin a D-glutamát. Další zvláštností je, že první je racemizována a PLP -vazebné enzymy (kódované alr nebo homolog dadX), zatímco druhý je racemizován enzymem nezávislým na kofaktoru (MurI). Některé varianty jsou přítomny v Termotoga spp. D-lysin je přítomen a jistě vankomycin jsou přítomny rezistentní bakterie D-serin (vanT gen).[9][10]
U zvířat jsou některé D-aminokyseliny neurotransmitery.[který? ][Citace je zapotřebí ]
Bez vodíku na α-uhlíku
Všechny proteinogenní aminokyseliny mají alespoň jeden vodík na a-uhlíku. Glycin má dva vodíky a všechny ostatní mají jeden vodík a jeden postranní řetězec. Nahrazení zbývajícího vodíku větším substituentem, jako je methylová skupina, narušuje hlavní řetězec proteinu.[7]
U některých hub kyselina a-amino-isomáselná se vyrábí jako prekurzor peptidů, z nichž některé vykazují antibiotické vlastnosti.[11] Tato sloučenina je podobná alaninu, ale místo vodíku má na a-uhlíku další methylovou skupinu. Je tedy achirální. Další sloučenina podobná alaninu bez a-vodíku je dehydroalanin, které mají methylenový postranní řetězec. Je to jeden z několika přirozeně se vyskytujících dehydroaminokyseliny.

alanin

kyselina aminoisomáselná

dehydroalanin
Dvojitá stereocentra aminokyselin
Podskupina L-a-aminokyselin je nejednoznačná, pokud jde o to, který ze dvou konců je a-uhlík. V bílkovinách a cystein zbytek může tvořit disulfidovou vazbu s dalším cysteinovým zbytkem, čímž zesíťuje protein. Dva zesítěné cysteiny tvoří a cystin Cystein a methionin se obvykle vyrábějí přímou sulfurylací, ale u některých druhů mohou být produkovány transsulfurace, kde je aktivován homoserin nebo serin je spojen s a cystein nebo homocystein tváření cystathionin Podobná sloučenina je lanthionin, kterou lze považovat za dvě molekuly alaninu spojené prostřednictvím thioetherové vazby a nacházejí se v různých organismech. kyselina djenkolic, rostlinný toxin z fazole jengkol, se skládá ze dvou cysteinů spojených methylenovou skupinou.Kyselina diaminopimelová se používá jako můstek v peptidoglykanu a používá se jako prekurzor lysinu (prostřednictvím jeho dekarboxylace).

cystin
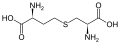
cystathionin

lanthionin
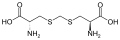
Kyselina djenkolová
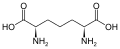
Kyselina diaminopimelová
Prebiotické aminokyseliny a alternativní biochemie
V meteoritech a v prebiotických experimentech (např. Miller – Ureyův experiment ) je nalezeno mnohem více aminokyselin než dvaceti standardních aminokyselin, z nichž některé jsou ve vyšších koncentracích než standardní: předpokládá se, že pokud by život na bázi aminokyselin paralelně vznikl jinde ve vesmíru, ne více než 75% aminokyselin by bylo společné.[7] Nejvýznamnější anomálií je nedostatek kyseliny aminomáselné.
| Podíl aminokyselin vzhledem k glycinu (%) | ||
|---|---|---|
| Molekula | Elektrický výboj | Murchinsonův meteorit |
| Glycin | 100 | 100 |
| Alanin | 180 | 36 |
| Kyselina a-amino-n-máselná | 61 | 19 |
| Norvaline | 14 | 14 |
| Valine | 4.4 | |
| Norleucin | 1.4 | |
| Leucin | 2.6 | |
| Isoleucin | 1.1 | |
| Aloisoleucin | 1.2 | |
| t-leucin | < 0.005 | |
| kyselina a-amino-n-heptanová | 0.3 | |
| Prolin | 0.3 | 22 |
| Kyselina piperová | 0.01 | 11 |
| kyselina α, β-diaminopropionová | 1.5 | |
| kyselina α, y-diaminomáselná | 7.6 | |
| Ornitin | < 0.01 | |
| lysin | < 0.01 | |
| Kyselina asparagová | 7.7 | 13 |
| Kyselina glutamová | 1.7 | 20 |
| Serine | 1.1 | |
| Threonin | 0.2 | |
| Alothreonin | 0.2 | |
| Methionin | 0.1 | |
| Homocystein | 0.5 | |
| Homoserin | 0.5 | |
| β-alanin | 4.3 | 10 |
| kyselina p-amino-n-máselná | 0.1 | 5 |
| Kyselina β-aminoizomáselná | 0.5 | 7 |
| kyselina y-aminomáselná | 0.5 | 7 |
| Kyselina α-aminoizomáselná | 7 | 33 |
| isovalin | 1 | 11 |
| Sarkosin | 12.5 | 7 |
| N-ethylglycin | 6.8 | 6 |
| N-propyl glycin | 0.5 | |
| N-isopropylglycin | 0.5 | |
| N-methylalanin | 3.4 | 3 |
| N-ethylalanin | < 0.05 | |
| N-methyl-p-alanin | 1.0 | |
| N-ethylp-alanin | < 0.05 | |
| isoserin | 1.2 | |
| kyselina a-hydroxy-y-aminomáselná | 17 |
Rovný boční řetěz
Genetický kód byl popsán jako zmrazená nehoda a důvody, proč existuje pouze jedna standardní aminokyselina s přímým řetězcem (alanin), by mohly být jednoduše nadbytečné s valinem, leucinem a isoleucinem.[7] Uvádí se však, že aminokyseliny s přímým řetězcem tvoří mnohem stabilnější alfa helixy.[12]

Glycin (vodíkový postranní řetězec)

Alanin (postranní řetězec methyl)

Homoalanin nebo kyselina α-aminomáselná (ethylový postranní řetězec)

Norvalin (n-Propylový postranní řetězec)

Norleucin (n-Butyl postranní řetězec)

Homonorleucin (n-Pentyl postranního řetězce) (zobrazena kyselina heptanová)
Chalkogen
Serine, homoserin O-methyl-homoserin a O-ethyl-homoserin mají postranní řetězec s hydroxymethylem, hydroxyethylem, O-methyl-hydroxymethylem a O-methyl-hydroxyethylem. Zatímco cystein, homocystein, methionin a ethionin vlastnit thiolové ekvivalenty. Ekvivalenty selenolu jsou selenocystein, selenohomocystein, selenomethionin a selenoethionin. Aminokyseliny s dalším chalkogenem dolů se také vyskytují v přírodě: několik druhů, jako je Aspergillus fumigatus, Aspergillus terreus a Penicillium chrysogenum v nepřítomnosti síry, jsou schopny produkovat a inkorporovat se do nich protein telurocystein a telluromethionin.[13]
Hydroxyglycin, aminokyselina s hydroxylovým postranním řetězcem, je vysoce nestabilní[je třeba další vysvětlení ]
Rozšířený genetický kód
Role
V buňkách, zejména autotrofech, se nachází několik neproteinogenních aminokyselin jako metabolické meziprodukty. Navzdory katalytické flexibilitě enzymů vázajících PLP je však mnoho aminokyselin syntetizováno jako ketokyseliny (např. 4-methyl-2-oxopentanoát na leucin) a aminovány v posledním kroku, čímž se udržuje poměrně nízký počet meziproduktů neproteinogenních aminokyselin.
Ornitin a citrulin vyskytují se v močovinový cyklus část aminokyseliny katabolismus (viz. níže).[14]
Kromě primárního metabolismu je několik neproteinogenních aminokyselin prekurzorem nebo konečnou produkcí v sekundárním metabolismu za vzniku malých sloučenin nebo non-ribozomální peptidy (například některé toxiny ).
Posttranslačně zabudován do proteinu
Přestože nejsou genetickým kódem kódovány jako proteinogenní aminokyseliny, některé nestandardní aminokyseliny se v proteinech přesto nacházejí. Ty jsou tvořeny posttranslační modifikace postranních řetězců standardních aminokyselin přítomných v cílovém proteinu. Tyto modifikace jsou často nezbytné pro funkci nebo regulaci proteinu; například v Gama-karboxyglutamát the karboxylace z glutamát umožňuje lepší vazbu vápníkové kationty,[15] a v hydroxyprolin the hydroxylace z prolin je rozhodující pro údržbu pojivové tkáně.[16] Dalším příkladem je vznik hypusin v iniciační faktor překladu EIF5A modifikací lysinového zbytku.[17] Takové modifikace mohou také určit lokalizaci proteinu, např. Přidání dlouhých hydrofobních skupin může způsobit, že se protein váže na fosfolipid membrána.[18]

Kyselina karboxyglutamová. Zatímco kyselina glutamová obsahuje jednu γ-karboxylovou skupinu, kyselina karboxyglutamová dvě.

Hydroxyprolin. Tato iminokyselina se liší od prolinu díky hydroxylové skupině na uhlíku 4.
Existuje několik předběžných důkazů kyselina aminomalonová mohou být přítomny, pravděpodobně nesprávnou inkorporací, v proteinu.[19][20]
Toxické analogy
Několik neproteinogenních aminokyselin je toxických kvůli jejich schopnosti napodobovat určité vlastnosti proteinogenních aminokyselin, jako jsou thialysin. Některé neproteinogenní aminokyseliny jsou neurotoxické napodobováním aminokyselin používaných jako neurotransmitery (tj. Ne pro biosyntézu proteinů), např. Kyselina quisqualová, kanavanin nebo kyselina azetidin-2-karboxylová.[21]Cefalosporin C. má hlavní řetězec kyseliny alfa-aminoadipové (homoglutamát), který je amidován cefalosporinovou skupinou.[22] Penicilamin je terapeutická aminokyselina, jejíž mechanismus účinku není znám.

Thialysin

Kyselina quisqualová
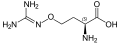
Kanavanin

kyselina azetidin-2-karboxylová

Cefalosporin C.

Penicilamin
Přirozeně se vyskytující cyanotoxiny může také zahrnovat neproteinogenní aminokyseliny. Microcystin a nodularin, například, jsou oba odvozeny od PŘIDAT, p-aminokyselina.
Ne aminokyseliny
Taurin je aminosulfonová kyselina a nikoli aminokyselina, nicméně se to občas považuje za množství potřebné k potlačení auxotrof v určitých organismech (např. kočkách) jsou blíže těm „esenciálním aminokyselinám“ (aminokyselinová auxotrofie) než vitaminům (kofaktorová auxotrofie).
Osmolyty, sarkosin a glycin betain jsou odvozeny od aminokyselin, ale mají sekundární respektive kvartérní amin.
Poznámky
- ^ Plus formylmethionin v eukaryotech s prokaryotickými organelami, jako jsou mitochondrie
Reference
- ^ Ambrogelly, A .; Palioura, S .; Söll, D. (2007). "Přirozené rozšíření genetického kódu". Přírodní chemická biologie. 3 (1): 29–35. doi:10.1038 / nchembio847. PMID 17173027.
- ^ Böck, A .; Forchhammer, K .; Heider, J .; Baron, C. (1991). "Selenoproteinová syntéza: Rozšíření genetického kódu". Trendy v biochemických vědách. 16 (12): 463–467. doi:10.1016/0968-0004(91)90180-4. PMID 1838215.
- ^ Théobald-Dietrich, A .; Giegé, R .; Rudinger-Thirion, J. L. (2005). „Důkazy o existenci vlásenkového prvku odpovědného za inzerci pyrrolysinu závislou na ribosomu do proteinů v mRNA“. Biochimie. 87 (9–10): 813–817. doi:10.1016 / j.biochi.2005.03.006. PMID 16164991.
- ^ A b Lu, Y .; Freeland, S. (2006). „O vývoji standardní abecedy aminokyselin“. Genome Biology. 7 (1): 102. doi:10.1186 / gb-2006-7-1-102. PMC 1431706. PMID 16515719.
- ^ Voet, D .; Voet, J. G. (2004). Biochemie (3. vyd.). John Wiley & Sons. ISBN 978-0471193500.
- ^ Chakauya, E .; Coxon, K. M .; Ottenhof, H. H .; Whitney, H. M .; Blundell, T. L .; Abell, C .; Smith, A. G. (2005). "Biosyntéza pantothenátu ve vyšších rostlinách". Transakce s biochemickou společností. 33 (4): 743–746. doi:10.1042 / BST0330743. PMID 16042590.
- ^ A b C d E Weber, A. L .; Miller, S.L. (1981). "Důvody pro výskyt dvaceti kódovaných proteinových aminokyselin". Journal of Molecular Evolution. 17 (5): 273–284. Bibcode:1981JMolE..17..273W. doi:10.1007 / BF01795749. PMID 7277510.
- ^ Koyack, M. J .; Cheng, R. P. (2006). "Návrh a syntéza β-peptidů s biologickou aktivitou". Proteinový design. Metody v molekulární biologii. 340. str. 95–109. doi:10.1385/1-59745-116-9:95. ISBN 978-1-59745-116-1. PMID 16957334.
- ^ Boniface, A .; Parquet, C .; Arthur, M .; Mengin-Lecreulx, D .; Blanot, D. (2009). „Objasnění struktury peptidoglykanu Thermotoga maritima odhaluje dva nové typy síťování“. Journal of Biological Chemistry. 284 (33): 21856–21862. doi:10.1074 / jbc.M109.034363. PMC 2755910. PMID 19542229.
- ^ Arias, C. A .; Martín-Martinez, M .; Blundell, T. L .; Arthur, M .; Courvalin, P .; Reynolds, P. E. (1999). „Charakterizace a modelování VanT: Nová, na membránu vázaná serinová racemáza z vankomycinu rezistentního Enterococcus gallinarum BM4174“. Molekulární mikrobiologie. 31 (6): 1653–1664. doi:10.1046 / j.1365-2958.1999.01294.x. PMID 10209740.
- ^ Gao, X .; Chooi, Y. H .; Ames, B. D .; Wang, P .; Walsh, C. T .; Tang, Y. (2011). „Biosyntéza fungálních indolových alkaloidů: Genetické a biochemické zkoumání cesty tryptokialaninu v Penicillium aethiopicum“. Journal of the American Chemical Society. 133 (8): 2729–2741. doi:10.1021 / ja1101085. PMC 3045477. PMID 21299212.
- ^ Padmanabhan, S .; Baldwin, R. L. (1991). „Nepolární aminokyseliny s přímým řetězcem jsou dobrými činidly vytvářejícími šroubovice ve vodě“. Journal of Molecular Biology. 219 (2): 135–137. doi:10.1016 / 0022-2836 (91) 90553-I. PMID 2038048.
- ^ Ramadan, S.E .; Razak, A. A .; Ragab, A. M .; El-Meleigy, M. (1989). „Začlenění teluru do aminokyselin a proteinů v houbách tolerovaných vůči teluru“. Výzkum biologických stopových prvků. 20 (3): 225–232. doi:10.1007 / BF02917437. PMID 2484755.
- ^ Curis, E .; Nicolis, I .; Moinard, C .; Osowska, S .; Zerrouk, N .; Bénazeth, S .; Cynober, L. (2005). „Téměř vše o citrulinu u savců“. Aminokyseliny. 29 (3): 177–205. doi:10.1007 / s00726-005-0235-4. PMID 16082501.
- ^ Vermeer, C. (1990). „Proteiny obsahující gama-karboxyglutamát a karboxylázu závislou na vitaminu K“. The Biochemical Journal. 266 (3): 625–636. doi:10.1042 / bj2660625. PMC 1131186. PMID 2183788.
- ^ Bhattacharjee, A; Bansal, M (2005). "Struktura kolagenu: Trojitá šroubovice Madrasu a současný scénář". IUBMB Life. 57 (3): 161–72. doi:10.1080/15216540500090710. PMID 16036578.
- ^ Park, M. H. (2006). „Posttranslační syntéza aminokyseliny odvozené od polyaminu, hypusinu, v eukaryotickém iniciačním faktoru translace 5A (eIF5A)“. Journal of Biochemistry. 139 (2): 161–9. doi:10.1093 / jb / mvj034. PMC 2494880. PMID 16452303.
- ^ Blenis, J; Resh, M. D. (1993). "Subcelulární lokalizace specifikovaná proteinovou acylací a fosforylací". Současný názor na buněčnou biologii. 5 (6): 984–9. doi:10.1016 / 0955-0674 (93) 90081-z. PMID 8129952.
- ^ Copley, S. D .; Frank, E .; Kirsch, W. M .; Koch, T. H. (1992). „Detekce a možný původ kyseliny aminomalonové v proteinových hydrolyzátech“. Analytická biochemie. 201 (1): 152–157. doi:10.1016 / 0003-2697 (92) 90188-D. PMID 1621954.
- ^ Van Buskirk, J. J .; Kirsch, W. M .; Kleyer, D. L .; Barkley, R. M .; Koch, T. H. (1984). "Kyselina aminomalonová: identifikace v Escherichia coli a aterosklerotickém plaku". Sborník Národní akademie věd Spojených států amerických. 81 (3): 722–725. Bibcode:1984PNAS ... 81..722V. doi:10.1073 / pnas.81.3.722. PMC 344907. PMID 6366787.
- ^ Dasuri, K .; Ebenezer, P. J .; Uranga, R. M .; Gavilán, E .; Zhang, L .; Fernandez-Kim, S. O. K .; Bruce-Keller, A. J .; Keller, J. N. (2011). „Toxicita analogu aminokyseliny v primárních kulturách neuronů a astrocytů potkanů: důsledky nesprávného skládání proteinů a regulace TDP-43“. Journal of Neuroscience Research. 89 (9): 1471–1477. doi:10.1002 / jnr.22677. PMC 3175609. PMID 21608013.
- ^ Trown, P. W .; Smith, B .; Abraham, E. P. (1963). "Biosyntéza cefalosporinu C z aminokyselin". The Biochemical Journal. 86 (2): 284–291. doi:10.1042 / bj0860284. PMC 1201751. PMID 13994319.



















