Hydroxyprolin - Hydroxyproline - Wikipedia
 | |
| Jména | |
|---|---|
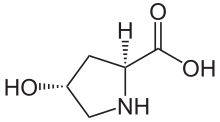
| Název IUPAC (2S,4R) -4-Hydroxypyrrolidin-2-karboxylová kyselina | |
| Identifikátory | |
3D model (JSmol ) | |
| ChemSpider | |
| Informační karta ECHA | 100.000.084 |
| Pletivo | Hydroxyprolin |
PubChem CID | |
| UNII | |
Řídicí panel CompTox (EPA) | |
| |
| |
| Vlastnosti | |
| C5H9NÓ3 | |
| Molární hmotnost | 131.131 g · mol−1 |
Pokud není uvedeno jinak, jsou uvedeny údaje o materiálech v nich standardní stav (při 25 ° C [77 ° F], 100 kPa). | |
| Reference Infoboxu | |
(2S,4R) -4-Hydroxyprolinnebo L-hydroxyprolin (C5H9Ó3N ), je aminokyselina, zkráceně jako Hyp nebo Ó, např., v Proteinová datová banka.
Struktura a objev
V roce 1902 Hermann Emil Fischer izolovaný hydroxyprolin z hydrolyzovaného želatina. V roce 1905 Hermann Leuchs syntetizoval racemickou směs 4-hydroxyprolinu.[1]
Hydroxyprolin se liší od prolin přítomností hydroxylové (OH) skupiny navázané na gama uhlíkový atom.
Výroba a funkce
Hydroxyprolin je produkován hydroxylace aminokyseliny prolin enzymem prolylhydroxyláza po syntéze bílkovin (jako a posttranslační modifikace ). Enzymem katalyzovaná reakce probíhá v lumen z endoplazmatické retikulum. Ačkoli není přímo inkorporován do proteinů, hydroxyprolin obsahuje zhruba 4% všech aminokyselin nalezených ve zvířecí tkáni, což je množství větší než sedm dalších aminokyselin, které jsou translačně inkorporovány.[2]
Zvířata
Kolagen
Hydroxyprolin je hlavní složkou protein kolagen,[3] obsahující zhruba 13,5% savčího kolagenu. Hydroxyprolin a prolin hrají klíčové role pro stabilitu kolagenu.[4] Umožňují ostré kroucení kolagenové šroubovice.[5] V kanonickém kolagenu triády Xaa-Yaa-Gly (kde Xaa a Yaa jsou libovolné aminokyseliny) je prolin zaujímající pozici Yaa hydroxylován za vzniku sekvence Xaa-Hyp-Gly. Tato modifikace prolinového zbytku zvyšuje stabilitu kolagenu trojitá šroubovice. Původně bylo navrženo, že stabilizace byla způsobena molekulami vody tvořícími vodíkovou vazebnou síť spojující prolyl hydroxylové skupiny a karbonylové skupiny hlavního řetězce.[6] Následně se ukázalo, že ke zvýšení stability dochází především stereoelektronické efekty a že hydratace hydroxyprolinových zbytků poskytuje malou nebo žádnou další stabilitu.[7]
Nekolagen
Kromě kolagenu také savčí proteiny elastin a argonaute 2 mají domény podobné kolagenu, ve kterých se tvoří hydroxyprolin. Některé šnečí jedy, konotoxiny obsahují hydroxyprolin, ale chybí jim sekvence podobné kolagenu.[2]
Ukázalo se, že při cílení je zahrnuta hydroxylace prolin Faktor indukovatelný hypoxií (HIF) alfa podjednotka (HIF-1 alfa) pro degradaci proteolýza. Pod normoxie (normální podmínky kyslíku) EGLN1[1] protein hydroxyluje prolin v poloze 564 HIF-1 alfa, což umožňuje ubikvitylace podle supresor nádoru von Hippel-Lindau (pVHL) a následné cílení na proteazom degradace.[8]
Hydroxyprolin se nachází v několika bílkovinách kromě kolagenu. Z tohoto důvodu byl jako indikátor pro stanovení použit obsah hydroxyprolinu kolagen a / nebo želatina množství.
Rostliny
Bohatý na hydroxyprolin glykoproteiny (HRGP) se také nacházejí v rostlinné buněčné stěny.[9] Tyto hydroxyproliny slouží jako připojovací body pro glykanové řetězce které se přidávají jako posttranslační úpravy.[9]
Klinický význam
Prolin vyžaduje hydroxylace kyselina askorbová (vitamín C ). Nejviditelnější první účinky (problémy s dásněmi a vlasy) absence kyselina askorbová u lidí pocházejí z výsledné poruchy v hydroxylace z prolin zbytky kolagen, se sníženým stabilita molekuly kolagenu, což způsobuje kurděje.
Zvýšené hladiny hydroxyprolinu v séru a moči byly také prokázány u Pagetova nemoc.[10]
Ostatní hydroxyproliny
V přírodě existují i jiné hydroxyproliny. Nejpozoruhodnější jsou 2,3-cis-, 3,4-trans-, a 3,4-dihydroxyprolin, který se vyskytuje v rozsivka buněčné stěny[11] a předpokládá se, že budou mít roli v oxid křemičitý depozice. Hydroxyprolin se také nachází ve stěnách oomycety, houboví protisti příbuzní rozsivkám.[12] (2S,4S)-cis-4-Hydroxyprolin se nachází v toxických cyklických peptidech z Amanita houby (např., phalloidin ).[13]
Viz také
Reference
- ^ R.H.A. Plimmer (1912) [1908]. R.H.A. Plimmer; F.G. Hopkins (eds.). Chemické složení proteinů. Monografie o biochemii. Část I. Analýza (2. vyd.). London: Longmans, Green and Co. str. 132. Citováno 18. ledna 2010.
- ^ A b Gorres, Kelly L .; Raines, Ronald T. (duben 2010). "Prolyl 4-hydroxyláza". Kritické recenze v biochemii a molekulární biologii. 45 (2): 106–124. doi:10.3109/10409231003627991. PMC 2841224. PMID 20199358.
- ^ Szpak, Paul (2011). „Chemie a ultrastruktura rybích kostí: důsledky pro taphonomii a stabilní analýzu izotopů“. Journal of Archaeological Science. 38 (12): 3358–3372. doi:10.1016 / j.jas.2011.07.022.
- ^ Nelson, D. L. a Cox, M. M. (2005) Lehninger's Principles of Biochemistry, 4. vydání, W. H. Freeman and Company, New York.
- ^ Brinckmann, J., Notbohm, H. a Müller, P.K. (2005) Collagen, Topics in Current Chemistry 247, Springer, Berlin.
- ^ Bella, J; Eaton, M; Brodsky, B; Berman, HM (1994). "Krystal a molekulární struktura peptidu podobného kolagenu v rozlišení 1,9 A". Věda. 266 (5182): 75–81. doi:10.1126 / science.7695699. PMID 7695699.
- ^ Kotch, F.W .; Guzei, I.A .; Raines, R.T. (2008). "Stabilizace kolagenové trojité šroubovice pomocí O-metylace zbytků hydroxyprolinu". Journal of the American Chemical Society. 130 (10): 2952–2953. doi:10.1021 / ja800225k. PMC 2802593. PMID 18271593.
- ^ Jaakkola, P .; Mole, D.R .; Tian, Y.M .; Wilson, M.I .; Gielbert, J .; Gaskell, S.J .; Kriegsheim, A.V .; Hebestreit, H.F .; et al. (2001). „Cílení HIF-alfa na ubikvititační komplex von Hippel-Lindau pomocí kyslíkem regulované prolylhydroxylace“. Věda. 292 (5516): 468–72. doi:10.1126 / science.1059796. PMID 11292861.
- ^ A b Cassab, Gladys I (1998). "Proteiny rostlinné buněčné stěny". Roční přehled fyziologie rostlin a molekulární biologie rostlin. 49: 281–309. doi:10.1146 / annurev.arplant.49.1.281. PMID 15012236.
- ^ „Bezkolejná učebnice ortopedie“. Wheeless online.
- ^ Nakajima, T .; Volcani, B.E. (1969). „3,4-Dihydroxyprolin: nová aminokyselina v buněčných stěnách rozsivky“. Věda. 164 (3886): 1400–1401. doi:10.1126 / science.164.3886.1400. PMID 5783709.
- ^ Alexopoulos, C.J., Mims C.W. a Blackwell, M. (1996). Úvodní mykologie (4. vydání). New York: John Wiley & Sons. 687–688. ISBN 978-0-471-52229-4.CS1 maint: více jmen: seznam autorů (odkaz)
- ^ Wieland, T. (1986). Peptidy jedovatých hub muchomůrka. Springer.
