Dehydroalanin - Dehydroalanine
 | |
 | |
| Jména | |
|---|---|
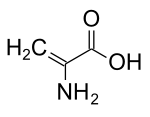
| Název IUPAC Kyselina 2-aminoprop-2-enová | |
| Identifikátory | |
3D model (JSmol ) | |
| ChEBI | |
| ChemSpider | |
| DrugBank | |
| KEGG | |
PubChem CID | |
| UNII | |
Řídicí panel CompTox (EPA) | |
| |
| |
| Vlastnosti | |
| C3H5NE2 | |
| Molární hmotnost | 87,08 g / mol |
Pokud není uvedeno jinak, jsou uvedeny údaje o materiálech v nich standardní stav (při 25 ° C [77 ° F], 100 kPa). | |
| Reference Infoboxu | |
Dehydroalanin (Ca, β-didehydroalanin, a, β-di-dehydroalanin, 2-aminoakrylátnebo 2,3-didehydroalanin) je dehydroaminokyselina. Neexistuje ve své volné formě, ale vyskytuje se přirozeně jako zbytek nacházející se v peptidy z mikrobiální původ.[1] Jako aminokyselinový zbytek je neobvyklý, protože má nenasycené páteř.[2]
Struktura a reaktivita
Jako většina primárních enaminy, dehydroalanin je nestabilní. Dehydroalanin hydrolyzuje na pyruvát.
N-Acylované deriváty dehydroalaninu, jako jsou peptidy a příbuzné sloučeniny, jsou stabilní. Například, methyl-2-acetamidoakrylát je N-acetylovaný derivát esteru. Jako zbytek v peptidu je generován a posttranslační modifikace. Požadované prekurzory jsou serin nebo cystein zbytky, které podléhají ztrátě vody zprostředkované enzymy sirovodík, resp.
Většina aminokyselinových zbytků je nereaktivní nukleofily, ale ty, které obsahují dehydroalanin nebo některé další dehydroaminokyseliny, jsou výjimkou. Tyto jsou elektrofilní v důsledku a, p-nenasycený karbonyl,[2] a může například alkylovat jiné aminokyseliny. Tato aktivita umožnila syntetizovat DHA synteticky lanthionin.
Výskyt
Dehydroalaninový zbytek byl poprvé detekován v nisin, a cyklický peptid s antimikrobiální aktivitou.[2] Dehydroalanin je také přítomen v některých lantibiotika a mikrocystiny.
DHA může být vytvořen z cysteinu nebo serinu jednoduchou bazickou katalýzou bez potřeby enzymu, což se může stát během vaření a zásaditý procesy přípravy jídla. Poté může alkylovat další aminokyselinové zbytky, jako je například lysin, tvořící lysinoalanin křížové odkazy a racemizace původního alaninu. Výsledné bílkoviny mají nižší nutriční kvalitu pro některé druhy, ale vyšší nutriční kvalitu pro jiné druhy. Některé lysinoalaniny mohou také způsobit zvětšení ledvin u potkanů.[3]
Mnoho peptidů obsahujících dehydroalanin je toxických.[2]

Dehydroalaninový zbytek byl dlouho považován za důležitý elektrofilní katalytický zbytek histidin amoniak-lyáza a fenylalanin amoniak-lyáza enzymy, ale u aktivního zbytku byl později nalezen jiný nenasycený derivát alaninu - 3,5-dihydro-5-methyldien-4H-imidazol-4-on - to je ještě více elektrofilní.[4][5]
Reference
- ^ Downs, DM; Ernst, DC (duben 2015). „Od mikrobiologie k biologii rakoviny: rodina proteinů Rid zabraňuje poškození buněk způsobenému endogenně generovanými reaktivními druhy dusíku“. Molekulární mikrobiologie. 96 (2): 211–9. doi:10,1111 / mmi.12945. PMC 4974816. PMID 25620221.
- ^ A b C d Siodłak, Dawid (2015). „α, β-dehydroaminokyseliny v přirozeně se vyskytujících peptidech“. Aminokyseliny. 47 (1): 1–17. doi:10.1007 / s00726-014-1846-4. PMC 4282715. PMID 25323736.
- ^ Friedman, Mendel (1999). "Lysinoalanin v potravinách a v antimikrobiálních bílkovinách". In Jackson, Lauren S .; Knize, Mark G .; Morgan, Jeffrey N. (eds.). Dopad zpracování na bezpečnost potravin. Pokroky v experimentální medicíně a biologii. 459. Springer. str. 145–159. doi:10.1007/978-1-4615-4853-9_10. ISBN 978-1-4615-4853-9. PMID 10335374.
- ^ Rétey, János (2003). „Objev a role methyliden imidazolonu, vysoce elektrofilní protetické skupiny“. Biochimica et Biophysica Acta (BBA) - bílkoviny a proteomika. 1647 (1–2): 179–184. doi:10.1016 / S1570-9639 (03) 00091-8. PMID 12686130.
- ^ Calabrese JC, Jordan DB, Boodhoo A, Sariaslani S, Vannelli T (září 2004). "Krystalová struktura fenylalanin amoniak lyázy: více šroubovicových dipólů zapojených do katalýzy". Biochemie. 43 (36): 11403–16. doi:10.1021 / bi049053 +. PMID 15350127.
