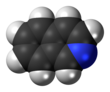
Isochinolin - Isoquinoline
 | |||
| |||
| Jména | |||
|---|---|---|---|
| Preferovaný název IUPAC Isochinolin[1] | |||
| Ostatní jména Benzo [C] pyridin 2-benzazin | |||
| Identifikátory | |||
3D model (JSmol ) | |||
| ChEBI | |||
| ChEMBL | |||
| ChemSpider | |||
| DrugBank | |||
| Informační karta ECHA | 100.003.947 | ||
| Číslo ES |
| ||
PubChem CID | |||
| UNII | |||
Řídicí panel CompTox (EPA) | |||
| |||
| |||
| Vlastnosti | |||
| C9H7N | |||
| Molární hmotnost | 129.162 g · mol−1 | ||
| Vzhled | Bezbarvá olejovitá kapalina; hygroskopické destičky, pokud jsou pevné | ||
| Hustota | 1.099 g / cm3 | ||
| Bod tání | 26–28 ° C (79–82 ° F; 299–301 K) | ||
| Bod varu | 242 ° C (468 ° F; 515 K) | ||
| Kyselost (strK.A) | pKBH+ = 5.14[2] | ||
| −83.9·10−6 cm3/ mol | |||
Pokud není uvedeno jinak, jsou uvedeny údaje o materiálech v nich standardní stav (při 25 ° C [77 ° F], 100 kPa). | |||
| Reference Infoboxu | |||
Isochinolin je heterocyklický aromatický organická sloučenina. Je to strukturní izomer z chinolin. Isochinolin a chinolin jsou benzopyridiny, které se skládají z a benzen prsten spojený s a pyridin prsten. V širším smyslu se termín isochinolin používá k odkazu na isochinolin deriváty. 1-benzylisochinolin je strukturální páteř v přirozeně se vyskytující alkaloidy počítaje v to papaverin. Izochinolinový kruh v těchto přírodních sloučeninách pochází z aromatických látek aminokyselina tyrosin.[3][4][5][6][7][8]
Vlastnosti
Isochinolin je bezbarvý hygroskopický kapalina při teplotách nad bodem tání s penetrací, nepříjemný zápach. Nečisté vzorky se mohou jevit nahnědlé, jak je typické pro dusíkaté heterocykly. Krystalizuje v krevních destičkách, které mají nízkou hladinu rozpustnost ve vodě, ale dobře se rozpustí v ethanol, aceton, diethylether, sirouhlík a další běžné organická rozpouštědla. Je také rozpustný ve zředěném stavu kyseliny jako protonovaný derivát.
Být analogový pyridinu je isochinolin slabý základna, s strK.A ze dne 5.14.[2] Protonuje k vytvoření soli po léčbě silné kyseliny, jako je HCI. Tvoří se adukty s Lewisovy kyseliny, jako je BF3.
Výroba
Izochinolin byl nejprve izolován z uhelný dehet v roce 1885 Hoogewerf a van Dorp.[9] Izolovali to frakční krystalizace síranu kyseliny. Weissgerber vyvinul v roce 1914 rychlejší cestu selektivní těžbou černouhelného dehtu s využitím skutečnosti, že isochinolin je zásadnější než chinolin. Izochinolin lze poté ze směsi izolovat frakční krystalizací síranu kyseliny.
I když lze deriváty isochinolinu syntetizovat několika způsoby, relativně málo přímých metod dodává nesubstituovaný isochinolin. The Pomeranz-Fritschova reakce poskytuje účinnou metodu pro přípravu isochinolinu. Tato reakce používá a benzaldehyd a aminoacetoaldehyd diethylacetal, který v an kyselina střední reagovat za vzniku isochinolinu.[10] Alternativně, benzylamin a a glyoxal acetal lze použít k dosažení stejného výsledku pomocí Schlittler-Müllerovy modifikace.[11]

Pro přípravu různých isochinolinových derivátů je použitelných několik dalších metod.
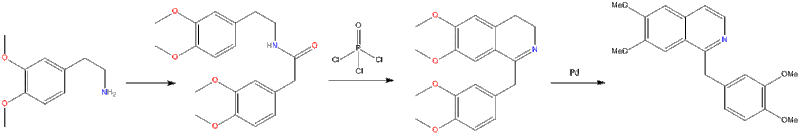
V Bischler – Napieralskiho reakce β-fenyletylamin je acylován a cyklodehydratován Lewisovou kyselinou, jako je fosforylchlorid nebo oxid fosforečný. Výsledný 1-substituovaný 3,4-dihydroisochinolin lze poté dehydrogenovat za použití palladia. Následující reakce Bischler – Napieralski produkuje papaverin.
The Reakce Pictet – Gams a Reakce Pictet – Spenglera jsou obě varianty reakce Bischler – Napieralski. Reakce Pictet – Gams funguje podobně jako reakce Bischler – Napieralski; Jediný rozdíl spočívá v tom, že další hydroxyskupina v reaktantu poskytuje místo pro dehydrataci za stejných reakčních podmínek jako cyklizace za vzniku isochinolinu, spíše než aby byla vyžadována samostatná reakce pro převedení dihydroisochinolinového meziproduktu.

V Reakce Pictet – Spenglera, kondenzace β-fenyletylamin a aldehyd tvoří imin, který prochází cyklizací za vzniku a tetrahydroisochinolin místo dihydroisochinolin. v enzymologie, (S)-noroklaurin syntáza (ES 4.2.1.78 ) je enzym že katalyzuje biologická syntéza Pictect-Spengler:

Intramolekulární aza Wittigovy reakce také poskytují isochinoliny.
Aplikace derivátů
Isochinoliny nacházejí mnoho aplikací, včetně:
- anestetika; dimethisochin je jeden příklad (zobrazený níže).
- antihypertenzní látky, jako je quinapril a debrisochin (vše odvozeno od 1,2,3,4-tetrahydroisochinolinu).
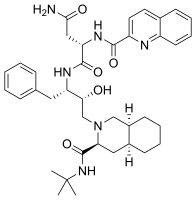
- antiretrovirová činidla, jako jsou sachinavir s isochinolylem funkční skupina, (je uvedeno níže).
- vazodilatátory, známý příklad, papaverin, je uvedeno níže.
Bisbenzylisochinolinium sloučeniny jsou sloučeniny podobné struktury jako tubokurarin. Mají dvě isochinoliniové struktury, spojené a uhlík řetěz, obsahující dva ester vazby.
V lidském těle
Parkinsonova choroba, je pomalu postupující pohybová porucha, je považována za způsobenou jistými neurotoxiny. Volal neurotoxin MPTP (1[N] -methyl-4-fenyl-1,2,3,6-tetrahydropyridin ), předchůdce MPP+, byl nalezen a spojen s Parkinsonovou chorobou v 80. letech. Aktivní neurotoxiny ničí dopaminergní neurony, což vede k parkinsonismu a Parkinsonově chorobě. Několik tetrahydroisochinolin Bylo zjištěno, že deriváty mají stejné neurochemické vlastnosti jako MPTP. Tyto deriváty mohou působit jako prekurzory aktivních neurotoxinů.[12]
Jiná použití
Isochinoliny se používají při výrobě barviva, barvy, insekticidy a antimykotika. Používá se také jako solventní pro extrakce z pryskyřice a terpeny a jako koroze inhibitor.
Viz také
- Naftalen, analog bez atomu dusíku.
Reference
- ^ Nomenklatura organické chemie: Doporučení IUPAC a preferovaná jména 2013 (modrá kniha). Cambridge: Královská společnost chemie. 2014. s. 212. doi:10.1039 / 9781849733069-FP001. ISBN 978-0-85404-182-4.
- ^ A b Brown, H.C. a kol., Baude, E.A. a Náchod, F.C., Stanovení organických struktur fyzikálními metodami, Academic Press, New York, 1955.
- ^ Gilchrist, T.L. (1997). Heterocyklická chemie (3. vyd.). Essex, Velká Británie: Addison Wesley Longman.
- ^ Harris, J .; Papež, W. J. "isoChinolin a isoQuinoline-Reds "Journal of the Chemical Society (1922) svazek 121, str. 1029–1033.
- ^ Katritsky, A.R .; Pozharskii, A.F. (2000). Příručka heterocyklické chemie (2. vyd.). Oxford, Velká Británie: Elsevier.
- ^ Katritsky, A.R .; Rees, C.W .; Scriven, E.F. (Eds.). (1996). Komplexní heterocyklická chemie II: Přehled literatury 1982–1995 (Sv. 5). Tarrytown, NY: Elsevier.
- ^ Nagatsu, T. „Isochinolinové neurotoxiny v mozku a Parkinsonova choroba“ Neuroscience Research (1997), svazek 29, str. 99–111.
- ^ O'Neil, Maryadele J. (vyd.). (2001). Index společnosti Merck (13. vydání). Whitehouse Station, NJ: Merck.
- ^ S. Hoogewerf a W.A. van Dorp (1885) „Sur un isomére de la quinoléine“ (Na izomeru chinolinu), Recueil des Travaux Chemiques des Pays-Bas (Sbírka prací v chemii v Nizozemsku), sv. 4, č. 4, strany 125–129. Viz také: S. Hoogewerf a W.A. van Dorp (1886) „Sur quelques dérivés de l'isoquinoléine“ (O některých derivátech isochinolinu), Recueil des Travaux Chemiques des Pays-Bas, sv. 5, č. 9, strany 305–312.
- ^ Li, J. J. (2014). „Pomeranz – Fritzova reakce“. Reakce na jméno: Sbírka podrobných mechanismů a syntetických aplikací (5. vydání). Springer. 490–491. ISBN 9783319039794.
- ^ Li, J. J. (2014). „Schlittler – Müllerova modifikace“. Reakce na jméno: Sbírka podrobných mechanismů a syntetických aplikací (5. vydání). Springer. str. 492. ISBN 9783319039794.
- ^ Niwa, Toshimitsu; Kajita, Mitsuharu; Nagatsu, Toshiharu (1998). „Izochinolinové deriváty“. Farmakologie endogenních neurotoxinů. s. 3–23. doi:10.1007/978-1-4612-2000-8_1. ISBN 978-1-4612-7375-2.
externí odkazy
. Encyklopedie Britannica. 22 (11. vydání). 1911. str. 758–759.