In vivo magnetická rezonanční spektroskopie - In vivo magnetic resonance spectroscopy
tento článek potřebuje další citace pro ověření. (Květen 2010) (Zjistěte, jak a kdy odstranit tuto zprávu šablony) |
In vivo magnetická rezonanční spektroskopie (PANÍ) je specializovaná technika spojená s magnetická rezonance (MRI).[1][2]
Magnetická rezonanční spektroskopie (MRS), známá také jako spektroskopie nukleární magnetické rezonance (NMR), je neinvazivní analytická technika bez ionizujícího záření, která byla použita ke studiu metabolických změn v mozkové nádory, tahy, záchvat poruchy, Alzheimerova choroba, Deprese a další nemoci postihující mozek. Používá se také ke studiu metabolismu jiných orgánů, jako je svaly. V případě svalů se NMR používá k měření intramyocelulární lipidy obsah (IMCL).[3]
Spektroskopie magnetickou rezonancí je analytická technika, kterou lze použít k doplnění běžnějšího zobrazování magnetickou rezonancí (MRI) při charakterizaci tkáně. Obě techniky obvykle získávají signál z vodíkových protonů (používají se také další endogenní jádra, jako jsou uhlík, dusík a fosfor), ale MRI získává signál primárně z protonů, které se nacházejí ve vodě a tuku, což je přibližně tisíckrát hojněji než molekuly detekované pomocí MRS. Výsledkem je, že MRI často používá větší dostupný signál k výrobě velmi čistých 2D obrazů, zatímco MRS velmi často získává signál pouze z jedné lokalizované oblasti, která se označuje jako „voxel“. MRS lze použít ke stanovení relativních koncentrací a fyzikálních vlastností různých biochemikálií často označovaných jako „metabolity“ kvůli jejich roli v metabolismus.
Sběr dat
Získání MRS skenování je velmi podobné jako u MRI s několika dalšími kroky před získáním dat. Mezi tyto kroky patří:
- Posílení magnetického pole: tento krok slouží k nápravě nehomogenity magnetického pole vyladěním různých pulzů ve směrech x, yaz. Tento krok je obvykle automatizovaný, ale lze jej provést ručně.
- Potlačování vodního signálu: protože molekuly vody obsahují vodík a relativní koncentrace vody k metabolitu je asi 10 000: 1, je vodní signál často potlačen, nebo ve spektrech nebude patrný vrchol metabolitu. Toho je dosaženo přidáním impulsů potlačujících vodu. Nedávné pokroky umožňují protonovou MRS bez potlačení vody.[4]
- Volba spektroskopické techniky: pečlivé plánování měření je důležité v kontextu konkrétního experimentu.
- Single Voxel Spectroscopy (SVS): má minimální prostorové rozlišení přibližně 1 cm3, a má nejčistší spektrum bez nežádoucích artefaktů kvůli malému získanému objemu, což vede ke snadnému překrytí a méně nežádoucím signálům zvenčí voxelu.
- Spektroskopické zobrazování magnetickou rezonancí (MRSI): 2-dimenzionální (nebo 3-dimenzionální) MRS technika, která používá dva / tři směry fázového kódování k vytvoření dvourozměrné mapy spektra. Nevýhody této techniky spočívají v tom, že mít dva / tři fázové směry kódování vyžaduje zdlouhavý čas skenování a větší objem akvizice pravděpodobně zavede artefakty kvůli horšímu shimmingu, netlačené vodě a také inherentní upřímně funkce šíření bodů v důsledku konečného vzorkování k-prostoru, což má za následek, že signál z jednoho voxelu krvácí do všech ostatních.
Kvantifikace dat
Během získávání dat sken získává nezpracovaná data ve formě spekter. Tato surová data musí být kvantifikována, aby bylo dosaženo smysluplného porozumění spektru. Této kvantifikace je dosaženo lineární kombinací.[5] Lineární kombinace je technika, která využívá základní sady. Sady základů jsou transformované spektrální tvary (tj. Posunuty, rozšířeny, fázovány) a získány pomocí numerické simulace nebo experimentálně měřeny ve fantomech. Se základními sadami lze nyní nezpracovaná data kvantifikovat jako naměřené koncentrace různých chemických druhů. K jeho dokončení se používá software. LCModel, komerční software, byl po většinu historie oboru standardním softwarovým kvantifikačním balíčkem. Nyní však existuje mnoho freewarových balíčků pro kvantifikaci: AMARES, AQSES, Gannet, INSPECTOR, jMRUI, TARQUIN a další.[5]
Před lineární kombinací byla pro kvantifikaci dat použita extrakce píku. Toto však již není populární ani doporučené.[5] Špičková extrakce je technika, která integruje oblast pod signálem. Přes svou zdánlivě přímočarost existuje s touto technikou několik zmatků. Jednotlivé použité Lorentzianovy tvary se hlavně nezvětšují tak, aby odpovídaly složitosti spektrálních tvarů metabolitů vázaných na J, a jsou příliš jednoduché na rozeznání mezi překrývajícími se vrcholy.[5]
Pulzní sekvence
Podobně jako MRI používá MRS pulzní sekvence k získání signálu z několika různých molekul ke generování spektra namísto obrazu. V MRS jsou STEAM (metoda stimulace získaného ozvěny) a PRESS (bodově vyřešená spektroskopie) dvě primární použité techniky sekvence pulzů. Z hlediska výhod je STEAM nejlepší pro zobrazování metabolitů s kratším T2 a má nižší SAR, zatímco PRESS má vyšší SNR než STEAM. Kromě STEAM a PRESS jako hlavních sekvencí použitých v in vivo magnetická rezonanční spektroskopie, existují adiabatické pulsy. Adiabatické impulsy vytvářejí rovnoměrné úhly otočení, když je extrémní B1 nehomogenita. Tyto sekvence nám tedy umožňují dosáhnout excitace, při které se dosáhne hledaného B1 necitlivost a rezonance ve vysokofrekvenční cívce a vzorkovaném objektu. Konkrétně adiabatické impulsy řeší problém výpadku signálu, který pochází z různých B1 vzory toku, které jsou výsledkem použitých povrchových vysílacích cívek a použití normálních pulzů.[6] Adiabatické pulsy jsou také užitečné pro omezení špičkového výkonu RF pro excitaci a snížení zahřívání tkáně.
Sekvence prostorové lokalizace
V PRESS jsou dvěma hlavními nevýhodami artefakty zdlouhavého času ozvěny (TE) a posunu chemického posunu (CSD).[7] Zdlouhavý čas ozvěny vyplývá ze skutečnosti, že PRESS používá dva 180 ° impulsy, na rozdíl od STEAM, který používá výhradně 90 ° impulsy. Doba trvání 180 ° pulzů je obecně delší než 90 ° pulzů, protože k převrácení síťového magnetizačního vektoru je zapotřebí více energie, na rozdíl od pouhých 90 °. Artefakty posunu chemického posunu vznikají částečně kvůli méně optimálním profilům výběru řezů. Několik 180 ° pulzů neumožňuje velmi krátké TE, což má za následek méně optimální profil výběru řezu. Vícenásobné 180 ° pulsy navíc znamenají menší šířku pásma a tím větší posunutí chemického posunu. Konkrétně dochází k artefaktům posunu chemického posunu, protože signály s různými chemickými posuny zažívají různé výběry řezů kódované frekvencí a proto nepocházejí ze stejného objemu. Navíc se tento efekt zvyšuje při vyšších silách magnetického pole.
SPECIÁL sestává z prostorově selektivního preexcitačního inverzního pulzu (typicky AFP) následovaného prostorově selektivním buzením a přeostřováním, které jsou obvykle SLR nebo zkrácené sinc pulzy.[5]
SPECIAL je hybrid PRESS a Image-Selected In Vivo Spectroscopy (ISIS). ISIS dosahuje prostorové lokalizace ve třech prostorových dimenzích prostřednictvím série osmi pulzů selektivní preinverze, které lze vhodně umístit tak, aby součet osmi cyklů odstranil veškerý signál mimo požadovanou 3D oblast.[5] SPECIAL získává prostorovou lokalizaci pouze z jedné dimenze s preexcitačními inverzními impulzy (cyklicky zapíná a vypíná každou další dobu opakování [TR]), což z ní dělá dvoustupňovou sekvenci.
Použití předinverzního pulzu k odstranění jednoho přeostřovacího impulzu (ve srovnání s PRESS) je to, co umožňuje SPECIALU dosáhnout krátkého TE, dosahujícího minimálně 2,2 ms na preklinickém skeneru v mozku krysy, zatímco je schopen obnovit plný signál a jako pouhých 6 ms na klinickém skeneru 3T.[5]
Největší nevýhodou SPECIAL a SPECIAL-sLASER je to, že se jedná o dvoutaktová schémata a systematické variace mezi cykly se projeví v jejich rozdílovém spektru. Kontaminace lipidy je zvláště velkým problémem s SPECIAL a byla řešena třemi různými způsoby.
První je přes OVS, který sníží kontaminaci lipidových signálů, které pocházejí z vnějšku, i když to stojí za cenu zvýšení SAR. Druhým není nastavení amplitudy preexcitačního inverzního impulzu na nulu u každého druhého TR, ale místo toho posunutí umístění této roviny ISIS tak, aby vzrušený objem pro vypnutou podmínku byl mimo objekt. Ukázalo se, že to značně snižuje kontaminaci lipidy, spekuluje se, že vznikly z interakce mezi RF pulsem a lipidovými kompartmenty v důsledku neúplné relaxace, magnetizačního přenosu nebo homonukleárního Overhauserova efektu, ačkoli přesný mechanismus zůstává neznámý.[5] Třetím je použití echo-planárního odečtu, který deprimuje magnetizaci zvenčí voxelu, což také prokázalo podstatné snížení lipidových artefaktů. Všechny tři metody lze kombinovat, aby se překonala kontaminace lipidy.[5]
Použití
MRS umožňuje lékařům a výzkumným pracovníkům získat biochemické informace o papírové kapesníky z Lidské tělo neinvazivním způsobem (bez nutnosti a biopsie ), zatímco MRI jim poskytuje pouze informace o struktuře těla (distribuci vody a tuku).[8]
Například, zatímco MRI lze použít jako pomoc při diagnostice rakovina „MRS by mohlo být potenciálně použito k pomoci při získávání informací o agresivitě nádoru.[9] Kromě toho, protože mnoho patologií se jeví jako podobné v diagnostickém zobrazování (jako je radiační nekróza a opakující se nádor po radioterapii), může být v budoucnu použit MRS jako pomůcka pro rozlišení mezi podobně vypadajícími prognózami.
Zařízení MRS lze vyladit (stejně jako a rádio přijímač), aby zachytil signály z různých chemická jádra v těle. Nejběžnější jádra, která se mají studovat, jsou protony (vodík ), fosfor, uhlík, sodík a fluor.
Druhy biochemikálií (metabolity ), které lze studovat, zahrnují cholin - obsahující sloučeniny (které se používají k výrobě buňka membrány), kreatin (chemická látka podílející se na energii metabolismus ), inositol a glukóza (oba cukry ), N-acetylaspartát, a alanin a laktát které jsou u některých nádorů zvýšené.
V současné době se MRS používá hlavně jako nástroj vědci (např. lékaři a biochemici ) pro lékařský výzkum projektů, ale je zřejmé, že má také schopnost dávat lékaři užitečný klinický informace, zejména s objevem, že je lze použít ke zkoumání koncentrace kyselina alfa-hydroxyglutarová, který je přítomen pouze v IDH1 a IDH2 zmutovaný gliomy, který mění předepsaný léčebný režim.
MRS se v současné době používá k vyšetřování řady nemoci v Lidské tělo, zejména rakovina (v mozek, prsa a prostata ), epilepsie, Alzheimerova choroba, Parkinsonova choroba, a Huntingtonova chorea. MRS se používá k diagnostice tuberkulózy hypofýzy.[10]
Rakovina prostaty: V kombinaci s magnetickou rezonancí (MRI) a se stejnými výsledky může potom trojrozměrný MRS předpovědět prevalenci maligní degenerace tkáně prostaty přibližně o 90%. Kombinace obou metod může být užitečná při plánování biopsií a terapií prostaty a také pro sledování úspěšnosti terapie.[11]
Příklad
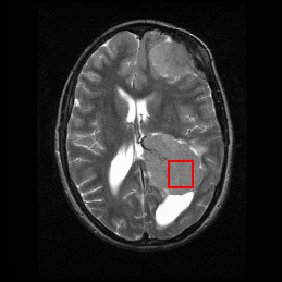
Níže je zobrazen mozkový sken MRI (v axiální letadlo, to je krájení zepředu dozadu a ze strany na stranu skrz hlava ) zobrazující mozkový nádor (meningiom ) vpravo dole. Červené pole ukazuje sledovaný objem, ze kterého byla získána chemická informace pomocí MRS (krychle se 2 cm stranami, která při protnutí 5 mm silného řezu MRI skenu vytváří čtverec).
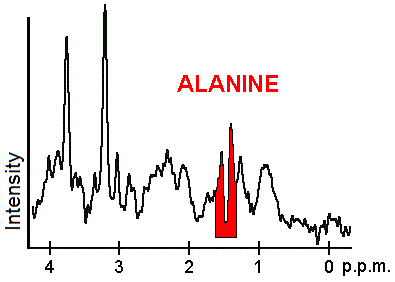
Každý biochemický nebo metabolit má jiný vrchol ve spektru, který se objevuje při známé frekvenci. Píky odpovídající aminokyselině alanin, jsou zvýrazněny červeně (při 1,4 ppm). Toto je příklad druhu biochemických informací, které mohou lékařům pomoci vytvořit jejich diagnóza. Další významné metabolity jsou cholin (3,2 ppm) a kreatin (3,0 ppm).
Aplikace MRS
| Metabolit | Hlavní chemický posun (ppm) | Funkce | aplikace MRS in vivo | Klinické aplikace |
|---|---|---|---|---|
| N-acetyl aspartát (NAA)[12] | 2.01 |
| Marker neuronové hustoty Značka koncentrace |
|
| N-Acetyl Aspartyl Glutamát (NAAG)[13] | 2.04 |
| Součet NAA a NAAG poskytuje spolehlivý odhad molekul obsahujících NAA |
|
| Adenosintrifosfát (ATP)[14] | 4.20 - 4.80, 6.13, 8.22 |
| Normálně zjištěno pomocí 31P NMR spektroskopie, obtížněji detekovatelná 1H NMR spektroskopie |
|
| Alanin (Ala)[15] | 1.40 |
| Žádný |
|
| kyselina y-aminomáselná (GABA)[16] | 3.00 |
| Žádný |
|
| Kyselina askorbová (Asc - vitamin C)[17] | 4.49 |
| Cíl pro hyperpolarizaci 13C aplikace k zobrazení redoxního stavu in vivo |
|
| Kyselina asparagová (Asc)[18] | 3.89 |
| Žádný |
|
| Karnitin[19] | 3.21 |
| Žádný |
|
| Karnosin[20] | 7.09 |
| Neinvazivní metoda pro měření intracelulárního pH pomocí 1H NMR in vivo |
|
| Cholin obsahující sloučeniny (tCho)[21] | 3.20 |
| Žádný |
|
| Kyselina citronová | 2.57, 2.72 |
| Žádný |
|
| Kreatin (Cr) a fosfokreatin (PCr)[22] | 3.03 |
| Žádný |
|
| Deoxymyoglobin (DMb)[23] | 79.00 |
| Žádný |
|
| Glukóza (Glc)[24] | 5.22 |
| Společný cíl v 13C aplikace pro studium metabolických drah |
|
| Glutamát (Glu)[25] | 2.20 - 2.40 |
| Oddělení mezi glutamátem a glutaminem se stává nespolehlivým, i když lze součet (Glx) kvantifikovat s vysokou přesností |
|
| Glutamin (Gln)[26] | 2.20 - 2.40 |
| Oddělení mezi glutamátem a glutaminem se stává nespolehlivým, i když lze součet (Glx) kvantifikovat s vysokou přesností |
|
| Glutathion (GSH)[27] | 3.77 |
| Žádný |
|
| Glycerol[28] | 3.55, 3.64, 3.77 |
| Obtížné pozorovat 1Spektra H NMR kvůli rozšíření čáry |
|
| Glycin[29] | 3.55 |
| Žádný |
|
| Glykogen[30] | 3.83 |
| Rutinně pozorováno v 13C NMR, ale zůstává nepolapitelný 11H NMR |
|
| Histidin[31] | 7.10, 7.80 |
| Stanovte intracelulární pH v 11H NMR |
|
| Homokarnosin[32] | 7.10, 8.10, 3.00 - 4.50 |
| Dobrá volba pro monitorování pH in vivo Vzhledem k překrývání rezonancí GABA a homokarnosinu je rezonance GABA H-4 při 3,01 ppm „celkovou GABA“ představující součet GABA a homokarnosinu. |
|
| β-hydroxybutyrát (BHB)[33] | 1.19 |
| Žádný |
|
| 2-hydroxyglutarát (2HG)[34] | 1.90 |
| Žádný |
|
| myo-Inositol (ml)[35] | 3.52 |
| Žádný |
|
| scyllo-Inositol (SI)[36] | 3.34 |
| Žádný |
|
| Laktát (lak)[37] | 1.31 |
| Žádný |
|
| Lipidy[38] | 0.9 - 1.5 |
| Vysoký výskyt lipidů je jedním z hlavních důvodů 1H NMR mimo mozek zaznamenal omezené aplikace |
|
| Makromolekuly[39] | 0,93 (MM1), 1,24 (MM2), 1,43 (MM3), 1,72 (MM4), 2,05 (MM5), 2,29 (MM6), 3,00 (MM7), 3,20 (MM8), 3,8 - 4,0 (MM9), 4,3 (MM10) ) |
| Významnou částí pozorovaného signálu jsou makromolekulární rezonance, které jsou základem zbytku metabolitů Krátký T2 relaxační časové konstanty účinně eliminují makromolekulární rezonance z dlouhé echo-doby 1H NMR spektra Rozdíl v T1 relaxace mezi metabolity a makromolekulami se používá ke snížení příspěvku extrakraniálního lipidového signálu |
|
| Nikotinamid Adenin Dinukleotid (NAD+)[40] | 9.00 |
| 31P NMR umožňuje detekci obou NAD+ a NADH 1H NMR neumožňuje detekci NADH |
|
| Fenylalanin[41] | 7.30 - 7.45 |
| Žádný |
|
| Pyruvát[42] | 2.36 |
| Pouze sloučenina schválená FDA pro hyperpolarizaci 13C NMR |
|
| Serine[43] | 3.80 - 4.00 |
| Žádný |
|
| Taurin (Tau)[44] | 3.25, 3.42 |
| Žádný |
|
| Threonin (Thr)[45] | 1.32 |
| Žádný |
|
| Tryptofan (TRP)[46] | 7.20, 7.28 |
| Žádný |
|
| Tyrosin (Tyr)[47] | 6.89 - 7.19 |
| Žádný |
|
| Voda[48] | 4.80 |
| Odkazy na vnitřní koncentraci Chemický posun vody používaný k detekci teplotních změn neinvazivně in vivo |
|
v 1H Spektroskopie magnetické rezonance Každý proton lze vizualizovat při konkrétním chemickém posunu (poloha píku podél osy x) v závislosti na jeho chemickém prostředí. Tento chemický posun je diktován sousedními protony v molekule. Proto lze metabolity charakterizovat jejich jedinečnou sadou 1H chemické posuny. Metabolity, které MRS sondy znají (1H) chemické posuny, které byly dříve identifikovány v NMR spektrech. Mezi tyto metabolity patří:
- N-acetyl aspartát (NAA): s hlavním vrcholem rezonance při 2,02 ppm, pokles hladin NAA naznačuje ztrátu nebo poškození neuronální tkáně, které je výsledkem mnoha typů urážek mozku. Jeho přítomnost za normálních podmínek naznačuje neuronální a axonální integritu.
- Cholin: je známo, že s jeho hlavním vrcholem 3,2 ppm je cholin spojován s membránovým obratem nebo se zvyšováním buněčného dělení. Zvýšený cholin naznačuje zvýšení produkce buněk nebo rozpad membrány, což může naznačovat demyelinaci nebo přítomnost maligních nádorů.
- Kreatin a fosfokreatin: s jeho hlavním vrcholem při 3,0 ppm, kreatin označuje metabolismus mozkové energie. Postupná ztráta kreatinu ve spojení s dalšími hlavními metabolity naznačuje smrt tkáně nebo větší smrt buněk v důsledku nemoci, poranění nebo nedostatečného zásobení krví. Zvýšení koncentrace kreatinu může být odpovědí na kraniální mozkové trauma. Absence kreatinu může svědčit o vzácném vrozeném onemocnění.
- Lipidy: s jejich hlavními alifatickými vrcholy umístěnými v rozmezí 0,9–1,5 ppm je patrné zvýšení lipidů, což také svědčí o nekróza. Tato spektra jsou snadno kontaminována, protože lipidy nejsou přítomny pouze v mozku, ale také v jiných biologických tkáních, jako je tuk ve pokožce hlavy a v oblasti mezi pokožkou hlavy a lebkou.
- Laktát: Je systém AX3, jehož výsledkem je dublet (dva symetrické vrcholy) se středem kolem 1,31 ppm a kvartet (čtyři vrcholy s relativní výškou vrcholů 1: 2: 2: 1) se středem kolem 4,10 ppm. Dublet při 1,31 ppm se obvykle kvantifikuje, protože kvarteto může být potlačeno nasycením vodou nebo zakryto zbytkovou vodou. U zdravých subjektů není laktát viditelný, protože jeho koncentrace je nižší než detekční limit MRS; přítomnost tohoto píku však naznačuje glykolýza byla zahájena v prostředí s nedostatkem kyslíku. Mezi tyto příčiny patří ischemie, hypoxie, mitochondriální poruchy a některé typy nádorů.
- Myo-inositol: s jeho hlavním vrcholem 3,56 ppm bylo pozorováno narušení zvýšení Myo-inositolu u pacientů s Alzheimerovou chorobou, demencí a HIV.
- Glutamát a glutamin: tyto aminokyseliny jsou označeny řadou rezonančních vrcholů mezi 2,2 a 2,4 ppm. Hyperamonémie, jaterní encefalopatie jsou dva hlavní stavy, které mají za následek zvýšené hladiny glutaminu a glutamátu. MRS, používaný ve spojení s MRI nebo jinou zobrazovací technikou, lze použít k detekci změn koncentrací těchto metabolitů nebo významně abnormálních koncentrací těchto metabolitů.
- GABA lze detekovat primárně z jeho vrcholů při přibližně 3,0 ppm, ale protože kreatin má silný singlet při 3,0 ppm s přibližně 20násobnou amplitudou, technika, která využívá Spojka J. musí být použit k přesné kvantifikaci GABA. Nejběžnějšími technikami jsou úpravy rozdílu J (MEGA) nebo řešení J (používané v JPRESS)
- Glutathion lze také detekovat z jeho vrcholu na vrcholu při 3,0 ppm, avšak podobně jako GABA musí také používat metodu, která využívá Spojka J. k odstranění překrývajícího se kreatinového signálu.
Omezení MRS
Hlavním omezením MRS je jeho nízký dostupný signál v důsledku nízké koncentrace metabolitů ve srovnání s vodou. Jako takový má ze své podstaty špatné časové a prostorové rozlišení. Žádná alternativní technika však není schopna neinvazivně kvantifikovat metabolismus in vivo, a proto MRS zůstává cenným nástrojem pro výzkum a klinické vědce.
Non-Proton (1H) MRS
31Fosforová magnetická rezonanční spektroskopie
1Klinickým úspěchem H MRS je pouze konkurence 31P MRS. To je z velké části kvůli relativně vysoké citlivosti NMR na fosfor (7% protonů) v kombinaci se 100% přirozeným množstvím.[49]V důsledku toho jsou vysoce kvalitní spektra získána během několika minut. Dokonce i při nízké intenzitě pole se dosáhne velkého rozlišení spekter kvůli relativně velké (~ 30 ppm) disperzi chemického posunu pro fosfáty in vivo. Klinicky vyniká NMR fosforu, protože detekuje všechny metabolity hrající klíčovou roli v energetickém metabolismu tkáně a může nepřímo odvodit intracelulární pH. Fosforovou NMR však čelí hlavně omezený počet metabolitů, které dokáže detekovat.[50]
13Uhlíková magnetická rezonanční spektroskopie
Na rozdíl od fosforové NMR je uhlíková NMR necitlivá technika. To vyplývá ze skutečnosti, že 13C NMR má nízkou abundanci (1,1%) a nízký gyromagnetický poměr uhlíku.[51] Tato nízká hojnost je proto 12C nemá magnetický moment, takže není aktivní NMR, což vede k 13Použití C pro účely spektroskopie. Tuto nízkou citlivost však lze zlepšit oddělením, průměrováním, polarizačním přenosem a většími objemy.[52] I přes nízkou přirozenou hojnost a citlivost 13C, 13C MRS se používá ke studiu několika metabolitů, zejména glykogenu a triglyceridů.[53] Ukázalo se zvláště užitečné při získávání informací o metabolických tocích z 13Prekurzory označené C.[54] V čem je velké překrývání 1H MRS a 13C MRS může získat spektra-moudrý a velký důvod, v kombinaci s 1Proč je vysoká citlivost H MRS? 13C MRS nikdy neviděl široké použití jako 1H MRS. Viz také Hyperpolarizovaný uhlík-13 MRI.
23Sodná magnetická rezonanční spektroskopie
Sodná NMR je nechvalně známá svou nízkou citlivostí (9,2% vzhledem k citlivosti na protony) a nízkou SNR kvůli své nízké koncentraci sodíku (30 - 100 mM), zejména ve srovnání s protony (40 - 50 M).[55] Zájem o sodíkovou NMR však znovu vzbudil nedávný významný nárůst SNR při vysokých magnetických polích, spolu se zlepšeným designem cívek a optimalizovanými pulzními sekvencemi. Existuje velká naděje pro klinický potenciál sodíkových NMR, protože detekce abnormálního intracelulárního sodíku in vivo může mít významný diagnostický potenciál a odhalit nové poznatky o homeostáze tkáňové elektrolýzy.[56]
19Fluorová magnetická rezonanční spektroskopie
Fluorová NMR má vysokou citlivost (82% vzhledem k citlivosti na protony) a 100% přirozenou hojnost.[57] Je však důležité si uvědomit, že žádný endogenní 19Sloučeniny obsahující F se nacházejí v biologických tkáních, a proto signál fluoru pochází z externí referenční sloučeniny. Protože19F se nenachází v biologických tkáních, 19F se nemusí vypořádat s interferencí ze signálů pozadí jako in vivo 1H MRS dělá s vodou, takže je obzvláště silný pro farmakokinetické studie. 1H MRI poskytuje anatomické orientační body 19F MRI / MRS nám umožňuje sledovat a mapovat specifické interakce konkrétních sloučenin.[58] in vivo 19F MRS lze použít ke sledování absorpce a metabolismu léčiv, ke studiu metabolismu anestetik, ke stanovení průtoku krve mozkem a k měření různých parametrů, jako je pH, hladiny kyslíku a koncentrace kovů, pomocí fluorovaných sloučenin („sond“).[59]
Viz také
- Funkční magnetická rezonanční spektroskopie mozku
- Magnetická rezonance
- Magnetizační přenos
- NMR
- NMR spektroskopie
Reference
- ^ Dappert A, Guenther RS, Peyrard S, eds. (1992). In-vivo magnetická rezonanční spektroskopie. Berlín: Springer-Verlag. ISBN 978-3-540-55029-7.
- ^ Jansen JF, Backes WH, Nicolay K, Kooi ME (srpen 2006). „1H MR spektroskopie mozku: absolutní kvantifikace metabolitů“. Radiologie. 240 (2): 318–32. doi:10.1148 / radiol.2402050314. PMID 16864664.
- ^ Preul MC, Caramanos Z, Collins DL, Villemure JG, Leblanc R, Olivier A, Pokrupa R, Arnold DL (březen 1996). "Přesná, neinvazivní diagnostika lidských mozkových nádorů pomocí protonové magnetické rezonanční spektroskopie". Přírodní medicína. 2 (3): 323–5. doi:10,1038 / nm0396-323. PMID 8612232.
- ^ Dong Z (duben 2015). "Proton MRS a MRSI mozku bez potlačení vody". Pokrok ve spektroskopii nukleární magnetické rezonance. 86-87: 65–79. doi:10.1016 / j.pnmrs.2014.12.001. PMID 25919199.
- ^ A b C d E F G h i Landheer, Karl; Schulte, Rolf F .; Treacy, Michael S .; Swanberg, Kelley M .; Juchem, Christoph (2019). "Teoretický popis moderních spektrálních pulzních sekvencí magnetické rezonance 1H ve Vivo". Journal of Magnetic Resonance Imaging. 0. doi:10,1002 / jmri.26846. ISSN 1522-2586. PMID 31273880.
- ^ de Graaf RA, Luo Y, Terpstra M, Garwood M (listopad 1995). Msgstr "Spektrální úpravy s adiabatickými pulsy". Journal of Magnetic Resonance, Series B. 109 (2): 184–93. doi:10.1006 / jmrb.1995.0008. PMID 7582600.
- ^ van der Graaf M (březen 2010). „Spektroskopie magnetické rezonance in vivo: základní metodologie a klinické aplikace“. Evropský biofyzikální časopis. 39 (4): 527–40. doi:10.1007 / s00249-009-0517-r. PMC 2841275. PMID 19680645.
- ^ Gujar SK, Maheshwari S, Björkman-Burtscher I, Sundgren PC (září 2005). "Spektroskopie magnetické rezonance". Journal of Neuro-Ophthalmology. 25 (3): 217–26. doi:10.1097 / 01.wno.0000177307.21081.81. PMID 16148633.
- ^ Fanelli A (2016). „Xenograftové modely: In vivo zobrazování ". Citováno 3. prosince 2017.
- ^ Saini KS, Patel AL, Shaikh WA, Magar LN, Pungaonkar SA (srpen 2007). "Spektroskopie magnetické rezonance u tuberkulómu hypofýzy". Singapore Medical Journal. 48 (8): 783–6. PMID 17657390.
- ^ Mueller-Lisse UG, Scherr M (červen 2003). „1H-MR-Spektroskopie der Prostata: Ein Überblick“ [1H magnetická rezonanční spektroskopie prostaty]. Der Radiologe (v němčině). 43 (6): 481–8. doi:10.1007 / s00117-003-0902-r. PMID 12827263.
- ^ de Graaf, Robin. In Vivo NMR spektroskopie: principy a techniky. Wiley. str. 52–53. ISBN 978-1119382546.
- ^ de Graaf, Robin. In Vivo NMR spektroskopie: principy a techniky. Wiley. str. 53–54. ISBN 978-1119382546.
- ^ de Graaf, Robin. In Vivo NMR spektroskopie: principy a techniky. Wiley. str. 54–55. ISBN 978-1119382546.
- ^ de Graaf, Robin. In Vivo NMR spektroskopie: principy a techniky. Wiley. str. 55–56. ISBN 978-1119382546.
- ^ de Graaf, Robin. In Vivo NMR spektroskopie: principy a techniky. Wiley. 56–57. ISBN 978-1119382546.
- ^ de Graaf, Robin. In Vivo NMR spektroskopie: principy a techniky. Wiley. str. 57–58. ISBN 978-1119382546.
- ^ de Graaf, Robin. In Vivo NMR spektroskopie: principy a techniky. Wiley. p. 58. ISBN 978-1119382546.
- ^ de Graaf, Robin. In Vivo NMR spektroskopie: principy a techniky. Wiley. p. 82. ISBN 978-1119382546.
- ^ de Graaf, Robin. In Vivo NMR spektroskopie: principy a techniky. Wiley. p. 84. ISBN 978-1119382546.
- ^ de Graaf, Robin. In Vivo NMR spektroskopie: principy a techniky. Wiley. str. 59–61. ISBN 978-1119382546.
- ^ de Graaf, Robin. In Vivo NMR spektroskopie: principy a techniky. Wiley. 61–62. ISBN 978-1119382546.
- ^ de Graaf, Robin. In Vivo NMR spektroskopie: principy a techniky. Wiley. p. 87. ISBN 978-1119382546.
- ^ de Graaf, Robin. In Vivo NMR spektroskopie: principy a techniky. Wiley. p. 63. ISBN 978-1119382546.
- ^ de Graaf, Robin. In Vivo NMR spektroskopie: principy a techniky. Wiley. str. 64–65. ISBN 978-1119382546.
- ^ de Graaf, Robin. In Vivo NMR spektroskopie: principy a techniky. Wiley. str. 65–66. ISBN 978-1119382546.
- ^ de Graaf, Robin. In Vivo NMR spektroskopie: principy a techniky. Wiley. s. 66–67. ISBN 978-1119382546.
- ^ de Graaf, Robin. In Vivo NMR spektroskopie: principy a techniky. Wiley. str. 67–68. ISBN 978-1119382546.
- ^ de Graaf, Robin. In Vivo NMR spektroskopie: principy a techniky. Wiley. p. 68. ISBN 978-1119382546.
- ^ de Graaf, Robin. In Vivo NMR spektroskopie: principy a techniky. Wiley. str. 68–69. ISBN 978-1119382546.
- ^ de Graaf, Robin. In Vivo NMR Spectroscopy: Principles and Techniques. Wiley. str. 69–70. ISBN 978-1119382546.
- ^ de Graaf, Robin. In Vivo NMR Spectroscopy: Principles and Techniques. Wiley. p. 70. ISBN 978-1119382546.
- ^ de Graaf, Robin. In Vivo NMR Spectroscopy: Principles and Techniques. Wiley. 70–71. ISBN 978-1119382546.
- ^ de Graaf, Robin. In Vivo NMR Spectroscopy: Principles and Techniques. Wiley. pp. 71–72. ISBN 978-1119382546.
- ^ de Graaf, Robin. In Vivo NMR Spectroscopy: Principles and Techniques. Wiley. 72–73. ISBN 978-1119382546.
- ^ de Graaf, Robin. In Vivo NMR Spectroscopy: Principles and Techniques. Wiley. 72–73. ISBN 978-1119382546.
- ^ de Graaf, Robin. In Vivo NMR Spectroscopy: Principles and Techniques. Wiley. pp. 73–74. ISBN 978-1119382546.
- ^ de Graaf, Robin. In Vivo NMR Spectroscopy: Principles and Techniques. Wiley. p. 87. ISBN 978-1119382546.
- ^ de Graaf, Robin. In Vivo NMR Spectroscopy: Principles and Techniques. Wiley. str. 74–76. ISBN 978-1119382546.
- ^ de Graaf, Robin. In Vivo NMR Spectroscopy: Principles and Techniques. Wiley. p. 76. ISBN 978-1119382546.
- ^ de Graaf, Robin. In Vivo NMR Spectroscopy: Principles and Techniques. Wiley. str. 76–77. ISBN 978-1119382546.
- ^ de Graaf, Robin. In Vivo NMR Spectroscopy: Principles and Techniques. Wiley. str. 77–78. ISBN 978-1119382546.
- ^ de Graaf, Robin. In Vivo NMR Spectroscopy: Principles and Techniques. Wiley. p. 78. ISBN 978-1119382546.
- ^ de Graaf, Robin. In Vivo NMR Spectroscopy: Principles and Techniques. Wiley. str. 79–80. ISBN 978-1119382546.
- ^ de Graaf, Robin. In Vivo NMR Spectroscopy: Principles and Techniques. Wiley. p. 80. ISBN 978-1119382546.
- ^ de Graaf, Robin. In Vivo NMR Spectroscopy: Principles and Techniques. Wiley. p. 80. ISBN 978-1119382546.
- ^ de Graaf, Robin. In Vivo NMR Spectroscopy: Principles and Techniques. Wiley. p. 81. ISBN 978-1119382546.
- ^ de Graaf, Robin. In Vivo NMR Spectroscopy: Principles and Techniques. Wiley. 81–82. ISBN 978-1119382546.
- ^ de Graaf, Robin. In Vivo NMR Spectroscopy: Principles and Techniques. Wiley. pp. 90–93. ISBN 978-1119382546.
- ^ de Graaf, Robin. In Vivo NMR Spectroscopy: Principles and Techniques. Wiley. pp. 90–93. ISBN 978-1119382546.
- ^ de Graaf, Robin. In Vivo NMR Spectroscopy: Principles and Techniques. Wiley. pp. 93–96. ISBN 978-1119382546.
- ^ de Graaf, Robin. In Vivo NMR Spectroscopy: Principles and Techniques. Wiley. pp. 93–96. ISBN 978-1119382546.
- ^ de Graaf, Robin. In Vivo NMR Spectroscopy: Principles and Techniques. Wiley. pp. 93–96. ISBN 978-1119382546.
- ^ de Graaf, Robin. In Vivo NMR Spectroscopy: Principles and Techniques. Wiley. pp. 93–96. ISBN 978-1119382546.
- ^ de Graaf, Robin. In Vivo NMR Spectroscopy: Principles and Techniques. Wiley. pp. 96–102. ISBN 978-1119382546.
- ^ de Graaf, Robin. In Vivo NMR Spectroscopy: Principles and Techniques. Wiley. pp. 96–102. ISBN 978-1119382546.
- ^ de Graaf, Robin. In Vivo NMR Spectroscopy: Principles and Techniques. Wiley. 102–104. ISBN 978-1119382546.
- ^ de Graaf, Robin. In Vivo NMR Spectroscopy: Principles and Techniques. Wiley. 102–104. ISBN 978-1119382546.
- ^ de Graaf, Robin. In Vivo NMR Spectroscopy: Principles and Techniques. Wiley. 102–104. ISBN 978-1119382546.
