Účinky rozpouštědel - Solvent effects
v chemie, rozpouštědlové účinky jsou vliv a solventní o chemické reaktivitě nebo molekulárních asociacích. Rozpouštědla mohou mít vliv na rozpustnost, stabilitu a reakční rychlosti a výběr vhodného rozpouštědla umožňuje termodynamické a kinetické řízení nad chemickou reakcí.
Účinky na rozpustnost
A rozpuštěná látka rozpouští se v a solventní když vytváří příznivé interakce s rozpouštědlem. Tento proces rozpouštění vše závisí na změna volné energie rozpuštěné látky i rozpouštědla. Volná energie solvatace je kombinací několika faktorů.
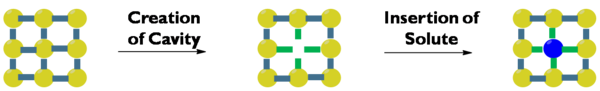
Nejprve musí být v rozpouštědle vytvořena dutina. Vytvoření dutiny bude entropicky a entalpicky nepříznivé, protože se snižuje uspořádaná struktura rozpouštědla a dochází k menšímu počtu interakcí rozpouštědlo-rozpouštědlo. Zadruhé, rozpuštěná látka se musí oddělit od objemové rozpuštěné látky. To je entalpicky nepříznivé, protože interakce mezi solutem a solutem se narušují, ale je to entropicky příznivé. Zatřetí, solut musí obsáhnout dutinu vytvořenou v rozpouštědle. To má za následek příznivé interakce mezi rozpuštěnou látkou a rozpouštědlem a je to také entropicky výhodné, protože směs je více neuspořádaná, než když není rozpuštěná látka a rozpouštědlo smíchány. K rozpuštění často dochází, když jsou interakce rozpouštědla a rozpouštědla podobné interakcím rozpouštědla a rozpouštědla, což znamená termín jako se rozpouští jako.[1] Polární rozpuštěné látky se proto rozpouštějí v polárních rozpouštědlech, zatímco nepolární rozpuštěné látky se rozpouští v nepolárních rozpouštědlech. Neexistuje žádná míra polarity rozpouštědla, a proto lze klasifikaci rozpouštědel založenou na polaritě provádět pomocí různých stupnic. (viz také: Rozpouštědla - klasifikace rozpouštědel)
Účinky na stabilitu
Různá rozpouštědla mohou ovlivnit rovnovážná konstanta reakce diferenciální stabilizací reaktantu nebo produktu. Rovnováha se posune ve směru látky, která je přednostně stabilizována. Ke stabilizaci reaktantu nebo produktu může dojít kterýmkoli z těchto různých činidel nekovalentní interakce s rozpouštědlem, jako je H-vazba interakce dipól-dipól, van der Waalsovy interakce atd.
Acidobazické rovnováhy
Ionizační rovnováha kyseliny nebo zásady je ovlivněna změnou rozpouštědla. Účinek rozpouštědla není jen kvůli jeho kyselosti nebo zásaditosti, ale také kvůli jeho dielektrická konstanta a jeho schopnost přednostně solvatovat a tím stabilizovat určité druhy v acidobazických rovnováhách. Změna solvatační schopnosti nebo dielektrické konstanty tak může ovlivnit kyselost nebo zásaditost.
| Solventní | Dielektrická konstanta[2] |
|---|---|
| Acetonitril | 37 |
| Dimethylsulfoxid | 47 |
| Voda | 78 |
V tabulce výše je vidět, že voda je nejpolárnějším rozpouštědlem, následuje DMSO a potom acetonitril. Zvažte následující rovnováhu kyselé disociace:
- HA ⇌ A− + H+
Voda, která je nejpolárnějším rozpouštědlem uvedeným výše, stabilizuje ionizované látky ve větší míře než DMSO nebo acetonitril. Ionizace - a tedy kyselost - by byla největší ve vodě a menší v DMSO a acetonitrilu, jak je vidět v následující tabulce, která ukazuje pK.A hodnoty při 25 ° C pro acetonitril (ACN)[3][4][5] a dimethylsulfoxid (DMSO)[6] a voda.
| HA ⇌ A− + H+ | ACN | DMSO | voda |
|---|---|---|---|
| p- Kyselina toluensulfonová | 8.5 | 0.9 | silný |
| 2,4-dinitrofenol | 16.66 | 5.1 | 3.9 |
| Kyselina benzoová | 21.51 | 11.1 | 4.2 |
| Octová kyselina | 23.51 | 12.6 | 4.756 |
| Fenol | 29.14 | 18.0 | 9.99 |
Keto – enolové rovnováhy

Mnoho karbonyl sloučeniny vykazují keto – enol tautomerismus. Tento efekt je zvláště výrazný v 1,3-dikarbonyl sloučeniny, které tvoří vodíkově vázané enoly. The rovnovážná konstanta je závislá na polaritě rozpouštědla, s cis-enolová forma převládající při nízké polaritě a diketo forma převládající při vysoké polaritě. The intramolekulární H-vazba vytvořená v cis-enolová forma je výraznější, když pro ni neexistuje konkurence mezimolekulární H-vazba s rozpouštědlem. Výsledkem je, že rozpouštědla s nízkou polaritou, která se neúčastní vazby H, to umožňují cis-enolická stabilizace intramolekulární H-vazbou.
| Solventní | |
|---|---|
| Plynná fáze | 11.7 |
| Cyklohexan | 42 |
| Tetrahydrofuran | 7.2 |
| Benzen | 14.7 |
| Ethanol | 5.8 |
| Dichlormethan | 4.2 |
| Voda | 0.23 |
Účinky na rychlost reakce
Reaktivita a reakční mechanismy jsou často zobrazovány jako chování izolovaných molekul, ve kterých je rozpouštědlo považováno za pasivní podporu. Povaha rozpouštědla však může ve skutečnosti ovlivnit reakční rychlosti a pořadí chemické reakce.[7][8][9][10]
Provedení reakce bez rozpouštědla může ovlivnit rychlost reakce u reakcí s bimolekulární mechanismy, například maximalizací koncentrace reagencií. Kulové frézování je jedním z několika mechanochemické techniky, kde se k řízení reakcí používají fyzikální metody spíše než rozpouštědla, jsou metody ovlivňující reakce v nepřítomnosti rozpouštědla.
Rovnovážně-rozpouštědlové účinky
Rozpouštědla mohou ovlivňovat rychlosti prostřednictvím účinků rovnováhy a rozpouštědla, které lze vysvětlit na základě teorie přechodového stavu. V podstatě jsou reakční rychlosti ovlivněny diferenciálním solvatováním výchozího materiálu a přechodovým stavem rozpouštědlem. Když molekuly reaktantu přejdou do přechodového stavu, molekuly rozpouštědla se orientují tak, aby stabilizovaly přechodový stav. Pokud je přechodový stav stabilizován ve větší míře než výchozí materiál, probíhá reakce rychleji. Pokud je výchozí materiál stabilizovaný ve větší míře než přechodový stav, probíhá reakce pomaleji. Taková diferenciální solvatace však vyžaduje rychlou reorientační relaxaci rozpouštědla (z orientace přechodového stavu zpět do orientace základního stavu). Účinky rovnováhy a rozpouštědla jsou tedy pozorovány u reakcí, které mají tendenci mít ostré bariéry a slabě dipolární, rychle uvolňující rozpouštědla.[7]
Třecí rozpouštědlové efekty
Rovnovážná hypotéza nestojí za velmi rychlými chemickými reakcemi, při nichž se teorie přechodového stavu rozpadá. V takových případech zahrnujících silně dipolární, pomalu uvolňující rozpouštědla nehraje solvatace přechodného stavu při ovlivňování reakční rychlosti příliš velkou roli. Místo toho dynamické příspěvky rozpouštědla (např tření, hustota, vnitřní tlak, nebo viskozita ) hrají velkou roli při ovlivňování reakční rychlosti.[7][10]
Hughes – Ingoldova pravidla
Vliv rozpouštědla na eliminační a nukleofilní substituční reakce byl původně studován britskými chemiky Edward D. Hughes a Christopher Kelk Ingold.[11] Pomocí jednoduchého modelu solvatace, který zohledňoval pouze čisté elektrostatické interakce mezi ionty nebo dipolárními molekulami a rozpouštědly v počátečních a přechodných stavech, byly všechny nukleofilní a eliminační reakce organizovány do různých typů nábojů (neutrální, kladně nabitý nebo záporně nabitý).[7]Hughes a Ingold poté učinili určité předpoklady o rozsahu solvatace, který lze očekávat v těchto situacích:
- zvyšující se velikost náboje zvýší solvataci
- rostoucí delokalizace sníží solvataci
- ztráta náboje sníží solvataci více než rozptyl náboje [7]
Použitelný účinek těchto obecných předpokladů je uveden v následujících příkladech:
- Zvýšení polarity rozpouštědla zrychluje rychlosti reakcí, kdy se v aktivovaném komplexu vyvíjí náboj z neutrálního nebo slabě nabitého reaktantu
- Zvýšení polarity rozpouštědla snižuje rychlost reakcí, kde je v aktivovaném komplexu menší náboj ve srovnání s výchozími materiály
- Změna polarity rozpouštědla bude mít malý nebo žádný účinek na rychlost reakce, pokud je malý nebo žádný rozdíl v náboji mezi reaktanty a aktivovaným komplexem.[7]
Příklady reakcí
Substituční reakce
Rozpouštědlo použité v substituční reakce ze své podstaty určuje nukleofilitu nukleofil; tato skutečnost je stále zřetelnější, protože v plynné fázi probíhá více reakcí.[12] Podmínky rozpouštědla jako takové významně ovlivňují výkon reakce s určitými podmínkami rozpouštědla, které upřednostňují jeden reakční mechanismus před druhým. Pro SN1 reakce schopnost rozpouštědla stabilizovat meziprodukt karbokace má přímý význam pro jeho životaschopnost jako vhodného rozpouštědla. Schopnost polárních rozpouštědel zvyšovat rychlost SN1 reakce je výsledkem solárního působení meziproduktu reaktantu, tj. Karbokace, polárním rozpouštědlem, čímž se sníží mezilehlá energie vzhledem k výchozímu materiálu. V následující tabulce jsou uvedeny relativní rychlosti solvolýzy tert-butylchlorid s octová kyselina (CH3CO2H), methanolu (CH3OH) a voda (H2Ó).
| Solventní | Dielektrická konstanta, ε | Relativní sazba |
|---|---|---|
| CH3CO2H | 6 | 1 |
| CH3ACH | 33 | 4 |
| H2Ó | 78 | 150,000 |
Důvod pro SN2 reakce je zcela odlišná, protože nedostatek solvatace na nukleofilu zvyšuje rychlost SN2 reakce. V obou případech (SN1 nebo S.N2), schopnost buď stabilizovat přechodový stav (SN1) nebo destabilizovat výchozí materiál reaktantu (SN2) působí na snížení ΔG‡aktivace a tím zvýšit rychlost reakce. Tento vztah je podle rovnice ΔG = –RT ln K (Gibbsova volná energie ). Míra rovnice pro SN2 reakce jsou bimolekulární být prvním řádem v Nucleophile a prvním řádem v Reagent. Rozhodující faktor, když oba SN2 a SN1 reakční mechanismy jsou životaschopné, je síla nukleofilu. Nuclephilicita a bazicita jsou spojeny a čím více se nukleofilní molekula stává, tím větší je bazicita uvedeného nukleofilu. Toto zvýšení zásaditosti způsobuje SN2 reakční mechanismy, když je zvolené rozpouštědlo protické. Protická rozpouštědla reagují se silnými nukleofily s dobrým základním charakterem způsobem kyselina / báze, čímž se snižuje nebo odstraňuje nukleofilní povaha nukleofilu. Následující tabulka ukazuje účinek polarity rozpouštědla na relativní rychlosti reakce SN2 reakce 1-brombutan s azid (N3–). Při přechodu z protického rozpouštědla na aprotické rozpouštědlo je znatelné zvýšení reakční rychlosti. Tento rozdíl vyplývá z acidobazických reakcí mezi protickými rozpouštědly (nikoli aprotickými rozpouštědly) a silnými nukleofily. I když je to pravda sterické účinky ovlivnit také relativní rychlost reakce,[13] pro demonstraci principu polarity rozpouštědla na SN2 reakční rychlosti, sterické účinky mohou být zanedbávány.
| Solventní | Dielektrická konstanta, ε | Relativní sazba | Typ |
|---|---|---|---|
| CH3ACH | 33 | 1 | Protic |
| H2Ó | 78 | 7 | Protic |
| DMSO | 49 | 1,300 | Aprotické |
| DMF | 37 | 2800 | Aprotické |
| CH3CN | 38 | 5000 | Aprotické |
Srovnání SN1 až SN2 reakce jsou vpravo. Vlevo je SN1 reakční souřadnicový diagram. Všimněte si poklesu ΔG‡aktivace pro reakční podmínky polární rozpouštědlo. To vyplývá ze skutečnosti, že polární rozpouštědla stabilizují tvorbu karbokationtového meziproduktu ve větší míře než nepolární podmínky rozpouštědla. To je patrné v ΔEA, ΔΔG‡aktivace. Vpravo je SN2 reakční souřadnicový diagram. Všimněte si sníženého ΔG‡aktivace pro nepolární rozpouštědlové reakční podmínky. Polární rozpouštědla stabilizují reaktanty ve větší míře než nepolární rozpouštědlové podmínky solvatací záporného náboje na nukleofilu, čímž je méně dostupná reakce s elektrofilem.

Reakce katalyzované přechodným kovem
Reakce zahrnující komplexy nabitých přechodových kovů (kationtové nebo aniontové) jsou dramaticky ovlivněny solvatací, zejména v polárních médiích. Byly vypočteny změny 30-50 kcal / mol na povrchu potenciální energie (aktivační energie a relativní stabilita), pokud se během chemické transformace změnil náboj kovových druhů.[14]
Syntézy volných radikálů
Mnoho syntéz na bázi volných radikálů ukazuje velké kinetické rozpouštědlové efekty, které mohou snížit rychlost reakce a způsobit, že plánovaná reakce bude následovat nežádoucí dráhu.[15]
Reference
- ^ Eric V. Anslyn; Dennis A. Dougherty (2006). Moderní fyzikální organická chemie. University Science Books. ISBN 978-1-891389-31-3.
- ^ Loudon, G. Marc (2005), Organická chemie (4. vydání), New York: Oxford University Press, s. 317–318, ISBN 0-19-511999-1
- ^ Kütt A, Movchun V, Rodima T, Dansauer T, Rusanov EB, Leito I, Kaljurand I, Koppel J, Pihl V, Koppel I, Ovsjannikov G, Toom L, Mishima M, Medebielle M, Lork E, Röschenthaler GV, Koppel IA , Kolomeitsev AA (2008). „Pentakis (trifluormethyl) fenyl, skupina, která je stericky přeplněná a odnímající elektrony: Syntéza a kyselost pentakis (trifluormethyl) benzenu, -toluenu, fenolu a -anilinu“. J. Org. Chem. 73 (7): 2607–2620. doi:10.1021 / jo702513w. PMID 18324831.
- ^ Kütt, A .; Leito, I .; Kaljurand, I .; Sooväli, L .; Vlasov, V.M .; Yagupolskii, L.M .; Koppel, I.A. (2006). „Komplexní samo-konzistentní spektrofotometrická stupnice kyselosti neutrálních kyselin Brønstedových v acetonitrilu“. J. Org. Chem. 71 (7): 2829–2838. doi:10.1021 / jo060031y. PMID 16555839.
- ^ Kaljurand I, Kütt A, Sooväli L, Rodima T, Mäemets V, Leito I, Koppel IA (2005). „Rozšíření samo-konzistentní spektrofotometrické stupnice bazicity v acetonitrilu na celé rozpětí 28 pKa jednotek: sjednocení různých stupnic bazicity“. J. Org. Chem. 70 (3): 1019–1028. doi:10.1021 / jo048252w. PMID 15675863.
- ^ „Tabulka Bordwell pKa (kyselost v DMSO)“. Citováno 2008-11-02.
- ^ A b C d E F Reichardt, Christian (1990). Účinky rozpouštědel v organické chemii. Marburg, Německo: Wiley-VCH. 147–181. ISBN 0-89573-684-5.
- ^ Jones, Richard (1984). Fyzikální a mechanická organická chemie. Cambridge: Cambridge University Press. str. 94–114. ISBN 0-521-22642-2.
- ^ James T. Hynes (1985). "Dynamika chemické reakce v roztoku". Annu. Rev. Phys. Chem. 36 (1): 573–597. Bibcode:1985ARPC ... 36..573H. doi:10.1146 / annurev.pc.36.100185.003041.
- ^ A b Sundberg, Richard J .; Carey, Francis A. (2007). Pokročilá organická chemie: Struktura a mechanismy. New York: Springer. str.359 –376. ISBN 978-0-387-44897-8.
- ^ Hughes, Edward D .; Ingold, Christopher K. (1935). "Mechanismus substituce na nasyceném atomu uhlíku. Část IV. Diskuse o ústavních a rozpouštědlových účincích na mechanismus, kinetiku, rychlost a orientaci substituce". J. Chem. Soc.: 244–255. doi:10.1039 / JR9350000244.
- ^ Eğe, Seyhan (2008). Struktura a reaktivita organické chemie. Houghton Mifflin Harcourt. ISBN 978-0-618-31809-4.
- ^ Yongho, Kim .; Cramer, Christopher J .; Truhlar, Donald G. (2009). "Sterické účinky a účinky rozpouštědla na S.N2 reakce “. J. Phys. Chem. A. 113 (32): 9109–9114. Bibcode:2009JPCA..113.9109K. doi:10.1021 / jp905429p. PMID 19719294.
- ^ V. P. Ananikov; D. G. Musaev; K. Morokuma (2001). „Katalytická aktivace trojných vazeb a redukce vazby vinyl-vinyl redukcí pomocí komplexů Pt (IV). Funkční studie hustoty“. Organometallics. 20 (8): 1652–1667. doi:10.1021 / om001073u.
- ^ Grzegorz Litwinienko; A. L. J. Beckwith; K.U. Ingold (2011). „Často přehlížený význam rozpouštědla v syntéze volných radikálů“. Chem. Soc. Rev. 40 (5): 2157–63. doi:10.1039 / C1CS15007C. PMID 21344074.

![{{ mathbf {K}}} _ {{ mathrm {T}}} = { frac {[cis-enol]} {[diketo]}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/e9921ac02a5c977cb96d9a14a8fd9ffe9794422f)