Diazo - Diazo

The diazo skupina je organický skupina skládající se ze dvou propojených dusík atomy (azo ) v koncové poloze. Celkový náboj neutrální organické sloučeniny obsahující diazo skupinu vázanou na atom uhlíku se nazývají diazo sloučeniny nebo diazoalkany[1] a jsou popsány obecným strukturním vzorcem R2C = N+= N–. Nejjednodušší příklad diazo sloučeniny je diazomethan, CH2N2. Diazo sloučeniny (R.2C = N2) by neměla být zaměňována s azosloučeniny typu R-N = N-R nebo s diazoniové sloučeniny typu R-N2+.
Struktura
The elektronická struktura diazosloučenin se vyznačuje π elektronovou hustotou delokalizovanou na α-uhlíku a dvěma atomy dusíku, spolu s ortogonálním π systémem s elektronovou hustotou delokalizovanou pouze na terminálních atomech dusíku. Protože všechno oktetové pravidlo -uspokojivé rezonanční formy diazo sloučenin mají formální náboje, jsou členy třídy sloučenin známých jako 1,3-dipóly. Některé z nejstabilnějších diazosloučenin jsou a-diazo-p-diketony a a-diazo-p-diestery, ve kterých se elektronová hustota dále delokalizuje na karbonylovou skupinu přitahující elektrony. Naproti tomu většina diazoalkanů bez substituentů přitahujících elektrony, včetně samotného diazomethanu, je výbušná. Komerčně relevantní diazo sloučenina je ethyl diazoacetát (N2CHCOOEt). Skupina izomerních sloučenin s pouze několika podobnými vlastnostmi je diaziriny, kde uhlík a dva dusíky jsou spojeny jako kruh.
Čtyři rezonanční struktury lze nakreslit:[2]
Sloučeniny s diazo skupinou by měly být odlišeny od diazonium - sloučeniny, které mají stejnou koncovou azoskupinu, ale nesou celkový kladný náboj, a - azo sloučeniny, ve kterých azoskupina přemosťuje dva organické substituenty.
Dějiny
Diazo sloučeniny byly nejprve vyrobeny Peter Griess který objevil všestrannou novou chemickou reakci, jak je podrobně popsáno v jeho článku z roku 1858 „Předběžné oznámení o vlivu kyseliny dusité na aminonitro- a aminodinitrofenol.“[3][4]
Syntéza
Existuje několik způsobů přípravy diazo sloučenin.[5][6]
Z aminů
Alfa-akceptorem substituovaná primární alifatická aminy R-CH2-NH2 (R = COOR, CN, CHO, COR) reagují s kyselina dusitá k vytvoření diazo sloučeniny.
Z diazomethylových sloučenin
Příklad elektrofilní substituce použití diazomethylové sloučeniny je reakce reakce mezi acylhalogenid a diazomethan,[7] například první krok v Syntéza Arndt-Eistert.
Převodem diazo
v přenos diazo určitý uhlíkové kyseliny reagovat s tosylazid v přítomnosti slabé báze, jako je triethylamin nebo DBU. Vedlejším produktem je odpovídající tosylamid (p-toluensulfonamid). Tato reakce se také nazývá Transfer Regitz diazo.[8] Příkladem je syntéza terc-butyl diazoacetátu[9] a diazomalonát.[10] Methyl fenyldiazoacetát se vytváří tímto způsobem zpracováním methylfenylacetátu s p-acetamidobenzensulfonylazidem v přítomnosti báze.[11][12]

Tento mechanismus zahrnuje útok enolátu na terminální dusík, přenos protonů a vyloučení anionu sulfonamidu. Použití p-karbonyldehydu vede k deformylativní variantě Regitzova přenosu, která je užitečná pro přípravu diazosloučenin stabilizovaných pouze jednou karbonylovou skupinou.[14]

Z N-alkyl-N-nitroso sloučeniny
Diazo sloučeniny lze získat v eliminační reakce z N-alkyl-N-nitroso sloučeniny,[15] jako například při syntéze diazomethanu z Diazaldu nebo MNNG:
(Zde zobrazený mechanismus je jednou z možností.[16] Pro alternativní mechanismus analogické tvorby diazomethanu z an N-nitrososulfonamid, viz stránka na Diazald.)
Z hydrazonů
Hydrazony jsou oxidovaný (dehydrogenace ) například s oxid stříbrný nebo oxid rtuťnatý například syntéza 2-diazopropan z aceton hydrazonu.[17] Další oxidační činidla jsou tetraacetát olovnatý, oxid manganičitý a Swernovo činidlo. Tosyl hydrazony RRC = N-NHT reagují například s bází triethylamin při syntéze krotyl diazoacetátu[18] a při syntéze fenyldiazomethan z PhCHNHT a methoxid sodný.[19]
Reakce a karbonyl skupina s hydrazin 1,2-bis (terc-butyldimethylsilyl) hydrazin za vzniku hydrazonu následuje reakce s jod difluorjodbenzen poskytuje diazo sloučeninu:[20][21]
Z azidů
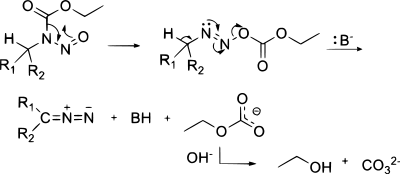
Je popsán jeden způsob syntézy diazo sloučenin z azidy použitím fosfiny:[22]
Reakce
V cykloadicích
Diazo sloučeniny reagují jako 1,3-dipoly v diazoalkan 1,3-dipolární cykloadice.
Jako prekurzory karbenu
Diazo sloučeniny se používají jako prekurzory karbeny, které jsou generovány termolýzou nebo fotolýzou, například v Wolff přesmyk. Jako takové se používají v cyklopropanace například při reakci ethyl diazoacetát s styren.[23] Určité diazosloučeniny se mohou tvořit alkeny ve formálním dimerizace karbenu reakce.
Diazosloučeniny jsou meziprodukty v Bamford-Stevensova reakce z tosylhydrazony na alkeny, opět s karbenovým meziproduktem:
V Doyle-Kirmseova reakce určité diazosloučeniny reagují s allylsulfidy na homoallylsulfid. Intramolekulární reakce diazokarbonylových sloučenin poskytují přístup k cyklopropanům. V Rozšíření Buchnerova prstenu diazo sloučeniny reagují s aromatickými kruhy s expanzí kruhu.
Jako nukleofil
The Buchner-Curtius-Schlotterbeckova reakce poskytuje ketony z aldehydů a alifatických diazosloučenin:
Typ reakce je nukleofilní adice.
Výskyt v přírodě
Skupinu diazo tvoří dvě rodiny přirozeně se vyskytujících produktů: kinamycin a lomaiviticin. Tyto molekuly jsou interkalátory DNA, jejichž „hlavicemi“ jsou diazofunkčnost. Ztráta N2indukovaný reduktivně generuje fluorenylový radikál štěpící DNA.
Viz také
Reference
- ^ Termín diazoalkan používají někteří autoři k označení jakéhokoli substituovaného diazomethanu (tj. Všech diazo sloučenin). Jiní autoři však tento termín používají k označení výlučně diazosloučenin s alkylovými substituenty, které neobsahují jiné funkční skupiny (což by vylučovalo sloučeniny jako diazo (difenyl) methan nebo ethyl diazoacetát).
- ^ Carey R.J. Sundberg Pokročilá organická chemie, 2. vydání
- ^ Trevor I. Williams, „Griess, (Johann) Peter (1829–1888)“, Oxfordský slovník národní biografie, Oxford University Press, 2004
- ^ Peter Griess (1858) „Vorläufige Notiz über die Einwirkung von salpetriger Säure auf Amidinitro- und Aminitrophenylsäure,“ (Předběžné oznámení o reakci kyseliny dusité s kyselinou pikramovou a aminonitrofenolem), Annalen der Chemie und Pharmacie, 106 : 123-125.
- ^ March, Jerry (1985), Pokročilá organická chemie: reakce, mechanismy a struktura (3. vyd.), New York: Wiley, ISBN 0-471-85472-7
- ^ Nové syntézy diazolových sloučenin Gerhard Maas Angew. Chem. Int. Vyd. 2009, 48, 8186 – 8195 doi:10.1002 / anie.200902785
- ^ Příklad Organické syntézy, Sb. Sv. 3, str. 119 (1955); Sv. 26, s. 13 (1946).Odkaz
- ^ M. Regitz, Angew. Chem., 79, 786 (1967); Angew. Chem. Internovat. Vyd. Engl., 6, 733 (1967).
- ^ Organic Syntheses, Coll. Sv. 5, str. 179 (1973); Sv. 48, str. 36 (1968). Odkaz
- ^ Organic Syntheses, Coll. Sv. 6, str. 414 (1988); Sv. 59, str. 66 (1979). Odkaz
- ^ Huw M. L. Davies; Wen-hao Hu; Dong Xing (2015). "Methyl fenyldiazoacetát". EEROS: 1–10. doi:10.1002 / 047084289X.rn00444.pub2. ISBN 9780470842898.
- ^ Selvaraj, Ramajeyam; Chintala, Srinivasa R .; Taylor, Michael T .; Fox, Joseph M. (2014). „3-Hydroxymethyl-3-fenylcyklopropen“. Org. Synth. 91: 322. doi:10.15227 / orgsyn.091.0322.
- ^ Shishkov, I. V .; Rominger, F .; Hofmann, P. (2009). "Pozoruhodně stabilní měď (I) a-karbonylové karbeny: syntéza, struktura a mechanické studie alkenových cyklopropanačních reakcí". Organometallics. 28 (4): 1049–1059. doi:10.1021 / om8007376.
- ^ Kurti, Laszlo (2005). Strategické aplikace pojmenovaných reakcí v organické syntéze: pozadí a podrobné mechanismy. Czako, Barbara. Burlington: Elsevier Science. ISBN 9780080575414. OCLC 850164343.
- ^ Příklad: Organic Syntheses, Coll. Sv. 6, str. 981 (1988); Sv. 57, str. 95 (1977). Odkaz
- ^ Chemie diazoniových a diazo skupin. Část 1. Patai, Saul., Wiley InterScience (služba online). Chichester: Wiley. 1978. ISBN 9780470771549. OCLC 501316965.CS1 maint: ostatní (odkaz)
- ^ Organic Syntheses, Coll. Sv. 6, str. 392 (1988); Sv. 50, str. 27 (1970). Odkaz
- ^ Organic Syntheses, Coll. Sv. 5, str. 258 (1973); Sv. 49, str. 22 (1969). Odkaz
- ^ Organic Syntheses, Coll. Sv. 7, str. 438 (1990); Sv. 64, str. 207 (1986).http://www.orgsyn.org/orgsyn/prep.asp?prep=CV7P0438
- ^ Lei, X .; Porco Ja, J. (2006). "Celková syntéza diazobenzofluorenového antibiotika (-) - kinamycinu C1". Journal of the American Chemical Society. 128 (46): 14790–14791. doi:10.1021 / ja066621v. PMID 17105273.
- ^ Nepolapitelný přírodní produkt je syntetizován Stu Borman Chemické a technické novinky 31. října 2006 Odkaz Archivováno 2008-08-28 na Wayback Machine.
- ^ Fosfinem zprostředkovaná konverze azidů na diazosloučeniny Eddie L. Myers a Ronald T. Raines Angew. Chem. Int. Vyd. 2009, 48, 2359 –2363 doi:10.1002 / anie.200804689
- ^ Organic Syntheses, Coll. Sv. 6, str. 913 (1988); Sv. 50, str. 94 (1970).Odkaz