Terc-butyloxykarbonylová chránící skupina - Tert-Butyloxycarbonyl protecting group
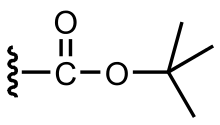
The tert-butyloxykarbonylová chránící skupina nebo tert-butoxykarbonylová chránící skupina[1] (Skupina BOC) je chránící skupina použito v organická syntéza.
Skupinu BOC lze přidat do skupiny amin za vodných podmínek za použití di-tert-butyldikarbonát v přítomnosti základny, jako je uhličitan sodný (kalcinovaná soda):

Ochranu aminu lze také dosáhnout v acetonitril řešení pomocí 4-dimethylaminopyridin (DMAP) jako základna.
Odstranění BOC v aminokyseliny lze dosáhnout silnými kyselinami, jako je kyselina trifluoroctová v dichlormethan, nebo s HCl v methanolu.[2][3][4] Komplikací může být tendence t-butyl kation meziprodukt k alkylaci dalších nukleofilů; mrchožrouti jako např anisol nebo thioanisol může být použit.[5][6]Selektivní štěpení N-Boc skupina v přítomnosti dalších chránících skupin je možná při použití AlCl3.
Postupné zacházení s trimethylsilyljodid pak může být pro deprotekci Boc použit také methanol,[7][8] zvláště tam, kde jsou jiné metody deprotekce pro substrát příliš tvrdé.[9] Mechanismus zahrnuje silylaci karbonylového kyslíku a eliminaci tert-butyljodid (1), methanolýza silylesteru do kyselina karbamová (2) a nakonec dekarboxylace na amin (3).[10]
- R2Poddůstojník2tBu + Me3SiI → R2Poddůstojník2SiMe3 + tBuI
(1)
- R2Poddůstojník2SiMe3 + MeOH → R2Poddůstojník2H + MeOSiMe3
(2)
- R2Poddůstojník2H → R2NH + CO2
(3)
Ochrana proti aminům

The tert-butyloxykarbonyl (Boc) skupina se používá jako a chránící skupina pro aminy v organická syntéza.
Běžné metody ochrany aminů
- Jednoduché rychlé míchání směsi aminu a di-tert-butyldikarbonát (Boc.)2O) suspendován ve vodě při teplotě okolí, příklad an reakce na vodě.[11]
- Zahřívání směsi aminu, který má být chráněn, a di-tert-butyldikarbonát v tetrahydrofuran (THF) při 40 ° C[12]
- Přidejte amin do hydroxid sodný a di-tert-butyl dikarbonát ve vodě a THF při 0 ° C, poté zahřát na teplotu okolí.[13]
- Zahřívání směsi aminu, který má být chráněn, a di-tert-butyl dikarbonát ve dvoufázové směsi chloroformu a vodného hydrogenuhličitanu sodného pod zpětným chladičem po dobu 90 minut.[14]
- Přidejte amin do di-tert-butyldikarbonát, 4-dimethylaminopyridin (DMAP) a acetonitril (MeCN) při teplotě okolí[15]
Aminy chráněné BOC se připraví za použití činidla di-tert-butyl-iminodikarboxylát. Po deprotonaci poskytuje toto reakční činidlo dvojnásobně chráněný BOC zdroj NH−
2, který může být N-alkylovaný. Tento přístup je doplňkem k Gabriel syntéza aminů.
Běžné metody deprotekce aminu
- Smíchejte chráněné karbamát být zbaven ochrany 3 M kyselina chlorovodíková (HCl) v ethylacetát po dobu 30 minut při teplotě okolí[16]
- Karbamát se zahřeje ve směsi vodné kyseliny chlorovodíkové a toluen při 65 ° C[17]
- Rozpuštění požadované chráněné sloučeniny ve směsi 50/50 dichlormethan a kyselina trifluoroctová [18]
Reference
- ^ „Pravidla pro zkratku ochranných skupin“ (PDF). IUPAC. iupac.org. 2013.
- ^ Robert M. Williams; Peter J. Sinclair; Duane E. DeMong; Daimo Chen; Dongguan Zhai (2003). "Asymetrická syntéza N-tert-Butoxykarbonyl α-aminokyseliny. Syntéza (5S,6R)-4-tert-Butoxykarbonyl-5,6-difenylmorfolin-2-on (6-oxo-2,3-difenyl-, 1,1 -dimethylethylester kyseliny, (2-morfolinkarboxylové), (2S,3R)-)]". Organické syntézy. 80: 18. doi:10.15227 / orgsyn.080.0018.
- ^ E. A. Englund; H. N. Gopi; D. H. Appella (2004). „Efektivní syntéza sondy pro funkci proteinu: kyselina 2,3-diaminopropionová s ortogonálními ochrannými skupinami“. Org. Lett. 6 (2): 213–215. doi:10.1021 / ol0361599. PMID 14723531.
- ^ D. M. Shendage; R. Fröhlich; G. Haufe (2004). „Vysoce účinná stereokonzervativní amidace a deamidace α-aminokyselin“. Org. Lett. 6 (21): 3675–3678. doi:10.1021 / ol048771l. PMID 15469321.
- ^ Lundt, Behrend F .; Johansen, Nils L .; Vølund, Aage; Markussen, Jan (1978). "Odstranění t-Butyl a t-Butoxykarbonyl chránící skupiny kyselinou trifluoroctovou ". Int. J. Pept. Protein Res. 12 (5): 258–268. doi:10.1111 / j.1399-3011.1978.tb02896.x. PMID 744685.
- ^ Vommina V. Sureshbabu; Narasimhamurthy Narendra (2011). „Ochranné reakce“. V Andrew B. Hughes (ed.). Ochranné reakce, léčivá chemie, kombinatorická syntéza. Aminokyseliny, peptidy a proteiny v organické chemii. 4. Wiley-VCH. str. XVIII – LXXXIV. doi:10.1002 / 9783527631827.ch1. ISBN 9783527641574.
- ^ Richard S. Lott; Virander S. Chauhan; Charles H. Stammer (1979). "Trimethylsilyljodid jako činidlo blokující peptid". J. Chem. Soc., Chem. Commun. (11): 495–496. doi:10.1039 / C39790000495.
- ^ Olah, G; Narang, S. C. (1982). „Jodotrimethylsilan - univerzální syntetické činidlo“. Čtyřstěn. 38 (15): 2225–2277. doi:10.1016/0040-4020(82)87002-6.
- ^ Zhijian Liu; Nobuyoshi Yasuda; Michael Simeone; Robert A. Reamer (2014). "N-Boc metoda deprotekce a izolace pro ve vodě rozpustné zwitteriontové sloučeniny “. J. Org. Chem. 79 (23): 11792–11796. doi:10.1021 / jo502319z. PMID 25376704.
- ^ Michael E. Jung; Mark A. Lyster (1978). "Konverze alkylkarbamátů na aminy působením trimethylsilyljodidu". J. Chem. Soc., Chem. Commun. (7): 315–316. doi:10.1039 / C39780000315.
- ^ Chankeshwara, Sunay V .; Chakraborti, Asit K. (2006). „Chemoselektivní bez katalyzátorů N-terc-butyloxykarbonylace aminů ve vodě “. Org. Lett. 8 (15): 3259–3262. doi:10.1021 / ol0611191. PMID 16836380.
- ^ Wuts, Peter G. M .; Greene, Theodora W. (2006). „Ochrana pro aminoskupinu“. Greeneovy ochranné skupiny v organické syntéze (4. vydání). John Wiley & Sons. str. 696–926. doi:10.1002 / 9780470053485.ch7. ISBN 9780471697541.
- ^ Fachao Yan; Hanbing Liang; Jian Song; Jie Cui; Qing Liu; Sheng Liu; Ping Wang; Yunhui Dong; Hui Liu (2017). „Palladiem katalyzovaná cyklizace - Heckova reakce allenamidů: přístup k derivátům 3-methylen-5-fenyl-1,2,3,4-tetrahydropyridinu“. Org. Lett. 19 (1): 86–89. doi:10.1021 / acs.orglett.6b03364. PMID 27966983.
- ^ Tarbell, D. Stanley; Yamamoto, Yutaka; Papež, Barry M. (1972). "Nová metoda přípravy N-t-Butoxykarbonylové deriváty a odpovídající sirné analogy z di-t-Butyldikarbonát nebo di-t-Butyl-dithiol-dikarbonáty a aminokyseliny ". Proc. Natl. Acad. Sci. USA 69 (3): 730–732. Bibcode:1972PNAS ... 69..730T. doi:10.1073 / pnas.69.3.730. PMC 426545. PMID 16591972.
- ^ Englund, Ethan A .; Gopi, Hosahudya N .; Appella, Daniel H. (2004). „Efektivní syntéza sondy pro funkci proteinu: kyselina 2,3-diaminopropionová s ortogonálními ochrannými skupinami“. Org. Lett. 6 (2): 213–215. doi:10.1021 / ol0361599. PMID 14723531.
- ^ Stahl, Glenn L .; Walter, Roderich; Smith, Clark W. (1978). „Obecný postup pro syntézu mono-N-Acylované 1,6-diaminohexany “. J. Org. Chem. 43 (11): 2285–2286. doi:10.1021 / jo00405a045.
- ^ Prashad, Mahavir; Har, Denis; Hu, Bin; Kim, Hong-Yong; Girgis, Michael J .; Chaudhary, Apurva; Repič, Oljan; Blacklock, Thomas J .; Marterer, Wolfgang (2004). „Proces vývoje rozsáhlé syntézy TKA731: antagonista tachykininových receptorů“. Org. Process Res. Dev. 8 (3): 330–340. doi:10.1021 / op0341824.
- ^ „Boc deprotekce - TFA“.


