Homologační reakce - Homologation reaction - Wikipedia
A homologační reakce, také známý jako homologizace, je jakýkoli chemická reakce který převádí reaktant na dalšího člena homologní série. Homologní řada je skupina sloučenin, které se liší konstantní jednotkou, obvykle (-CH2-) skupina. Reaktanty procházejí a homologace když se zvýší počet opakovaných strukturních jednotek v molekulách. Nejběžnější homologační reakce zvyšují počet methylen (-CH2-) jednotky v nasyceném řetězci v molekule.[1] Například reakce aldehydy nebo ketony s diazomethan nebo methoxymethylenetrifenylfosfin dát další homolog v sérii.
Mezi příklady homologačních reakcí patří:
- Kiliani-Fischerova syntéza, kde aldose molekula je prodloužena třístupňovým procesem skládajícím se z:
- Nukleofilní přidání kyanidu na karbonylovou skupinu za vzniku a kyanohydrin
- Hydrolýza za vzniku a lakton
- Redukce za vzniku homologní aldózy
- Wittigova reakce aldehydu s methoxymethylenetrifenylfosfin, který produkuje homologní aldehyd.
- Arndt – Eistertova reakce je řada chemických reakcí určených k přeměně karboxylové kyseliny na homolog s vyšší karboxylovou kyselinou (tj. obsahuje jeden další atom uhlíku)
- Homologace esteru Kowalski, alternativa k syntéze Arndt-Eistert. Používá se k převodu β-aminoesterů z a-aminoesterů prostřednictvím ynolát středně pokročilí.[2]
- Homologace Seyferth – Gilbert ve kterém je aldehyd přeměněn na koncový alkin a poté hydrolyzován zpět na aldehyd.
Některé reakce zvyšují délku řetězce o více než jednu jednotku. Zvažují se například následující homologační reakce se dvěma uhlíky.
Redukce řetězu
Rovněž lze zkrátit délku řetězu:
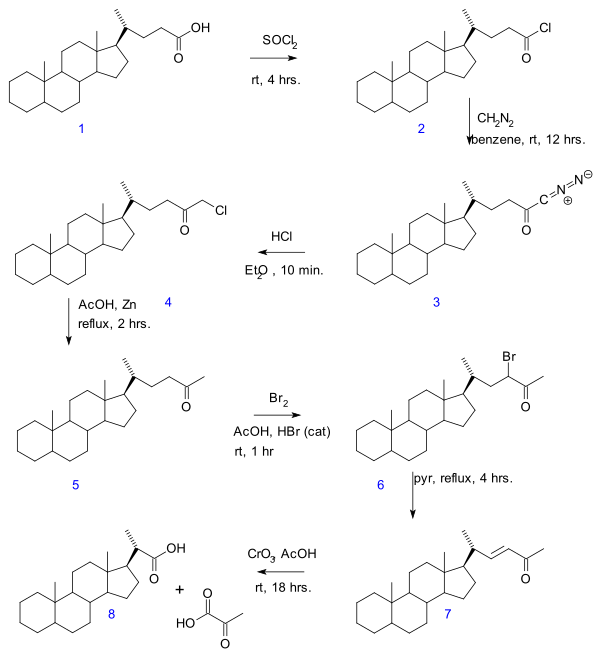
- V Gallagher – Hollanderova degradace (1946) kyselina pyrohroznová je odstraněn z lineární alifatické skupiny karboxylová kyselina čímž se získá nová kyselina o 2 atomy uhlíku méně.[3] Původní publikace se týká převodu žlučová kyselina v sérii reakcí: chlorid kyseliny (2) formace s thionylchlorid, diazoketon formace (3) s diazomethan, tvorba chlormethylketonu (4) s kyselina chlorovodíková, organická redukce chloru na methylketon (5), halogenace ketonu na 6, eliminační reakce s pyridin na enone 7 a nakonec oxidaci pomocí oxid chromitý na kyselina bisnorcholanová 8.
- V Hookerova reakce (1936) alkylový řetězec v jistém naftochinon (jev poprvé pozorován ve sloučenině lapachol ) se sníží o jednu methylen jednotka jako oxid uhličitý v každém manganistan draselný oxidace.[4][5]

- Mechanická oxidace způsobuje štěpení kruhu na alkenové skupině, vytlačování oxid uhličitý v dekarboxylace s následným uzavřením kroužku.
Viz také
Reference
- ^ Encyclopedia of Anorganic Chemistry doi:10.1002 / 0470862106.id396
- ^ D. Gray, C. Concellon a T. Gallagher (2004). „Homologace Kowalski Ester. Aplikace na syntézu β-aminoesterů“. J. Org. Chem. 69 (14): 4849–4851. doi:10.1021 / jo049562h. PMID 15230615.
- ^ Vincent P. Hollander a T. F. Gallagher ČÁSTEČNÁ SYNTÉZA SLOUČENIN TÝKAJÍCÍCH SE ADRENÁLNÍCH KORTICKÝCH HORMONŮ. VII. DEGRADACE BOČNÍHO ŘETĚZCE KYSELINY CHOLANOVÉ J. Biol. Chem., Mar 1946; 162: 549 - 554 Odkaz
- ^ O oxidaci 2-hydroxy-1,4-naftochinonových derivátů alkalickým manganistanem draselným Samuel C. Hooker J. Am. Chem. Soc. 1936; 58(7); 1174-1179. doi:10.1021 / ja01298a030
- ^ O oxidaci 2-hydroxy-1,4-naftochinonových derivátů alkalickým manganistanem draselným. Část II. Sloučeniny s nenasycenou stranou Řetězy Samuel C. Hooker a Al Steyermark J. Am. Chem. Soc. 1936; 58 (7); str. 1179 - 1181; doi:10.1021 / ja01298a031