Vznikající virus - Emergent virus - Wikipedia
An vznikající virus (nebo vznikající virus) je virus to je buď nově objevil se, zejména roste v výskyt /zeměpisný rozsah nebo má potenciál v blízké budoucnosti vzrůst.[1] Vznikající viry jsou hlavní příčinou vznikající infekční nemoci a zvednout veřejné zdraví vzhledem k jejich potenciálu způsobit globální výzvy ohniska nemoci, která může vést k epidemie a pandemie.[2] Stejně jako způsobení choroba mohou mít také závažné viry hospodářský Dopady.[3] Mezi nedávné příklady patří Koronaviry související se SARS, které způsobily Vypuknutí 2002-2004 z SARS (SARS-CoV-1 ) a Pandemie 2019–2020 z COVID-19 (SARS-CoV-2 ).[4][5] Mezi další příklady patří virus lidské imunodeficience Který způsobuje HIV / AIDS; viry odpovědné za Ebola;[6] the H5N1 virus chřipky odpovědný za ptačí chřipka;[7] a H1N1 / 09, který způsobil 2009 prasečí chřipka pandemický[8] (dřívější vznikající kmen z H1N1 způsobil 1918 Španělská chřipka pandemický).[9] Virový výskyt u lidí je často důsledkem zoonóza, který zahrnuje a mezidruhový skok a virové onemocnění do lidí z jiných zvířat. Protože zoonotické viry existují v zvířecí nádrže, jsou mnohem obtížnější vymýtit a může proto vyvolat přetrvávající infekce v lidské populaci.[10]
Vznikající viry by neměly být zaměňovány s nově se objevujícími viry nebo nově zjištěnými viry. Znovu se objevující virus je obecně považován za dříve objevený virus, který znovu zažívá,[1][11] například spalničky.[12] Nově detekovaný virus je dříve nerozpoznaný virus, který cirkuluje v druhu jako endemický nebo epidemický infekce.[13] Je možné, že unikly nově zjištěné viry klasifikace protože nezanechali žádný výrazný výraz stopy, a / nebo nemohly být izolovány nebo propagovány v buněčná kultura.[14] Mezi příklady patří lidský rhinovirus (hlavní příčina běžných nachlazení, která byla poprvé zjištěna v roce 1956),[15] hepatitida C. (nakonec identifikován v roce 1989),[16] a lidský metapneumovirus (poprvé popsáno v roce 2001, ale předpokládá se, že cirkuluje od 19. století).[17] Vzhledem k tomu, že detekce těchto virů je založena na technologii, je pravděpodobné, že se počet hlášených případů zvýší.
Zoonóza
Vzhledem k vzácnosti spontánního vývoje nových druhů virů je nejčastější příčinou vznikajících virů u lidí zoonóza. Odhaduje se, že tento jev představuje 73% všech objevující se nebo znovu se objevující patogeny, přičemž viry hrají nepřiměřeně velkou roli.[18] RNA viry jsou obzvláště časté a představují 37% nově se objevujících a znovu se objevujících patogenů.[18] Se zoonotickými viry je spojena široká škála zvířat - včetně volně žijících ptáků, hlodavců a netopýrů.[19] Není možné předpovědět konkrétní zoonotické události, které mohou být spojeny s konkrétním rezervoárem zvířat v daném okamžiku.[20]
Zoonotické přelévání může mít za následek samostatně omezené „slepé“ infekce, při nichž nedochází k žádnému dalšímu přenosu z člověka na člověka (jako u virus vztekliny ),[21] nebo v infekčních případech, kdy je zoonotický patogen schopen udržet přenos z člověka na člověka (jako u Virus ebola ).[6] Pokud je zoonotický virus schopen udržet úspěšný přenos z člověka na člověka, an nákaza může nastat.[22] Některé události přelévání mohou také vést k tomu, že se virus přizpůsobí výlučně lidské infekci (jak se stalo u virů) Virus HIV ),[23] v takovém případě se lidé stávají novým rezervoárem patogenu.
Úspěšný zoonotický „skok“ závisí na kontaktu člověka se zvířetem přechovávajícím variantu viru, která je schopna infikovat člověka. Za účelem překonání omezení rozsahu hostitele a udržení efektivního přenosu z člověka na člověka budou viry pocházející ze zvířecího rezervoáru obvykle procházet mutace, genetická rekombinace a sortiment.[20] Díky své rychlé replikaci a vysokým rychlostem mutací se RNA viry pravděpodobněji úspěšně adaptují na invazi do nové populace hostitele.[3]
Příklady živočišných zdrojů
Netopýři

Zatímco netopýři jsou základními členy mnoha ekosystémů,[24] jsou také často implikovány jako časté zdroje objevujících se virových infekcí.[25] Jejich imunitní systémy se vyvinuly takovým způsobem, aby potlačily jakékoli zánětlivá reakce virovým infekcím, což jim umožňuje stát se tolerantními hostiteli pro vyvíjející se viry a následně poskytovat hlavní rezervoáry zoonotických virů.[26] Jsou spojovány s více zoonotickými viry na hostitelský druh než kterýkoli jiný savec a molekulární studie prokázaly, že jsou přirozenými hostiteli několika vysoce profilovaných zoonotických virů, včetně těžké akutní respirační syndrom související s koronaviry a Ebola /Marburg hemoragická horečka filoviry.[27] Pokud jde o jejich potenciál pro případy přelévání, netopýři převzali vedoucí roli dříve přiřazenou hlodavcům.[26] Viry mohou být přenášeny z netopýrů několika mechanismy, včetně kousnutí netopýrů,[28] aerosolizace slin (např. během echolokace ) a výkaly / moč.[29]
Kvůli jejich odlišnosti ekologie / chování, netopýři jsou přirozeně náchylnější k virové infekci a přenosu. Několik druhů netopýrů (např. Hnědých netopýrů) se agreguje v přeplněných úkrytech, což podporuje intra- a mezidruhový přenos virů. Protože jsou netopýři rozšířeni v městských oblastech, navíc lidé občas zasahují do svých stanovišť, která jsou kontaminována guano a moč. Jejich schopnost létat a migrační vzorce také znamená, že netopýři jsou schopni šířit nemoci na velkou geografickou oblast a zároveň získávat nové viry.[30] Kromě toho netopýři zaznamenávají přetrvávající virové infekce, které spolu s extrémní životností (u některých druhů netopýrů je jejich délka života 35 let) pomáhá udržovat viry a přenášet je na jiné druhy. Mezi další vlastnosti netopýrů, které přispívají k jejich účinnosti jako virových hostitelů, patří: jejich výběr potravy, strnulost /hibernace návyky a náchylnost k reinfekci.[30]
Ovladače virového vývoje
Virový výskyt je často důsledkem obojího příroda a lidská činnost. Zejména, ekologické změny může výrazně usnadnit vznik a opětovný výskyt zoonotických virů.[31] Faktory jako odlesňování, opětovné zalesňování, fragmentace stanovišť a zavlažování všechny mohou ovlivnit způsoby, jakými lidé přicházejí do styku s divokými druhy zvířat, a následně podporovat výskyt virů.[3][32] Dodatečně, klimatická změna může ovlivnit ekosystémy a vektor distribuce, což může zase ovlivnit vznik vektorů přenášených virů. jiný ekologické změny - například zavádění druhů a ztráta predátorů - mohou také ovlivnit výskyt a prevalenci virů. Nějaký zemědělský praktiky, například intenzifikace hospodářských zvířat a nevhodné nakládání s fekcemi hospodářských zvířat, jsou také spojeny se zvýšeným rizikem zoonózy.[3][33]
Viry se mohou také objevit v důsledku usazování lidských populací, které jsou náchylné k infekci. Například virus se může objevit po ztrátě křížová ochrana imunity, ke kterému může dojít v důsledku ztráty divokého viru nebo ukončení očkování programy. Dobře rozvinuté země mají také vyšší podíl stárnoucí občané a onemocnění související s obezitou, což znamená, že jejich populace může být více potlačena imunosupresí, a proto jim hrozí riziko infekce.[3] Naproti tomu chudší národy mohou mít populace s oslabenou imunitou podvýživa nebo chronická infekce; tyto země také pravděpodobně nebudou mít stabilní programy očkování.[3] Navíc změny u člověka demografie[3] - například narození a / nebo migrace imunologicky naivních jedinců - může vést k rozvoji náchylné populace, která umožňuje rozsáhlou virovou infekci.
Mezi další faktory, které mohou podporovat virový vývoj, patří globalizace; zejména, mezinárodní obchod a lidské cestování /migrace může vést k zavlečení virů do nových oblastí.[3] Vzhledem k tomu, že hustě osídlená města podporují nekontrolovaný rychlý přenos patogenů urbanizace (tj. zvýšený pohyb a usazování jednotlivců v městské oblasti ) může podporovat virový vývoj.[34] Migrace zvířat může také vést ke vzniku virů, jak tomu bylo v případě virus západního Nilu který se šířil migrací populací ptáků.[35] Lidské praktiky týkající se výroby a spotřeby potravin mohou také přispět k riziku virového vývoje. Zejména, mokré trhy (tj. trhy se živými zvířaty) jsou ideálním prostředím pro přenos virů kvůli vysoké hustotě přítomných lidí a divokých / farmových zvířat.[29] Spotřeba keřové maso je také spojován s výskytem patogenů.[29]
Prevence
Kontrola a prevence zoonotických chorob závisí na vhodném globálním dohledu na různých úrovních, včetně identifikace nových patogenů, dohled nad veřejným zdravím (počítaje v to sérologické průzkumy ), a analýza rizik přenosu.[36] Složitost zoonotických událostí na celém světě predikuje multidisciplinární přístup k prevenci.[36] The Jeden model zdraví byla navržena jako globální strategie na prevenci vzniku zoonotických chorob u lidí, včetně nových virových onemocnění.[36] Koncept One Health si klade za cíl podporovat zdraví zvířat, lidí a životního prostředí, a to lokálně i globálně, podporou porozumění a spolupráce mezi odborníky z různých vzájemně souvisejících oborů, včetně biologie divočiny, veterinární věda, lék, zemědělství, ekologie, mikrobiologie, epidemiologie, a biomedicínské inženýrství.[36]
Virulence vznikajících virů
Jelikož jsou hostitelé imunologicky naivní vůči patogenům, s nimiž se dosud nesetkali, jsou nově se objevující viry extrémně vzácné virulentní pokud jde o jejich schopnost způsobit onemocnění. Jejich vysoká virulence je také způsobena nedostatečnou adaptací na nového hostitele; viry jsou obvykle silné selekční tlak na imunitní systém jejich přirozených hostitelů, což zase vyvíjí silný selekční tlak na viry.[37] Tento koevoluce znamená, že přirozený hostitel je schopen zvládnout infekci. Když však virus přeskočí na nového hostitele (např. Člověka), nový hostitel není schopen vypořádat se s infekcí kvůli nedostatku společné evoluce, což má za následek nesoulad mezi hostitelem imunoefektů a virus imunomodulátory.
Kromě toho, aby se maximalizoval přenos, viry často přirozeně procházejí útlumem (tj. virulence je snížena), aby infikovaná zvířata mohla přežít dostatečně dlouho, aby mohla účinněji infikovat ostatní zvířata.[38] Jelikož však dosažení útlumu vyžaduje čas, nové populace hostitelů nebudou z tohoto jevu zpočátku těžit. Kromě toho, jako zoonotické viry také přirozeně existují v zvířecí nádrže,[10] jejich přežití nezávisí na přenosu mezi novými hostiteli; to znamená, že je velmi nepravděpodobné, že by se nově vznikající viry oslabily za účelem maximálního přenosu a zůstaly virulentní.
I když jsou nově vznikající viry často vysoce virulentní, jsou omezeny několika faktory hostitele, včetně: imunita, přirozené protilátky a receptorová specificita. Pokud byl hostitel dříve infikován patogenem, který je podobný nově vznikajícímu viru, může z toho mít také prospěch hostitel křížová ochrana imunity.
Příklady vznikajících virů
Chřipka A
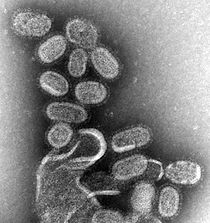
Chřipka je vysoce nakažlivá respirační infekce, která postihuje přibližně 9% světové populace a každoročně způsobuje 300 000 až 500 000 úmrtí.[39][40] Chřipkové viry jsou na základě svých hlavních proteinů klasifikovány do typů A, B, C a D.[41][42] Zatímco chřipka A i B mohou u lidí způsobit epidemii, chřipka A má také pandemický potenciál a vyšší míru mutací, proto je pro veřejné zdraví nejvýznamnější.[42][43]
Viry chřipky A se dále dělí na podtypy na základě kombinací povrchu glykoproteiny hemaglutinin (HA) a neuraminidáza (NA). Primárním přirozeným rezervoárem pro většinu podtypů chřipky A jsou divocí vodní ptáci;[42] prostřednictvím řady mutací se však malá podmnožina těchto virů přizpůsobila infekci lidí (a jiných zvířat).[44] Klíčovým determinantem toho, zda určitý podtyp chřipky A může infikovat člověka, je jeho vazebná specificita. Ptačí chřipka A se přednostně váže na receptory na buněčném povrchu s terminálním spojením α2,3 kyselina sialová, zatímco lidská chřipka A se přednostně váže na receptory buněčného povrchu terminální kyselinou sialovou vázanou na α2,6. Pomocí mutace některé viry ptačí chřipky A úspěšně změnily svou vazebnou specificitu z kyseliny sialové vázané na α2,3‐ až α2,6.[45] Aby se však viry ptačí chřipky mohly objevit u lidí, musí je také upravit RNA polymerázy pro funkci v savčích buňkách,[46] stejně jako mutace pro stabilitu v kyselém dýchacím traktu člověka.[47]
Následující přizpůsobování a hostitelský přepínač „Viry chřipky A mohou způsobit u lidí epidemie a pandemie. Drobné změny ve struktuře HA a NA (antigenní drift ) se vyskytují často, což umožňuje viru způsobit opakovaná ohniska (tj. sezónní chřipka ) vyhýbáním se imunitnímu rozpoznávání.[41] Hlavní změny ve struktuře HA a NA (antigenní posun ), které jsou způsobeny genetickým přeřazením mezi různými podtypy chřipky A (např. mezi podtypy lidí a zvířat), mohou místo toho způsobit velké regionální / globální pandemie.[41] V důsledku vzniku antigenně odlišných kmenů chřipky A u lidí došlo jen v 20. století ke čtyřem pandemím.[48]
Navíc, i když zvířecí viry chřipky A (např. prasečí chřipka ) se liší od lidských chřipkových virů, mohou u lidí stále způsobovat zoonotickou infekci. Tyto infekce jsou většinou získány po přímém kontaktu s infikovanými zvířaty nebo kontaminovaným prostředím, ale nevedou k účinnému přenosu z člověka na člověka; příklady tohoto zahrnují Chřipka H5N1 a Chřipka H7N9.[42]
SARS-CoV

V roce 2002 vysoce patogenní SARS-CoV Kmen (těžký akutní respirační syndrom Coronavirus) se vynořil ze zoonotické nádrže; přibližně 8 000 lidí bylo infikováno po celém světě a úmrtnost se u starších lidí přiblížila 50% nebo více.[49] Vzhledem k tomu, že SARS-CoV je nejvíce nakažlivými post-příznaky, zavedení přísných opatření v oblasti veřejného zdraví účinně zastavilo pandemii.[49] Za přirozeného hostitele rezervoáru pro SARS-CoV se považuje podkovy, ačkoli virus byl také identifikován u několika malých masožravců (např cibetky a mývalí psi ). Předpokládá se, že vznik SARS-CoV usnadnili čínské mokré trhy, na nichž cibety pozitivní na virus působily jako mezihostitelé a přenášeli SARS-CoV na člověka (a další druhy).[49][50] Novější analýza však naznačuje, že SARS-CoV mohl přímo vyskočit z netopýrů na člověka s následným křížovým přenosem mezi lidmi a cibetkami.[49]
V následujících situacích infikovat buněk, SARS-CoV používá hrotový povrch glykoprotein rozpoznat a vázat se na hostitele ACE-2, který používá jako buněčný vstupní receptor;[49] vývoj této charakteristiky byl zásadní pro umožnění SARS-CoV „skákat“ z netopýrů na jiné druhy.
MERS-CoV
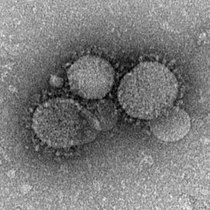
Poprvé hlášeno v roce 2012, MERS-CoV (Middle East Respiratory Syndrome Coronavirus) představuje druhé známé zavedení vysoce patogenního koronaviru ze zoonotické nádrže do člověka. Míra úmrtnosti tohoto vznikajícího viru je přibližně 35%, přičemž 80% všech případů hlásí Saúdská Arábie.[51] Ačkoli je pravděpodobné, že MERS-CoV pochází z netopýrů,[52] velbloudi velbloudi byli zapleteni jako pravděpodobní zprostředkující hostitelé. Předpokládá se, že MERS-CoV cirkuluje u těchto savců již více než 20 let,[52] a předpokládá se, že nové postupy chovu velbloudů přivedly přelévání MERS-CoV na člověka.[53] Studie prokázaly, že lidé mohou být infikováni MERS-CoV přímým nebo nepřímým kontaktem v infikovaných dromedárských velbloudech, zatímco přenos z člověka na člověka je omezen.[51]
MERS-CoV získává buněčný vstup pomocí povrchového proteinu špice k navázání na hostitele DPP4 povrchový receptor; základní subdoména tohoto povrchového proteinu s hroty sdílí podobnosti se subdoménou SARS-CoV, ale jeho subdoména vázající se na receptory (RBSD) se významně liší.[52]
Katarální horečka ovcí

Katarální horečka ovcí je neinfekční vektorový onemocnění způsobené virem katarální horečky ovcí, které postihuje druhy přežvýkavci (zejména ovce ).[54] Změna klimatu se podílí na vzniku a globálním šíření této choroby kvůli jejímu dopadu na distribuci vektorů. Přirozeným vektorem viru katarální horečky ovcí je africký midge C. imicola, která je obvykle omezena na Afriku a subtropickou Asii. Globální oteplování však rozšířilo geografický rozsah C. imicola, takže se nyní překrývá s jiným vektorem (C. pulcaris nebo C. obsoletus ) s mnohem geografičtějším rozsahem na sever. Tato změna umožnila viru katarální horečky ovcí přeskočit vektor, což způsobilo šíření katarální horečky ovcí na sever do Evropy.[55]
Viz také
- Biologická bezpečnost
- Vznikající infekční onemocnění
- Historie vznikajících infekčních nemocí
- Laboratorní biologická bezpečnost
- Virové kvazidruhy
Reference
- ^ A b Holland DJ (únor 1998). "Vznikající viry". Současné stanovisko v pediatrii. 10 (1): 34–40. doi:10.1097/00008480-199802000-00007. PMID 9529635.
- ^ Devaux CA (únor 2012). „Rozvíjející se a znovu se objevující viry: Globální výzva ilustrovaná vypuknutím viru Chikungunya“. World Journal of Virology. 1 (1): 11–22. doi:10.5501 / wjv.v1.i1.11. PMC 3782263. PMID 24175207.
- ^ A b C d E F G h Lindahl JF, Grace D (2015). „Důsledky lidské činnosti na rizika infekčních nemocí: přezkum“. Ekologie infekce a epidemiologie. 5: 30048. doi:10.3402 / tj. V5.30048. PMC 4663196. PMID 26615822.
- ^ Morens DM, Fauci AS (září 2020). „Vznikající pandemické nemoci: jak jsme se dostali k COVID-19“. Buňka. 182 (5): 1077–1092. doi:10.1016 / j.cell.2020.08.021. PMC 7428724. PMID 32846157.
- ^ Zheng J (2020). „SARS-CoV-2: vznikající koronavirus, který způsobuje globální hrozbu“. International Journal of Biological Sciences. 16 (10): 1678–1685. doi:10,7150 / ijbs.45053. PMC 7098030. PMID 32226285.
- ^ A b Holmes EC, Dudas G, Rambaut A, Andersen KG (říjen 2016). „Vývoj viru Ebola: Pohledy z epidemie 2013–2016“. Příroda. 538 (7624): 193–200. Bibcode:2016Natur.538..193H. doi:10.1038 / příroda1990. PMC 5580494. PMID 27734858.
- ^ Wei P, Cai Z, Hua J, Yu W, Chen J, Kang K a kol. (2016). „Bolesti a zisky z čínských zkušeností se vznikající epidemií: od SARS po H7N9“. BioMed Research International. 2016: 5717108. doi:10.1155/2016/5717108. PMC 4971293. PMID 27525272.
- ^ Smith GJ, Vijaykrishna D, Bahl J, Lycett SJ, Worobey M, Pybus OG a kol. (Červen 2009). „Počátky a evoluční genomika epidemie chřipky typu A H1N1 z roku 2009“. Příroda. 459 (7250): 1122–5. Bibcode:2009 Natur.459.1122S. doi:10.1038 / nature08182. PMID 19516283.
- ^ Taubenberger JK, Morens DM (leden 2006). „Chřipka 1918: matka všech pandemií“. Vznikající infekční nemoci. 12 (1): 15–22. doi:10.3201 / eid1201.050979. PMC 3291398. PMID 16494711.
- ^ A b Eidson M. "Zoonotické onemocnění". Britannica. Citováno 16. dubna 2020.
- ^ Miquel Porta, vyd. (2008). Slovník epidemiologie. Oxford University Press, USA. str. 78. ISBN 978-0-19-971815-3.
- ^ Fraser-Bell C (2019). „Globální znovuobjevení spalniček - aktualizace 2019“. Globální biologická bezpečnost. 1 (3). doi:10,31646 / gbio.43. ISSN 2652-0036.
- ^ Woolhouse M, Scott F, Hudson Z, Howey R, Chase-Topping M (říjen 2012). „Lidské viry: objev a vznik“. Filozofické transakce Královské společnosti v Londýně. Série B, Biologické vědy. 367 (1604): 2864–71. doi:10.1098 / rstb.2011.0354. PMC 3427559. PMID 22966141.
- ^ Leland DS, Ginocchio CC (leden 2007). „Úloha buněčné kultury pro detekci virů ve věku technologie“. Recenze klinické mikrobiologie. 20 (1): 49–78. doi:10.1128 / CMR.00002-06. PMC 1797634. PMID 17223623.
- ^ Kennedy JL, Turner RB, Braciale T, Heymann PW, Borish L (červen 2012). "Patogeneze rhinovirové infekce". Aktuální názor na virologii. 2 (3): 287–93. doi:10.1016 / j.coviro.2012.03.008. PMC 3378761. PMID 22542099.
- ^ Houghton M (Listopad 2009). „Dlouhá a klikatá cesta vedoucí k identifikaci viru hepatitidy C“. Journal of Hepatology. 51 (5): 939–48. doi:10.1016 / j.jhep.2009.08.004. PMID 19781804.
- ^ de Graaf M, Osterhaus AD, Fouchier RA, Holmes EC (prosinec 2008). "Evoluční dynamika lidských a ptačích metapneumovirů". The Journal of General Virology. 89 (Pt 12): 2933–2942. doi:10.1099 / vir.0.2008 / 006957-0. PMID 19008378.
- ^ A b Woolhouse ME, Gowtage-Sequeria S (prosinec 2005). „Rozsah hostitelů a objevující se a znovu se objevující patogeny“. Vznikající infekční nemoci. 11 (12): 1842–7. doi:10.3201 / eid1112.050997. PMC 3367654. PMID 16485468.
- ^ Kruse H, kirkemo AM, Handeland K (prosinec 2004). „Divoká zvěř jako zdroj zoonotických infekcí“. Vznikající infekční nemoci. 10 (12): 2067–72. doi:10.3201 / eid1012.040707. PMC 3323390. PMID 15663840.
- ^ A b Domingo E (2010). "Mechanismy virového vývoje". Veterinární výzkum. 41 (6): 38. doi:10.1051 / vetres / 2010010. PMC 2831534. PMID 20167200.
- ^ Baum SG (2008). „Zoonózy - s takovými přáteli, kdo potřebuje nepřátele?“. Transakce Americké klinické a klimatologické asociace. 119: 39–51, diskuse 51-2. PMC 2394705. PMID 18596867.
- ^ Parrish CR, Holmes EC, Morens DM, Park EC, Burke DS, Calisher CH a kol. (Září 2008). „Mezidruhový přenos virů a vznik nových epidemických chorob“. Recenze mikrobiologie a molekulární biologie. 72 (3): 457–70. doi:10.1128 / MMBR.00004-08. PMC 2546865. PMID 18772285.
- ^ ÚSTAV AIDS. „Odkud pochází HIV?“. ÚSTAV AIDS. ÚSTAV AIDS. Citováno 16. dubna 2020.
- ^ Národní vědecká nadace. „Noční život: Proč potřebujeme netopýry neustále - nejen na Halloween“. Národní vědecká nadace. Citováno 14. dubna 2020.
- ^ Shi Z (srpen 2013). „Vznikající infekční choroby spojené s viry netopýrů“. Věda Čína. Humanitní vědy. 56 (8): 678–82. doi:10.1007 / s11427-013-4517-x. PMC 7088756. PMID 23917838.
- ^ A b Subudhi S, Rapin N, Misra V (2019). „Modulace imunitního systému a perzistence virů u netopýrů: porozumění přelévání virů“. Viry. 11 (2). doi:10,3390 / v11020192. PMC 6410205. PMID 30813403.
- ^ O'Shea TJ, Cryan PM, Cunningham AA, Fooks AR, Hayman DT, Luis AD a kol. (Květen 2014). „Let netopýrů a zoonotické viry“. Vznikající infekční nemoci. 20 (5): 741–5. doi:10.3201 / eid2005.130539. PMC 4012789. PMID 24750692.
- ^ Wang LF, Anderson DE (únor 2019). „Viry u netopýrů a potenciální přelévání zvířat a lidí“. Aktuální názor na virologii. 34: 79–89. doi:10.1016 / j.coviro.2018.12.007. PMC 7102861. PMID 30665189.
- ^ A b C Kuzmin IV, Bozick B, Guagliardo SA, Kunkel R, Shak JR, Tong S, Rupprecht CE (červen 2011). „Netopýři, nově se objevující infekční nemoci a paradigma vztekliny se znovu objevili“. Časopis Emerging Health Threats. 4: 7159. doi:10,3402 / ehtj.v4i0.7159. PMC 3168224. PMID 24149032.
- ^ A b Calisher CH, Childs JE, Field HE, Holmes KV, Schountz T (červenec 2006). „Netopýři: důležití hostitelé nově vznikajících virů v rezervoáru“. Recenze klinické mikrobiologie. 19 (3): 531–45. doi:10.1128 / CMR.00017-06. PMC 1539106. PMID 16847084.
- ^ Woolhouse M, Gaunt E (2007). "Ekologický původ nových lidských patogenů". Kritické recenze v mikrobiologii. 33 (4): 231–42. doi:10.1080/10408410701647560. PMID 18033594. S2CID 19213392.
- ^ Penakalapati G, Swarthout J, Delahoy MJ, McAliley L, Wodnik B, Levy K, Freeman MC (říjen 2017). „Expozice živočišným výkalům a lidskému zdraví: Systematický přehled a navrhované priority výzkumu“. Věda o životním prostředí a technologie. 51 (20): 11537–11552. Bibcode:2017EnST ... 5111537P. doi:10.1021 / acs.est.7b02811. PMC 5647569. PMID 28926696.
- ^ Neiderud CJ (2015). „Jak urbanizace ovlivňuje epidemiologii vznikajících infekčních nemocí“. Ekologie infekce a epidemiologie. 5 (1): 27060. doi:10,3402 / tj. V5.27060. PMC 4481042. PMID 26112265.
- ^ Rappole JH, Derrickson SR, Hubálek Z (2000). „Stěhovaví ptáci a šíření viru západního Nilu na západní polokouli“. Vznikající infekční nemoci. 6 (4): 319–28. doi:10,3201 / eid0604,000401. PMC 2640881. PMID 10905964.
- ^ A b C d Rahman MT, Sobur MA, Islam MS a kol. (Září 2020). „Zoonotická onemocnění: etiologie, dopad a kontrola“. Mikroorganismy. 8 (9). doi:10,3390 / mikroorganismy8091405. PMID 32932606.
- ^ Domínguez-Andrés J, Netea MG (prosinec 2019). „Dopad historických migrací a evolučních procesů na lidskou imunitu“. Trendy v imunologii. 40 (12): 1105–1119. doi:10.1016 / j.it.2019.10.001. PMC 7106516. PMID 31786023.
- ^ Longdon B, Hadfield JD, Day JP, Smith SC, McGonigle JE, Cogni R a kol. (Březen 2015). „Příčiny a důsledky změn virulence po posunu patogenu hostitele“. PLOS patogeny. 11 (3): e1004728. doi:10.1371 / journal.ppat.1004728. PMC 4361674. PMID 25774803.
- ^ Clayville LR (říjen 2011). „Chřipková aktualizace: přehled aktuálně dostupných vakcín“. P & T. 36 (10): 659–84. PMC 3278149. PMID 22346299.
- ^ UNICEF. "Chřipka". UNICEF. Citováno 14. dubna 2020.
- ^ A b C Světová zdravotnická organizace. "Chřipka". Světová zdravotnická organizace. Citováno 13. dubna 2020.
- ^ A b C d Světová zdravotnická organizace. „Chřipka (ptačí a jiná zoonotická)“. SZO. Citováno 13. dubna 2020.
- ^ Centra pro kontrolu a prevenci nemocí (18. listopadu 2019). „Chřipka“. CDC. Citováno 13. dubna 2020.
- ^ Byrd-Leotis L, Cummings RD, Steinhauer DA (červenec 2017). „Souhra mezi hostitelským receptorem a chřipkovým virem hemaglutininem a neuraminidázou“. International Journal of Molecular Sciences. 18 (7): 1541. doi:10,3390 / ijms18071541. PMC 5536029. PMID 28714909.
- ^ Lewis DB (2006). "Ptačí chřipka na lidskou chřipku". Roční přehled medicíny. 57: 139–54. doi:10.1146 / annurev.med.57.121304.131333. PMID 16409141.
- ^ Long JS, Giotis ES, Moncorgé O, Frize R, Mistry B, James J a kol. (Leden 2016). „Druhový rozdíl v ANP32A je základem omezení hostitele polymerázy viru chřipky A“. Příroda. 529 (7584): 101–4. Bibcode:2016Natur.529..101L. doi:10.1038 / příroda16474. PMC 4710677. PMID 26738596.
- ^ Di Lella S, Herrmann A, Mair CM (červen 2016). „Modulace pH stability hemaglutininu chřipkového viru: strategie adaptace hostitelských buněk“. Biofyzikální deník. 110 (11): 2293–2301. Bibcode:2016BpJ ... 110.2293D. doi:10.1016 / j.bpj.2016.04.035. PMC 4906160. PMID 27276248.
- ^ Alexander DJ (2006). „Viry ptačí chřipky a lidské zdraví“. Vývoj v biologii. 124: 77–84. PMID 16447497.
- ^ A b C d E Bolles M, Donaldson E, Baric R (prosinec 2011). „SARS-CoV a emergentní koronaviry: virové determinanty mezidruhového přenosu“. Aktuální názor na virologii. 1 (6): 624–34. doi:10.1016 / j.coviro.2011.10.012. PMC 3237677. PMID 22180768.
- ^ Wang LF, Eaton BT (2007). „Netopýři, cibetky a vznik SARS“. Aktuální témata v mikrobiologii a imunologii. 315: 325–44. doi:10.1007/978-3-540-70962-6_13. ISBN 978-3-540-70961-9. PMC 7120088. PMID 17848070.
- ^ A b SZO. „Středního východu respirační syndrom coronavirus (MERS-CoV)“. SZO. Citováno 15. dubna 2020.
- ^ A b C Sharif-Yakan A, Kanj SS (prosinec 2014). „Vznik MERS-CoV na Středním východě: počátky, přenos, léčba a perspektivy“. PLOS patogeny. 10 (12): e1004457. doi:10.1371 / journal.ppat.1004457. PMC 4256428. PMID 25474536.
- ^ Farag E, Sikkema RS, Vinks T, Islam MM, Nour M, Al-Romaihi H a kol. (Prosinec 2018). „Ovladače vzniku MERS-CoV v Kataru“. Viry. 11 (1): 22. doi:10,3390 / v11010022. PMC 6356962. PMID 30602691.
- ^ Centrum pro bezpečnost potravin a veřejné zdraví, Iowa State University. „Katarální horečka ovcí“ (PDF). CFSPH. Citováno 14. dubna 2020.
- ^ Purse BV, Mellor PS, Rogers DJ, Samuel AR, Mertens PP, Baylis M (únor 2005). „Změna klimatu a nedávný výskyt katarální horečky ovcí v Evropě“. Recenze přírody. Mikrobiologie. 3 (2): 171–81. doi:10.1038 / nrmicro1090. PMID 15685226. S2CID 62802662.
Další čtení
- Artika IM, Ma'roef CN (květen 2017). „Laboratorní biologická bezpečnost pro zacházení s objevujícími se viry“. Asian Pacific Journal of Tropical Biomedicine. 7 (5): 483–491. doi:10.1016 / j.apjtb.2017.01.020. PMC 7103938. PMID 32289025.
externí odkazy
- „Vznikající viry“. Mikrobiologie Bytes. 2007. Archivovány od originál dne 2007-02-24.
- „Národní centrum pro vznikající a zoonotické infekční nemoci (NCEZID)“.
